[苏]必修一:《氧化还原1》
图片预览








文档简介
课件33张PPT。专题二 氧化还原反应
第一课时 思考与交流1.请举几个氧化反应和还原反应的实例,讨论并
交流这类化学反应的分类标准是什么?
2.氧化反应和还原反应是分别独立进行的吗?
1.CuO+H2 Cu+H2O,从CuO来看是 反应,从H2来看是 反应。
2.CO2+C 2CO,从CO2来看 是 反应,从C来看是 反应。
3.C+H2O CO+H2,从C来看是 反应,从H2O来看是 反应。
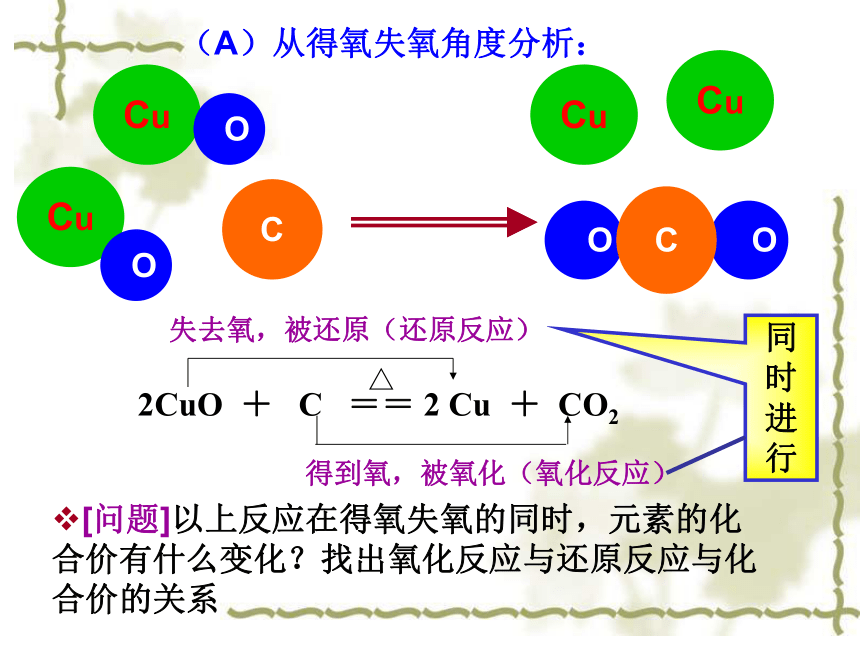
还原氧化氧化还原还原氧化氧化反应和还原反应一定是同时发生!一种物质被氧化,同时另一种物质被还原的反应,叫做氧化还原反应。 (A)从得氧失氧角度分析:Cu OCuC O OCCu OCu得到氧,被氧化(氧化反应)△2CuO + C == 2 Cu + CO2 失去氧,被还原(还原反应)[问题]以上反应在得氧失氧的同时,元素的化合价有什么变化?找出氧化反应与还原反应与化合价的关系同
时
进
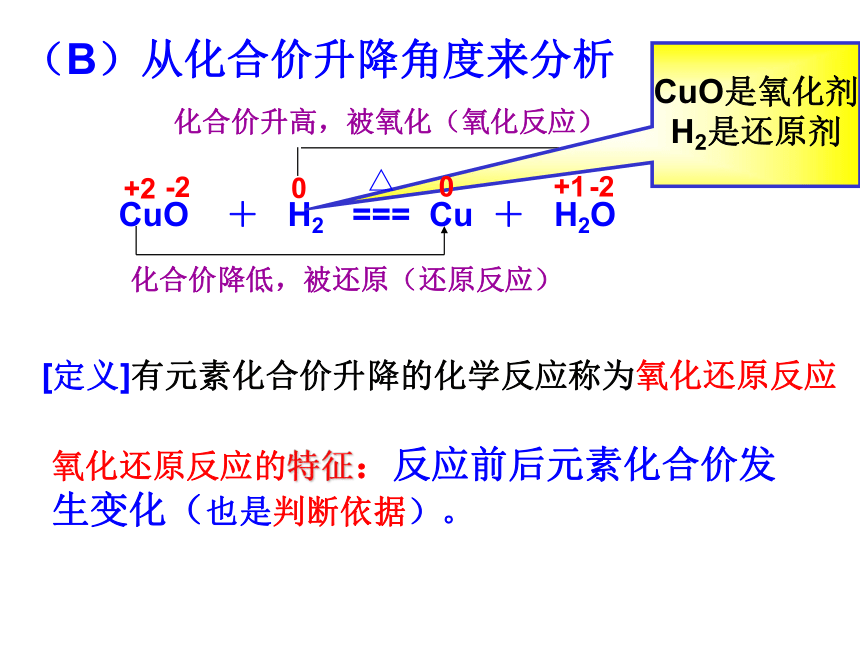
行(B)从化合价升降角度来分析化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应) CuO + H2 === Cu + H2OCuO是氧化剂
H2是还原剂 +2-200+1-2△[定义]有元素化合价升降的化学反应称为氧化还原反应氧化还原反应的特征:反应前后元素化合价发生变化(也是判断依据)。 氧化还原反应 : 有元素化合价 升降的反应所含元素化合价降低的物质
所含元素化合价升高的物质
还原剂被氧化后的产物
氧化剂被还原后的产物物质里所含元素化合价升高的反应
物质里所含元素化合价降低的反应 氧化剂:
还原剂:
氧化反应:
还原反应:
氧化产物:
还原产物: 1、下列反应属于氧化还原反应的是( )
A、CaCO3+2HCl=CaCl2+H2O+CO2↑
B、CaCO3 CaO+CO2↑
C、Na2O+H2O=2NaOH
D、Mg+2HCl=MgCl2+H2↑ 练习一D2、下列反应是否属于氧化还原反应?
2Na+Cl2 = 2NaCl
2H2+Cl2 = 2HCl[结论]有化合价升降的反应是氧化还原反应。 2Na+Cl2 = 2NaCl
2H2+Cl2 = 2HCl
1、化合价的升降是什么原因引起的?如何在上述两
反应中表达出来?
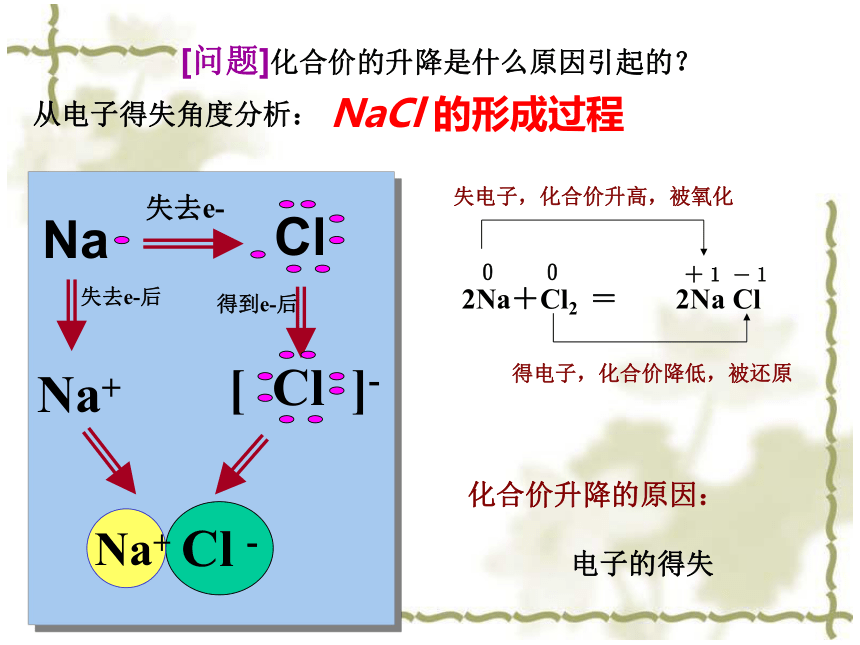
[思考] (三)从电子得失看氧化还原反应:[问题]化合价的升降是什么原因引起的?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+ 从电子得失角度分析:
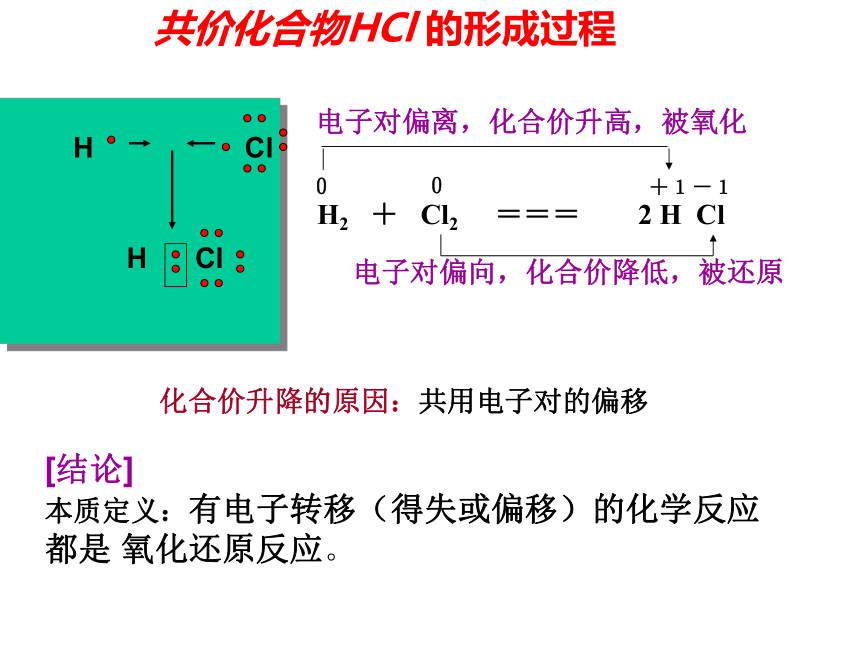
H2 + Cl2 === 2 H Cl00+1-1电子对偏离,化合价升高,被氧化电子对偏向,化合价降低,被还原[结论]
本质定义:有电子转移(得失或偏移)的化学反应都是 氧化还原反应。共价化合物HCl 的形成过程化合价升降的原因:共用电子对的偏移H Cl H Cl氧化还原反应 :有电子得失的反应在反应中得电子的物质
在反应中失电子的物质
还原剂被氧化后的产物
氧化剂被还原后的产物失电子的的反应
得电子的的反应 氧化剂:
还原剂:
氧化反应:
还原反应:
氧化产物:
还原产物:常见氧化剂:
(1)活泼的非金属单质如Cl2、O2等。
(2)含有最高价或较高价元素的化合物如KMnO4、HNO3、浓H2SO4、MnO2等
(3)一些金属阳离子如Fe3+、Cu2+、Ag+等
常见还原剂:
(1)活泼金属单质如K、Na、Mg、Fe等
(2)某些非金属单质如H2、C等
(3)含有最低价或较低价元素的化合物如FeCl2、CO、H2S等
(4)某些非金属阴离子如S2-、I-等学会比较,学会总结1. 得氧和失氧的反应只是氧化还原反应中的一部份。2. 化合价发生改变是所有氧化还原反应的共同特征3. 电子得失是氧化还原反应的本质失电子化合价升高被氧化还原剂得电子化合价降低被还原氧化剂(本质) ( 特征)(变化)(反应物)(本质) ( 特征)1、下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡是有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的转移(得失或偏移)
[练习二]BD2、(2000年高考题)对司机酒后驾车,可对其呼出的气体进行检验而查出,所利用的化学反应如下:CrO3(红色)+3C2H5OH==Cr2(SO4) 3(绿色) +3CH3CHO+6H2O,被检测出的气体成分是____,上述反应中的氧化剂是_____,还原剂是____。
C2H5OH
CrO3 C2H5OH
3.判断下列反应是否是氧化还原反应,是的请指出氧化剂和还原剂。
(1)2Fe+3Cl2 = 2FeCl3 (2)CaO+H2O = Ca(OH)2
(3)Cl2+H2O = HCl+HClO (4)Fe+CuSO4 = FeSO4+Cu
(5 ) CaCO3==CaO+CO2
(6)H2O==H2+O2
(7)NaOH+HCl = NaCl+H2O (8) CO2 + H2O = H2CO3
(9)、2KClO3 = 2KCl + 3O2↑
(10) 2Na + 2H2O = 2NaOH+ H2↑
(11)、Fe + H2SO4 = FeSO4 + H2↑
(12)、CuO + H2 = Cu+ H2O
(13)、CaCO3+2HCl = CaCl2+H2O +CO2↑ 高温通电第二课时专题二 氧化还原反应
温故而知新1. 化合价发生改变是所有氧化还原反应的共同特征2. 电子得失(电子对偏移)是氧化还原反应的本质(本质)失电子化合价升高被氧化还原剂得电子具还原性化合价降低被还原氧化剂 ( 特征)(变化)(反应物)具氧化性(性质)解决问题:标出2KBr + Cl2 = Br2 + 2KCl 反应中各元素的化合价,并分析哪种元素失电子,哪种元素得电子,电子从哪种元素转移到哪种元素?谁是氧化剂? 谁是还原剂? 谁是氧化产物? 谁是还原产物? Cl2
KBr Br2 KCl 一、分析表格,找出四种基本反应类型与氧化还原反应的关系。2Na+Cl2 == 2Na Cl
CaO+H2O ==Ca(OH)2是
否CaCO3 CaO+CO2↑
2KMnO4== K2MnO4 + MnO2 +O2 ↑否
是△Mg+2HCl=MgCl2+H2↑是否CaCO3+2HCl=CaCl2+H2O+CO2↑[结论] 置换反应全部是氧化还原反应;复分解反应
全部是非氧化还原反应;有单质参加的化合反应和
有单质生成的分解反应全部属于氧化还原反应。氧化还原反应与化学反应基本类型的关系七、表示电子转移的方法1.双线桥法:失 2?e-Cl2 + H2O = HCl + HClO失e-得 e-表示同一元素的原子或离子得失电子的结果 双箭号跨过等号,从反应物指向生成物,起止为同一元素 注明失去或得到电子的总数,得或失两字不能省略。注 意MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O得 2e-+4+2-100+1-1课堂练习用双线桥表示同种元素的电子得失。失2 ? e- 双箭号从反应物指向生成物
且起止为同一元素。 注明得与失。 2 Na + Cl2 = 2 NaCl得2 ? e-0+10-1课堂练习用双线桥表示同种元素的电子得失失 2 ? 3e- 双箭号从反应物指向生成物
且起止为同一元素。 注明得与失。2 Fe + 3 Cl2 = 2 FeCl3得 6 ? e-0+30-1课堂练习用双线桥表示同种元素的电子得失失 6 ? 2e- 双箭号从反应物指向生成物
且起止为同一元素。 注明得与失。2KClO3 = 2KCl + 3 O2得 2 ? 6e-+5-1-20小 结 用双线桥表示同种元素的电子得失。 双箭号从反应物指向生成物且起止为同一元素。注明得与失。注意:
箭头、箭尾一定要对准物质中的同一元素。思考并总结:氧化还原反应中,化合价升高总数 与 化合价降低总数有何关系?
元素失电子总数 与 元素得电子总数有何关系?化合价升高总数 = 化合价降低总数元素失电子总数 =元素得电子总数三:物质氧化性和还原性相对强弱的判断方法
已知下列两氧化还原反应1)Cl2+2KBr=2KCl+Br2,
2) Br2+2KI=2KBr+I2
试比较三种单质的氧化性强弱顺序。分析:在同一反应中,氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
1)中氧化性: Cl2>Br2
2)中氧化性:Br2>I2
故氧化性: Cl2>Br2>I2规律:物质氧化性和还原性相对强弱的判断方法 (1)根据金属活动顺序进行判断
K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au
金属的活泼性减弱,单质的还原性减弱
K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe2+,Sn2+, (H+),Cu2+,Hg2+,Ag+, 金属阳离子氧化性逐渐增强(2)根据非金属活动顺序进行判断
氟、氯、溴、碘的单质的氧化性强弱顺序为:F2>Cl2>Br2>I2
离子的还原性强弱顺序为:I->Br->Cl->F-(3)根据氧化还原反应的发生规律判断
对一般的氧化还原反应,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。(4)利用化合价,比较物质氧化性、还原性强弱
由同种元素形成的不同价态物质的氧化性和还原性的强弱规律是:元素的最高价态只具有氧化性,元素的最低价态只具有还原性,元素的中间价态既有氧化性又有还原性。如氧化性:2KMnO4> MnO2> MnCl2(5)根据反应条件判断,同一类反应,条件低的,氧化性(还原性)就强。如:
MnO2 + 4 HCl(浓) === MnCl2 + Cl2 + 2H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O
氧化性: 2KMnO4> MnO2△ Cl2 + 2 KI = 2 KCl + I2Fe +CuSO4 = FeSO4 + Cu课堂练习
1.用双线桥表示同种元素的电子得失。并对每个反应中物质的氧化性和还原性进行比较.
第一课时 思考与交流1.请举几个氧化反应和还原反应的实例,讨论并
交流这类化学反应的分类标准是什么?
2.氧化反应和还原反应是分别独立进行的吗?
1.CuO+H2 Cu+H2O,从CuO来看是 反应,从H2来看是 反应。
2.CO2+C 2CO,从CO2来看 是 反应,从C来看是 反应。
3.C+H2O CO+H2,从C来看是 反应,从H2O来看是 反应。
还原氧化氧化还原还原氧化氧化反应和还原反应一定是同时发生!一种物质被氧化,同时另一种物质被还原的反应,叫做氧化还原反应。 (A)从得氧失氧角度分析:Cu OCuC O OCCu OCu得到氧,被氧化(氧化反应)△2CuO + C == 2 Cu + CO2 失去氧,被还原(还原反应)[问题]以上反应在得氧失氧的同时,元素的化合价有什么变化?找出氧化反应与还原反应与化合价的关系同
时
进
行(B)从化合价升降角度来分析化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应) CuO + H2 === Cu + H2OCuO是氧化剂
H2是还原剂 +2-200+1-2△[定义]有元素化合价升降的化学反应称为氧化还原反应氧化还原反应的特征:反应前后元素化合价发生变化(也是判断依据)。 氧化还原反应 : 有元素化合价 升降的反应所含元素化合价降低的物质
所含元素化合价升高的物质
还原剂被氧化后的产物
氧化剂被还原后的产物物质里所含元素化合价升高的反应
物质里所含元素化合价降低的反应 氧化剂:
还原剂:
氧化反应:
还原反应:
氧化产物:
还原产物: 1、下列反应属于氧化还原反应的是( )
A、CaCO3+2HCl=CaCl2+H2O+CO2↑
B、CaCO3 CaO+CO2↑
C、Na2O+H2O=2NaOH
D、Mg+2HCl=MgCl2+H2↑ 练习一D2、下列反应是否属于氧化还原反应?
2Na+Cl2 = 2NaCl
2H2+Cl2 = 2HCl[结论]有化合价升降的反应是氧化还原反应。 2Na+Cl2 = 2NaCl
2H2+Cl2 = 2HCl
1、化合价的升降是什么原因引起的?如何在上述两
反应中表达出来?
[思考] (三)从电子得失看氧化还原反应:[问题]化合价的升降是什么原因引起的?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+ 从电子得失角度分析:
H2 + Cl2 === 2 H Cl00+1-1电子对偏离,化合价升高,被氧化电子对偏向,化合价降低,被还原[结论]
本质定义:有电子转移(得失或偏移)的化学反应都是 氧化还原反应。共价化合物HCl 的形成过程化合价升降的原因:共用电子对的偏移H Cl H Cl氧化还原反应 :有电子得失的反应在反应中得电子的物质
在反应中失电子的物质
还原剂被氧化后的产物
氧化剂被还原后的产物失电子的的反应
得电子的的反应 氧化剂:
还原剂:
氧化反应:
还原反应:
氧化产物:
还原产物:常见氧化剂:
(1)活泼的非金属单质如Cl2、O2等。
(2)含有最高价或较高价元素的化合物如KMnO4、HNO3、浓H2SO4、MnO2等
(3)一些金属阳离子如Fe3+、Cu2+、Ag+等
常见还原剂:
(1)活泼金属单质如K、Na、Mg、Fe等
(2)某些非金属单质如H2、C等
(3)含有最低价或较低价元素的化合物如FeCl2、CO、H2S等
(4)某些非金属阴离子如S2-、I-等学会比较,学会总结1. 得氧和失氧的反应只是氧化还原反应中的一部份。2. 化合价发生改变是所有氧化还原反应的共同特征3. 电子得失是氧化还原反应的本质失电子化合价升高被氧化还原剂得电子化合价降低被还原氧化剂(本质) ( 特征)(变化)(反应物)(本质) ( 特征)1、下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡是有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的转移(得失或偏移)
[练习二]BD2、(2000年高考题)对司机酒后驾车,可对其呼出的气体进行检验而查出,所利用的化学反应如下:CrO3(红色)+3C2H5OH==Cr2(SO4) 3(绿色) +3CH3CHO+6H2O,被检测出的气体成分是____,上述反应中的氧化剂是_____,还原剂是____。
C2H5OH
CrO3 C2H5OH
3.判断下列反应是否是氧化还原反应,是的请指出氧化剂和还原剂。
(1)2Fe+3Cl2 = 2FeCl3 (2)CaO+H2O = Ca(OH)2
(3)Cl2+H2O = HCl+HClO (4)Fe+CuSO4 = FeSO4+Cu
(5 ) CaCO3==CaO+CO2
(6)H2O==H2+O2
(7)NaOH+HCl = NaCl+H2O (8) CO2 + H2O = H2CO3
(9)、2KClO3 = 2KCl + 3O2↑
(10) 2Na + 2H2O = 2NaOH+ H2↑
(11)、Fe + H2SO4 = FeSO4 + H2↑
(12)、CuO + H2 = Cu+ H2O
(13)、CaCO3+2HCl = CaCl2+H2O +CO2↑ 高温通电第二课时专题二 氧化还原反应
温故而知新1. 化合价发生改变是所有氧化还原反应的共同特征2. 电子得失(电子对偏移)是氧化还原反应的本质(本质)失电子化合价升高被氧化还原剂得电子具还原性化合价降低被还原氧化剂 ( 特征)(变化)(反应物)具氧化性(性质)解决问题:标出2KBr + Cl2 = Br2 + 2KCl 反应中各元素的化合价,并分析哪种元素失电子,哪种元素得电子,电子从哪种元素转移到哪种元素?谁是氧化剂? 谁是还原剂? 谁是氧化产物? 谁是还原产物? Cl2
KBr Br2 KCl 一、分析表格,找出四种基本反应类型与氧化还原反应的关系。2Na+Cl2 == 2Na Cl
CaO+H2O ==Ca(OH)2是
否CaCO3 CaO+CO2↑
2KMnO4== K2MnO4 + MnO2 +O2 ↑否
是△Mg+2HCl=MgCl2+H2↑是否CaCO3+2HCl=CaCl2+H2O+CO2↑[结论] 置换反应全部是氧化还原反应;复分解反应
全部是非氧化还原反应;有单质参加的化合反应和
有单质生成的分解反应全部属于氧化还原反应。氧化还原反应与化学反应基本类型的关系七、表示电子转移的方法1.双线桥法:失 2?e-Cl2 + H2O = HCl + HClO失e-得 e-表示同一元素的原子或离子得失电子的结果 双箭号跨过等号,从反应物指向生成物,起止为同一元素 注明失去或得到电子的总数,得或失两字不能省略。注 意MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O得 2e-+4+2-100+1-1课堂练习用双线桥表示同种元素的电子得失。失2 ? e- 双箭号从反应物指向生成物
且起止为同一元素。 注明得与失。 2 Na + Cl2 = 2 NaCl得2 ? e-0+10-1课堂练习用双线桥表示同种元素的电子得失失 2 ? 3e- 双箭号从反应物指向生成物
且起止为同一元素。 注明得与失。2 Fe + 3 Cl2 = 2 FeCl3得 6 ? e-0+30-1课堂练习用双线桥表示同种元素的电子得失失 6 ? 2e- 双箭号从反应物指向生成物
且起止为同一元素。 注明得与失。2KClO3 = 2KCl + 3 O2得 2 ? 6e-+5-1-20小 结 用双线桥表示同种元素的电子得失。 双箭号从反应物指向生成物且起止为同一元素。注明得与失。注意:
箭头、箭尾一定要对准物质中的同一元素。思考并总结:氧化还原反应中,化合价升高总数 与 化合价降低总数有何关系?
元素失电子总数 与 元素得电子总数有何关系?化合价升高总数 = 化合价降低总数元素失电子总数 =元素得电子总数三:物质氧化性和还原性相对强弱的判断方法
已知下列两氧化还原反应1)Cl2+2KBr=2KCl+Br2,
2) Br2+2KI=2KBr+I2
试比较三种单质的氧化性强弱顺序。分析:在同一反应中,氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
1)中氧化性: Cl2>Br2
2)中氧化性:Br2>I2
故氧化性: Cl2>Br2>I2规律:物质氧化性和还原性相对强弱的判断方法 (1)根据金属活动顺序进行判断
K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au
金属的活泼性减弱,单质的还原性减弱
K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe2+,Sn2+, (H+),Cu2+,Hg2+,Ag+, 金属阳离子氧化性逐渐增强(2)根据非金属活动顺序进行判断
氟、氯、溴、碘的单质的氧化性强弱顺序为:F2>Cl2>Br2>I2
离子的还原性强弱顺序为:I->Br->Cl->F-(3)根据氧化还原反应的发生规律判断
对一般的氧化还原反应,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。(4)利用化合价,比较物质氧化性、还原性强弱
由同种元素形成的不同价态物质的氧化性和还原性的强弱规律是:元素的最高价态只具有氧化性,元素的最低价态只具有还原性,元素的中间价态既有氧化性又有还原性。如氧化性:2KMnO4> MnO2> MnCl2(5)根据反应条件判断,同一类反应,条件低的,氧化性(还原性)就强。如:
MnO2 + 4 HCl(浓) === MnCl2 + Cl2 + 2H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O
氧化性: 2KMnO4> MnO2△ Cl2 + 2 KI = 2 KCl + I2Fe +CuSO4 = FeSO4 + Cu课堂练习
1.用双线桥表示同种元素的电子得失。并对每个反应中物质的氧化性和还原性进行比较.
