物质的量浓度课件
图片预览



文档简介
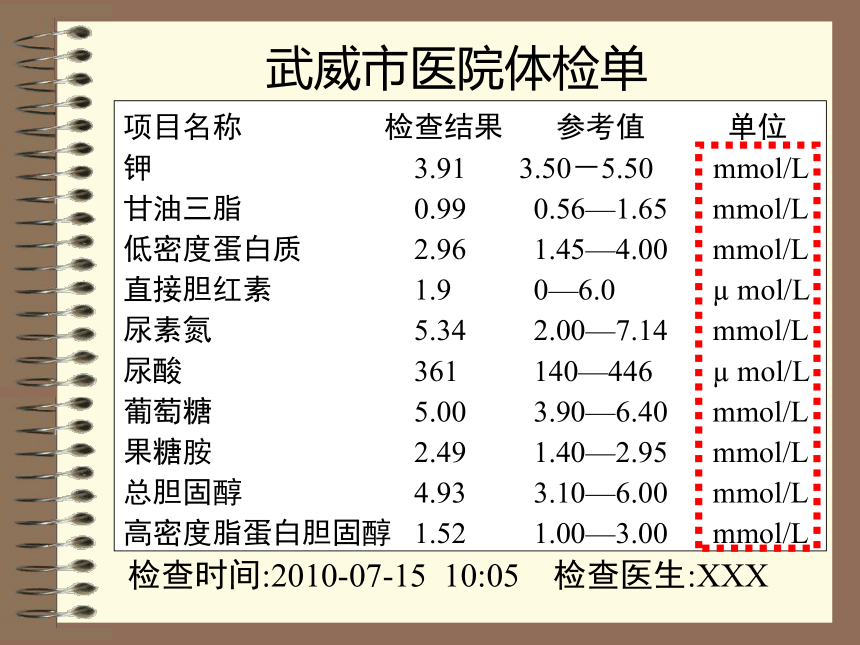
课件19张PPT。化学计量在实验中的应用物质的量浓度项目名称 检查结果 参考值 单位
钾 3.91 3.50-5.50 mmol/L
甘油三脂 0.99 0.56—1.65 mmol/L
低密度蛋白质 2.96 1.45—4.00 mmol/L
直接胆红素 1.9 0—6.0 μ mol/L
尿素氮 5.34 2.00—7.14 mmol/L
尿酸 361 140—446 μ mol/L
葡萄糖 5.00 3.90—6.40 mmol/L
果糖胺 2.49 1.40—2.95 mmol/L
总胆固醇 4.93 3.10—6.00 mmol/L
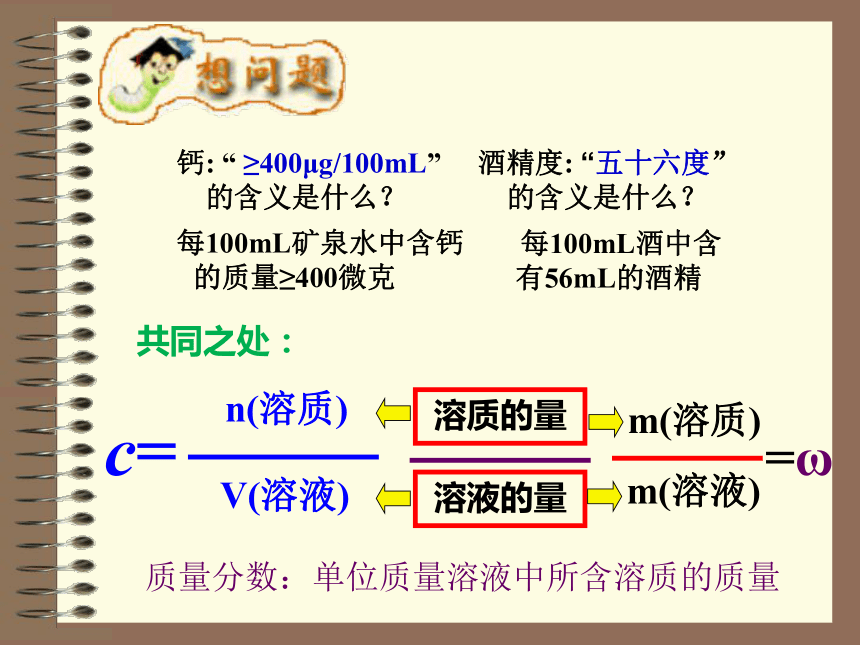
高密度脂蛋白胆固醇 1.52 1.00—3.00 mmol/L检查时间:2010-07-15 10:05 检查医生:XXX武威市医院体检单溶液的量溶质的量m(溶质)m(溶液)=ωn(溶质)V(溶液)c=质量分数:单位质量溶液中所含溶质的质量钙: “ ≥400μg/100mL”
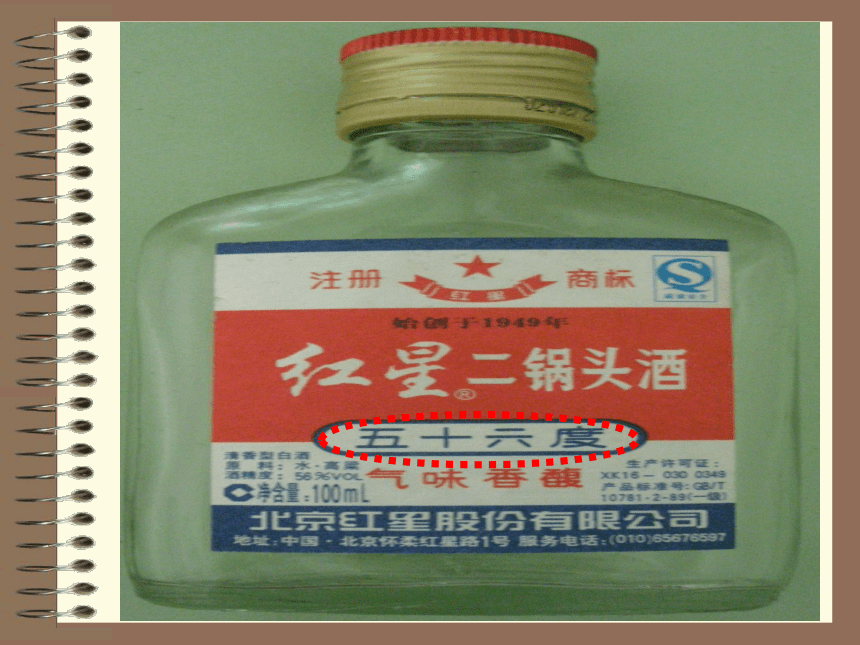
的含义是什么?酒精度: “五十六度”
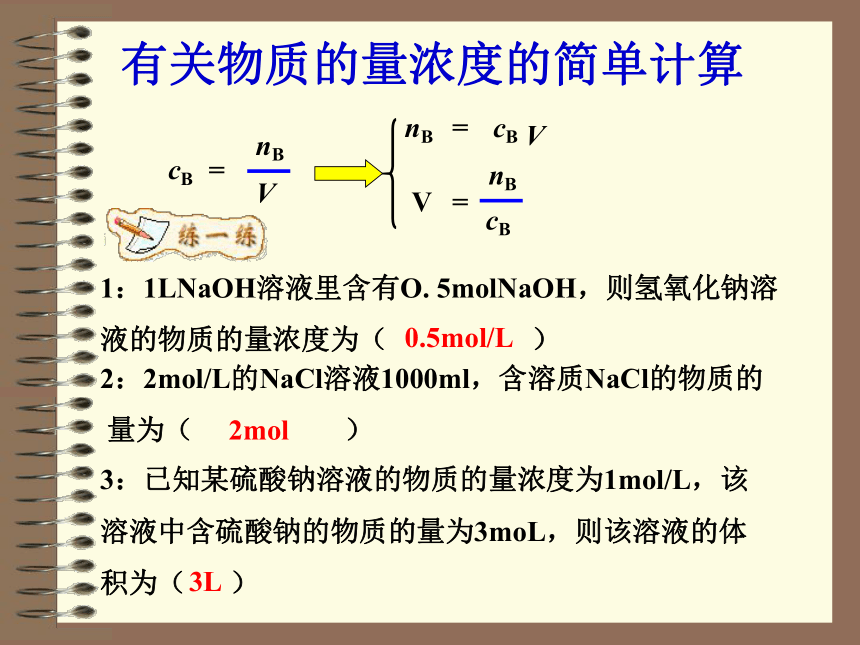
的含义是什么?每100mL矿泉水中含钙 的质量≥400微克 每100mL酒中含有56mL的酒精共同之处:物质的量浓度 以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。三、表达式:物质的量浓度=溶质的物质的量溶液的体积c(B)=摩尔/升( mol/L)或摩尔/立方米 (mol/m3)四、单位:nBV1、体积指的是溶液的体积,而不是溶剂的体积。 二、符号:cB五、注意:2、溶质用物质的量表示,而不是用质量表示。一、定义:有关物质的量浓度的简单计算1:1LNaOH溶液里含有O. 5molNaOH,则氢氧化钠溶液的物质的量浓度为( )2:2mol/L的NaCl溶液1000ml,含溶质NaCl的物质的
量为( )3:已知某硫酸钠溶液的物质的量浓度为1mol/L,该
溶液中含硫酸钠的物质的量为3moL,则该溶液的体
积为( )0.5mol/L2mol3L讨论1:将342克蔗糖(C12H22O11 )溶解在1L水中,所得溶液中溶质的物质的量浓度是多少?(M蔗糖=342g/mol) 讨论2:从1L1mol/L的C12H22O11溶液中取出100ml,取出
的C12H22O11溶液的物质的量浓度是多少?溶质质量、
溶剂质量、溶质质量分数、溶液密度怎样变化?结论:同一溶液,各部分是均一的。所以,无论取多少体
积,溶质的物质的量浓度相同,但溶质的物质的量不同。结论:溶液的体积不等于溶剂的体积,且不同物质(尤其是状态不同的物质)的体积是没有加和性的。1、用胆矾晶体配制1mol/L硫酸铜溶液的最佳方法是( )
A.称取250g胆矾溶于1L水中;
B.称取160g胆矾溶于1L水中;
C.将胆矾加热失水后再称取160g并溶于水配成1L溶液;
D.称取250g胆矾溶于水再稀释到1L。若是结晶水合物,溶质为除去结晶水的化合物。2、1 mol/L MgCl2 溶液,Mg2+ 的物质的量浓度为 mol/L, Cl- 的物质的量浓度为 mol/L 。1 3、0.5 mol/L H2SO4 溶液,H+ 的物质的量浓度为 mol/L, SO42- 的物质的量浓度为 mol/L 。4、0.1 mol/L Al2(SO4)3 溶液,Al3+ 的物质的量浓度为
mol/L,SO42- 的物质的量浓度为 mol/L 。2 1 0. 5 0. 2 0. 3 下列各溶液中,Na+ 浓度最大的是 ( )
(A)4L 0. 5 mol/L NaCl 溶液
(B)1L 0. 3 mol/L Na2SO4 溶液
(C) 0. 8L 0. 4 mol/L NaOH 溶液
(D) 2L 0. 15 mol/L Na3PO4 溶液
C (Na+) = 0. 5 mol/L×1 = 0. 5 mol/L C (Na+) = 0. 3 mol/L×2 = 0. 6 mol/L C (Na+) = 0. 4 mol/L×1 = 0. 4 mol/L C (Na+) = 0. 15 mol/L×3 = 0. 45 mol/LB例题1、将4gNaOH溶于水配成2L溶液,其物质的量浓度为多少?n(NaOH)= m(NaOH)M(NaOH)=4g40g/mol=0.1molc(NaOH)=n(NaOH)V(aq)=2L0.1mol=0.05mol/L解:答:40克氢氧化钠溶于水配成2L溶液,物质的量浓度为0.05mol/L1、将23.4gNaCl溶于水配成250mL溶液。计算溶液中溶质的物质的量浓度。 2.将28.4g Na2SO4溶于水配成250mL溶液,计算溶液中溶质的物质的量浓度,并求出溶液中Na+和SO42- 的物质的量浓度。 3、某溶液中只含Al3+、NO3-、Na+、SO42-、Cl-等五种离子已知c(NO3-)=0.2mol/L、 c(Na+)= 0.2mol/L、 c(SO42-)=0.1mol/L c(Cl-)=0.1mol/L 、c(Al3+)= mol/L3c(Al3+)+c(Na+)=c(NO3-)+2c(SO42-)+c(Cl-)c(Al3+)=[c(NO3-)+2c(SO42-)+c(Cl-)-c(Na+)]/3c(Al3+)=(0.2mol/L+2×0.1mol/L+0.1mol/L
-0.2mol/L)÷3 =0.1mol/L由溶液电中性原理知,溶液中各离子应该满足下列关系:c(浓溶液) ·V(浓溶液)=c(稀溶液) ·V(稀溶液)m (浓溶液) ·ω(浓溶液)=m(稀溶液) ·ω(稀溶液)c1V1=c2V2m1ω1=m2ω2原理:稀释以后,溶液中溶质的量不变。(稀释前后溶液中溶质物质的量不变)(稀释前后溶液中溶质质量不变)溶液的稀释定律解 根据溶液稀释定律有:c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)即有:0.1L×18mol·L-1=2L×c[H2SO4(aq)]解得: c[H2SO4(aq)] = 0.9mol·L-1答:稀释后所得稀硫酸的物质的量浓度为0.9mol·L-1例、向100ml18mol/L的硫酸加水稀释至2L,所得稀硫酸的物质的量浓度为多少?
c—物质的量浓度(mol?L-1 )
ρ—溶液密度( g?mL-1 )
ω—质量分数
M—溶质的摩尔质量( g?mol-1 )物质的量浓度与质量分数的关系例、市售浓硫酸中溶质的质量分数为98%密度为1.84g/cm3。计算市售浓硫酸中H2SO4的物质的量浓度。解:答:…… 作业:
把第一题第5、6小题,第二题第1小题都改为计算题
钾 3.91 3.50-5.50 mmol/L
甘油三脂 0.99 0.56—1.65 mmol/L
低密度蛋白质 2.96 1.45—4.00 mmol/L
直接胆红素 1.9 0—6.0 μ mol/L
尿素氮 5.34 2.00—7.14 mmol/L
尿酸 361 140—446 μ mol/L
葡萄糖 5.00 3.90—6.40 mmol/L
果糖胺 2.49 1.40—2.95 mmol/L
总胆固醇 4.93 3.10—6.00 mmol/L
高密度脂蛋白胆固醇 1.52 1.00—3.00 mmol/L检查时间:2010-07-15 10:05 检查医生:XXX武威市医院体检单溶液的量溶质的量m(溶质)m(溶液)=ωn(溶质)V(溶液)c=质量分数:单位质量溶液中所含溶质的质量钙: “ ≥400μg/100mL”
的含义是什么?酒精度: “五十六度”
的含义是什么?每100mL矿泉水中含钙 的质量≥400微克 每100mL酒中含有56mL的酒精共同之处:物质的量浓度 以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。三、表达式:物质的量浓度=溶质的物质的量溶液的体积c(B)=摩尔/升( mol/L)或摩尔/立方米 (mol/m3)四、单位:nBV1、体积指的是溶液的体积,而不是溶剂的体积。 二、符号:cB五、注意:2、溶质用物质的量表示,而不是用质量表示。一、定义:有关物质的量浓度的简单计算1:1LNaOH溶液里含有O. 5molNaOH,则氢氧化钠溶液的物质的量浓度为( )2:2mol/L的NaCl溶液1000ml,含溶质NaCl的物质的
量为( )3:已知某硫酸钠溶液的物质的量浓度为1mol/L,该
溶液中含硫酸钠的物质的量为3moL,则该溶液的体
积为( )0.5mol/L2mol3L讨论1:将342克蔗糖(C12H22O11 )溶解在1L水中,所得溶液中溶质的物质的量浓度是多少?(M蔗糖=342g/mol) 讨论2:从1L1mol/L的C12H22O11溶液中取出100ml,取出
的C12H22O11溶液的物质的量浓度是多少?溶质质量、
溶剂质量、溶质质量分数、溶液密度怎样变化?结论:同一溶液,各部分是均一的。所以,无论取多少体
积,溶质的物质的量浓度相同,但溶质的物质的量不同。结论:溶液的体积不等于溶剂的体积,且不同物质(尤其是状态不同的物质)的体积是没有加和性的。1、用胆矾晶体配制1mol/L硫酸铜溶液的最佳方法是( )
A.称取250g胆矾溶于1L水中;
B.称取160g胆矾溶于1L水中;
C.将胆矾加热失水后再称取160g并溶于水配成1L溶液;
D.称取250g胆矾溶于水再稀释到1L。若是结晶水合物,溶质为除去结晶水的化合物。2、1 mol/L MgCl2 溶液,Mg2+ 的物质的量浓度为 mol/L, Cl- 的物质的量浓度为 mol/L 。1 3、0.5 mol/L H2SO4 溶液,H+ 的物质的量浓度为 mol/L, SO42- 的物质的量浓度为 mol/L 。4、0.1 mol/L Al2(SO4)3 溶液,Al3+ 的物质的量浓度为
mol/L,SO42- 的物质的量浓度为 mol/L 。2 1 0. 5 0. 2 0. 3 下列各溶液中,Na+ 浓度最大的是 ( )
(A)4L 0. 5 mol/L NaCl 溶液
(B)1L 0. 3 mol/L Na2SO4 溶液
(C) 0. 8L 0. 4 mol/L NaOH 溶液
(D) 2L 0. 15 mol/L Na3PO4 溶液
C (Na+) = 0. 5 mol/L×1 = 0. 5 mol/L C (Na+) = 0. 3 mol/L×2 = 0. 6 mol/L C (Na+) = 0. 4 mol/L×1 = 0. 4 mol/L C (Na+) = 0. 15 mol/L×3 = 0. 45 mol/LB例题1、将4gNaOH溶于水配成2L溶液,其物质的量浓度为多少?n(NaOH)= m(NaOH)M(NaOH)=4g40g/mol=0.1molc(NaOH)=n(NaOH)V(aq)=2L0.1mol=0.05mol/L解:答:40克氢氧化钠溶于水配成2L溶液,物质的量浓度为0.05mol/L1、将23.4gNaCl溶于水配成250mL溶液。计算溶液中溶质的物质的量浓度。 2.将28.4g Na2SO4溶于水配成250mL溶液,计算溶液中溶质的物质的量浓度,并求出溶液中Na+和SO42- 的物质的量浓度。 3、某溶液中只含Al3+、NO3-、Na+、SO42-、Cl-等五种离子已知c(NO3-)=0.2mol/L、 c(Na+)= 0.2mol/L、 c(SO42-)=0.1mol/L c(Cl-)=0.1mol/L 、c(Al3+)= mol/L3c(Al3+)+c(Na+)=c(NO3-)+2c(SO42-)+c(Cl-)c(Al3+)=[c(NO3-)+2c(SO42-)+c(Cl-)-c(Na+)]/3c(Al3+)=(0.2mol/L+2×0.1mol/L+0.1mol/L
-0.2mol/L)÷3 =0.1mol/L由溶液电中性原理知,溶液中各离子应该满足下列关系:c(浓溶液) ·V(浓溶液)=c(稀溶液) ·V(稀溶液)m (浓溶液) ·ω(浓溶液)=m(稀溶液) ·ω(稀溶液)c1V1=c2V2m1ω1=m2ω2原理:稀释以后,溶液中溶质的量不变。(稀释前后溶液中溶质物质的量不变)(稀释前后溶液中溶质质量不变)溶液的稀释定律解 根据溶液稀释定律有:c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)即有:0.1L×18mol·L-1=2L×c[H2SO4(aq)]解得: c[H2SO4(aq)] = 0.9mol·L-1答:稀释后所得稀硫酸的物质的量浓度为0.9mol·L-1例、向100ml18mol/L的硫酸加水稀释至2L,所得稀硫酸的物质的量浓度为多少?
c—物质的量浓度(mol?L-1 )
ρ—溶液密度( g?mL-1 )
ω—质量分数
M—溶质的摩尔质量( g?mol-1 )物质的量浓度与质量分数的关系例、市售浓硫酸中溶质的质量分数为98%密度为1.84g/cm3。计算市售浓硫酸中H2SO4的物质的量浓度。解:答:…… 作业:
把第一题第5、6小题,第二题第1小题都改为计算题
