化学选四鲁科版第三章《研究电解质在溶液中的化学反应》ppt
文档属性
| 名称 | 化学选四鲁科版第三章《研究电解质在溶液中的化学反应》ppt |  | |
| 格式 | rar | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-11-02 12:49:00 | ||
图片预览






文档简介
课件14张PPT。 研究电解质在溶液中的化学反应一.复习电解质的电离电解质与非电解质回答:
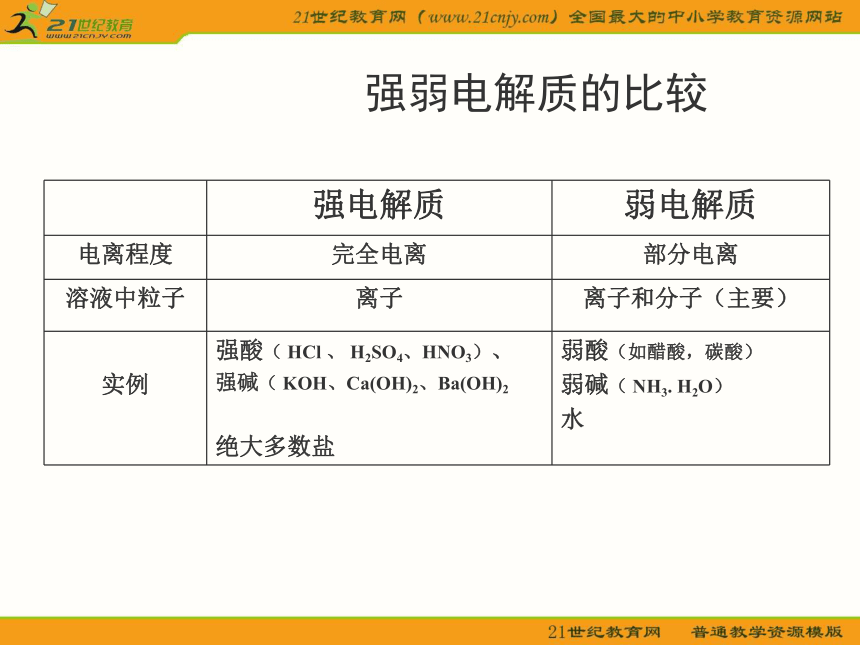
因为电解质在水溶液或熔融状态下电离,形成了能自由移动的(带电)离子. 提问:为什么电解质在水溶液里或熔化状态下能够导电?强电解质和弱电解质强电解质:在水溶液中全部电离成离子的电解质弱电解质:在水溶液中部分电离成离子的电解质特征: 全部电离特征: 部分电离如:NaCl、Ca(OH)2、H2SO4如:CH3COOH HClO H2CO3 NH3.H2O H2O强弱电解质的比较电离方程式1)定义:用来表示电解质发生电离过程的式子NaCl → Na+ + Cl-a 、必须遵守质量守恒和电荷守恒;b 、原子团不能拆开。2)电离方程式书写原则:试写:H2SO4 NaHCO3 H2O HClO导电性强弱滴入硫酸溶液,发生反应:
Ba(OH)2+H2SO4 → BaSO4↓+2H2O
离子浓度逐渐减小至接近零,待氢氧化钡完全反应后再滴入硫酸,离子浓度又增大,
灯泡又逐渐变亮。氢氧化钡在溶液中能电离出自由移动的离子,在电场作用下定向移动,形成电流,灯泡逐渐变暗,直至熄灭。二、离子反应1.离子反应:有离子参加或生成的反应.2.离子方程式:用实际参加反应的离子
符号来表示反应的式子.3.离子方程式的意义:
离子方程式的意义: (2). 不仅表示某一个特定的化学反应,而且能表示同一类型的化学反应。 (1). 表示离子反应的本质。4.离子方程式的书写Ⅰ.写——正确写出反应的化学方程式(注意条件与配平)Ⅱ.改——把易溶于水的强电解质写成离子形式,难溶的电解质、弱电解质、气体等仍用化学式表示2AgNO3 + CuCl2 → 2AgCl↓+Cu(NO3)22Ag++2NO3-+Cu2++2Cl- →2AgCl↓+Cu2++2NO3-Ⅲ.删——删去方程式两边不参加反应的形式相同的离子2Ag++2NO3-+Cu2++2Cl- →2AgCl↓+Cu2++2NO3-Ⅳ.查——整理方程式并检查两边各元素的原子数目和电荷总数是否相等可以拆成离子形式的物质:a、强酸:HCl、HBr、HI、HClO4、 H2SO4、HNO3等;b、强碱:KOH、NaOH、Ba(OH)2 等c、可溶性盐:请同学们复习溶解性表。(口诀下页)仍用化学式表示的物质:a、难溶的物质:Cu(OH)2、BaSO4、AgCl 等b、弱电解质:弱酸、弱碱、水。c、气体:H2S、CO2、SO2等d、单质:H2、I2、Na等e、氧化物:Na2O、Fe2O3等微溶物(如Ca(OH)2) ,一般在反应物中可拆成离子形式,而作为生成物时一般是沉淀,写化学式。(易溶于水的强电解质)盐的溶解性口诀
钾钠铵硝都易溶,硫酸盐中钡铅除,
盐酸盐除银亚汞,其它酸盐多难溶。
可溶的碱
钾钠钡铵微溶钙
可溶的酸
绝大多数的酸都溶于水离子共存(离子之间不发生离子反应)判断下列各组离子能否大量共存① Ca2+ Na+ CO32- NO3-② Ca2+ Na+ SO42- NO3-③ H+ K+ Cl- OH-④ NH4+ K+ OH- SO42-⑤ H+ K+ HCO3- SO42-⑥ Na+ K+ CO32- OH-生成难溶物 CaCO3生成微溶物 CaSO4生成水生成 NH3 · H2O生成 弱酸 H2CO3能大量共存 HCO3-生成CO32-、 H2O返回
因为电解质在水溶液或熔融状态下电离,形成了能自由移动的(带电)离子. 提问:为什么电解质在水溶液里或熔化状态下能够导电?强电解质和弱电解质强电解质:在水溶液中全部电离成离子的电解质弱电解质:在水溶液中部分电离成离子的电解质特征: 全部电离特征: 部分电离如:NaCl、Ca(OH)2、H2SO4如:CH3COOH HClO H2CO3 NH3.H2O H2O强弱电解质的比较电离方程式1)定义:用来表示电解质发生电离过程的式子NaCl → Na+ + Cl-a 、必须遵守质量守恒和电荷守恒;b 、原子团不能拆开。2)电离方程式书写原则:试写:H2SO4 NaHCO3 H2O HClO导电性强弱滴入硫酸溶液,发生反应:
Ba(OH)2+H2SO4 → BaSO4↓+2H2O
离子浓度逐渐减小至接近零,待氢氧化钡完全反应后再滴入硫酸,离子浓度又增大,
灯泡又逐渐变亮。氢氧化钡在溶液中能电离出自由移动的离子,在电场作用下定向移动,形成电流,灯泡逐渐变暗,直至熄灭。二、离子反应1.离子反应:有离子参加或生成的反应.2.离子方程式:用实际参加反应的离子
符号来表示反应的式子.3.离子方程式的意义:
离子方程式的意义: (2). 不仅表示某一个特定的化学反应,而且能表示同一类型的化学反应。 (1). 表示离子反应的本质。4.离子方程式的书写Ⅰ.写——正确写出反应的化学方程式(注意条件与配平)Ⅱ.改——把易溶于水的强电解质写成离子形式,难溶的电解质、弱电解质、气体等仍用化学式表示2AgNO3 + CuCl2 → 2AgCl↓+Cu(NO3)22Ag++2NO3-+Cu2++2Cl- →2AgCl↓+Cu2++2NO3-Ⅲ.删——删去方程式两边不参加反应的形式相同的离子2Ag++2NO3-+Cu2++2Cl- →2AgCl↓+Cu2++2NO3-Ⅳ.查——整理方程式并检查两边各元素的原子数目和电荷总数是否相等可以拆成离子形式的物质:a、强酸:HCl、HBr、HI、HClO4、 H2SO4、HNO3等;b、强碱:KOH、NaOH、Ba(OH)2 等c、可溶性盐:请同学们复习溶解性表。(口诀下页)仍用化学式表示的物质:a、难溶的物质:Cu(OH)2、BaSO4、AgCl 等b、弱电解质:弱酸、弱碱、水。c、气体:H2S、CO2、SO2等d、单质:H2、I2、Na等e、氧化物:Na2O、Fe2O3等微溶物(如Ca(OH)2) ,一般在反应物中可拆成离子形式,而作为生成物时一般是沉淀,写化学式。(易溶于水的强电解质)盐的溶解性口诀
钾钠铵硝都易溶,硫酸盐中钡铅除,
盐酸盐除银亚汞,其它酸盐多难溶。
可溶的碱
钾钠钡铵微溶钙
可溶的酸
绝大多数的酸都溶于水离子共存(离子之间不发生离子反应)判断下列各组离子能否大量共存① Ca2+ Na+ CO32- NO3-② Ca2+ Na+ SO42- NO3-③ H+ K+ Cl- OH-④ NH4+ K+ OH- SO42-⑤ H+ K+ HCO3- SO42-⑥ Na+ K+ CO32- OH-生成难溶物 CaCO3生成微溶物 CaSO4生成水生成 NH3 · H2O生成 弱酸 H2CO3能大量共存 HCO3-生成CO32-、 H2O返回
