(新课标人教版选修四)化学:反应原理难溶电解质的溶解平衡
文档属性
| 名称 | (新课标人教版选修四)化学:反应原理难溶电解质的溶解平衡 |

|
|
| 格式 | rar | ||
| 文件大小 | 528.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-11-03 12:04:00 | ||
图片预览








文档简介
课件23张PPT。新课标人教版选修四化学反应原理第三章 水溶液中的离子平衡第四节 难溶电解质的溶解平衡大于10g, 易溶
1g~10g, 可溶
0.01g~1g, 微溶
小于0.01g, 难溶物质在水中的溶解性固体的溶解性:t℃时100克水溶解溶质的质量气体的溶解性:常温常压时1体积水溶解气体的体积大于100体积 极易溶
大于10体积 易溶
大于1体积 可溶
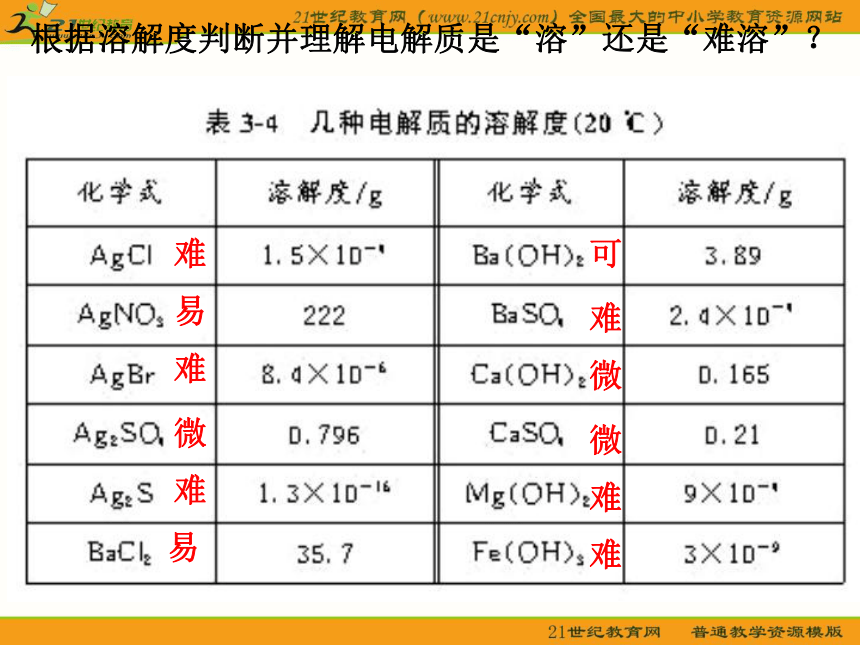
小于1体积 难溶可难难难难难难微微微易易根据溶解度判断并理解电解质是“溶”还是“难溶”?1、生成沉淀的离子反应能发生的原因生成物的溶解度很小(难溶物或微溶物)2、AgCl溶解平衡的建立当 v(溶解)=v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡一、Ag+和 Cl- 的反应真能进行到底吗?3、溶解平衡的特征逆、等、动、定、变4、生成难溶电解质的离子反应的限度难溶电解质的溶解度小于0.01g,离子反应生成难溶电解质,离子浓度小于1×10-5 mol/L时,认为沉淀反应完全,但溶液中还有相应的离子。石灰乳中存在下列平衡:
Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是( )
A、Na2CO3溶液 B、AlCl3溶液
C、NaOH溶液 D、CaCl2溶液AB练习二、沉淀反应的应用1、沉淀的生成(1)应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。(2)方法a 、调pH值如:工业原料氯化铵中混有氯化铁,
加氨水调pH值至7-8Fe3+ + 3NH3?H2O=Fe(OH)3↓+3NH4+b 、加沉淀剂:如沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂Cu2++S2-=CuS↓ Hg2++S2-=HgS↓2、沉淀的溶解(1)原理设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动(2)举例a 、难溶于水的盐溶于酸中
如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸沉淀不溶解沉淀溶解沉淀溶解Mg(OH)2+2HCl = MgCl2+2H2OMg(OH)2+2NH4Cl = MgCl2+2NH3+2H2Ob 、难溶于水的电解质溶于某些盐溶液
如:Mg(OH)2溶于NH4Cl溶液思考与交流 用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因Mg(OH)2+2NH4Cl = MgCl2+2NH3+2H2O产生白色沉淀白色沉淀变黄色黄色沉淀变黑色AgNO3+NaCl = AgCl↓(白色)+NaNO3AgCl+KI = AgI↓(黄色)+KCl2AgI+Na2S = Ag2S↓(黑色)+2NaI产生白色沉淀白色沉淀变红褐色出现红褐色沉淀MgCl2+2NaOH = Mg(OH)2↓(白色)+2NaCl3Mg(OH)2+2FeCl3=2Fe(OH)3↓(红褐色)+3MgCl2牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡: Ca5(PO4)3OH(s) 5Ca2++3PO43-+OH- 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是
。
已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小、质地更坚固。用离子方程表示当牙膏中配有氟化物添加剂后能防止龋齿的原因 。 生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿 5Ca2++3PO43-+F-=Ca5(PO4)3F↓ 练习(1)沉淀转化的方法
对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的沉淀。
(2)沉淀转化的实质
沉淀转化的实质是沉淀溶解平衡移动。一般溶解度小的沉淀转化成溶解度更小的沉淀容易实现。
(3)沉淀转化的应用
沉淀的转化在科研和生产中具有重要的应用价值。
①锅炉除水垢
二、沉淀反应的应用 3、沉淀的转化锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。CaSO4 SO42- + Ca2+ +
CO32-CaCO3②对一些自然现象的解释1、溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数.
2、表达式:(MmAn的饱和溶液) Ksp=[c(Mn+)]m · [c(Am-)]n
3、溶度积规则:离子积Qc=c(Mn+)m · c(Am-)n
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.三.溶度积和溶度积规则1.铬酸银(Ag2CrO4)在298K时的溶解度为0.0045g,求其溶度积。2.在100mL 0.01mol/LKCl 溶液中,加入 1mL 0.01mol/L AgNO3 溶液,有沉淀(已知AgCl KSP=1.8×10-10) ? Ag+沉淀是否完全?练习所以Ag+沉淀完全=9.84×10ˉ121、下列说法中正确的是( )
A.不溶于水的物质溶解度为0
B.绝对不溶解的物质是不存在的
C.某离子被沉淀完全是指该离子在溶液中的浓度为0
D.物质的溶解性为难溶,则该物质不溶于水
2、下列各组离子,在水溶液中能以较高浓度大量共存的是( )
①I- ClO- NO3- H+ ②K+ NH4+ HCO3- OH-
③ SO42- SO32- Cl- OH- ④Fe3+ Cu2+ SO42- Cl -
⑤H+ K+ AlO2- HSO3- ⑥Ca2+ Na+ SO42- CO32-
A.①⑥ B.③④ C.②⑤ D.①④BB练习小结第四节 难溶电解质的溶解平衡一、溶解平衡二、沉淀反应的应用①沉淀的生成②沉淀的溶解③沉淀的转化三.溶度积和溶度积规则①表达式:(MmAn的饱和溶液) Ksp=[c(Mn+)]m · [c(Am-)]n
②溶度积规则:离子积Qc=c(Mn+)m · c(Am-)n
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.
1g~10g, 可溶
0.01g~1g, 微溶
小于0.01g, 难溶物质在水中的溶解性固体的溶解性:t℃时100克水溶解溶质的质量气体的溶解性:常温常压时1体积水溶解气体的体积大于100体积 极易溶
大于10体积 易溶
大于1体积 可溶
小于1体积 难溶可难难难难难难微微微易易根据溶解度判断并理解电解质是“溶”还是“难溶”?1、生成沉淀的离子反应能发生的原因生成物的溶解度很小(难溶物或微溶物)2、AgCl溶解平衡的建立当 v(溶解)=v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡一、Ag+和 Cl- 的反应真能进行到底吗?3、溶解平衡的特征逆、等、动、定、变4、生成难溶电解质的离子反应的限度难溶电解质的溶解度小于0.01g,离子反应生成难溶电解质,离子浓度小于1×10-5 mol/L时,认为沉淀反应完全,但溶液中还有相应的离子。石灰乳中存在下列平衡:
Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是( )
A、Na2CO3溶液 B、AlCl3溶液
C、NaOH溶液 D、CaCl2溶液AB练习二、沉淀反应的应用1、沉淀的生成(1)应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。(2)方法a 、调pH值如:工业原料氯化铵中混有氯化铁,
加氨水调pH值至7-8Fe3+ + 3NH3?H2O=Fe(OH)3↓+3NH4+b 、加沉淀剂:如沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂Cu2++S2-=CuS↓ Hg2++S2-=HgS↓2、沉淀的溶解(1)原理设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动(2)举例a 、难溶于水的盐溶于酸中
如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸沉淀不溶解沉淀溶解沉淀溶解Mg(OH)2+2HCl = MgCl2+2H2OMg(OH)2+2NH4Cl = MgCl2+2NH3+2H2Ob 、难溶于水的电解质溶于某些盐溶液
如:Mg(OH)2溶于NH4Cl溶液思考与交流 用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因Mg(OH)2+2NH4Cl = MgCl2+2NH3+2H2O产生白色沉淀白色沉淀变黄色黄色沉淀变黑色AgNO3+NaCl = AgCl↓(白色)+NaNO3AgCl+KI = AgI↓(黄色)+KCl2AgI+Na2S = Ag2S↓(黑色)+2NaI产生白色沉淀白色沉淀变红褐色出现红褐色沉淀MgCl2+2NaOH = Mg(OH)2↓(白色)+2NaCl3Mg(OH)2+2FeCl3=2Fe(OH)3↓(红褐色)+3MgCl2牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡: Ca5(PO4)3OH(s) 5Ca2++3PO43-+OH- 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是
。
已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小、质地更坚固。用离子方程表示当牙膏中配有氟化物添加剂后能防止龋齿的原因 。 生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿 5Ca2++3PO43-+F-=Ca5(PO4)3F↓ 练习(1)沉淀转化的方法
对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的沉淀。
(2)沉淀转化的实质
沉淀转化的实质是沉淀溶解平衡移动。一般溶解度小的沉淀转化成溶解度更小的沉淀容易实现。
(3)沉淀转化的应用
沉淀的转化在科研和生产中具有重要的应用价值。
①锅炉除水垢
二、沉淀反应的应用 3、沉淀的转化锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。CaSO4 SO42- + Ca2+ +
CO32-CaCO3②对一些自然现象的解释1、溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数.
2、表达式:(MmAn的饱和溶液) Ksp=[c(Mn+)]m · [c(Am-)]n
3、溶度积规则:离子积Qc=c(Mn+)m · c(Am-)n
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.三.溶度积和溶度积规则1.铬酸银(Ag2CrO4)在298K时的溶解度为0.0045g,求其溶度积。2.在100mL 0.01mol/LKCl 溶液中,加入 1mL 0.01mol/L AgNO3 溶液,有沉淀(已知AgCl KSP=1.8×10-10) ? Ag+沉淀是否完全?练习所以Ag+沉淀完全=9.84×10ˉ121、下列说法中正确的是( )
A.不溶于水的物质溶解度为0
B.绝对不溶解的物质是不存在的
C.某离子被沉淀完全是指该离子在溶液中的浓度为0
D.物质的溶解性为难溶,则该物质不溶于水
2、下列各组离子,在水溶液中能以较高浓度大量共存的是( )
①I- ClO- NO3- H+ ②K+ NH4+ HCO3- OH-
③ SO42- SO32- Cl- OH- ④Fe3+ Cu2+ SO42- Cl -
⑤H+ K+ AlO2- HSO3- ⑥Ca2+ Na+ SO42- CO32-
A.①⑥ B.③④ C.②⑤ D.①④BB练习小结第四节 难溶电解质的溶解平衡一、溶解平衡二、沉淀反应的应用①沉淀的生成②沉淀的溶解③沉淀的转化三.溶度积和溶度积规则①表达式:(MmAn的饱和溶液) Ksp=[c(Mn+)]m · [c(Am-)]n
②溶度积规则:离子积Qc=c(Mn+)m · c(Am-)n
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.
