必修1化学第三章单元练习:金属及其化合物b
文档属性
| 名称 | 必修1化学第三章单元练习:金属及其化合物b |

|
|
| 格式 | rar | ||
| 文件大小 | 68.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-11-07 00:00:00 | ||
图片预览



文档简介
第三章 《 金属及其化合物》单元练习(B)
一、选择题(本题包括4小题,每小题3分,共12分。每题只有一个选项符合或最符合题意)
1、下列说法中不正确的是
A.人类历史上使用最早的合金是青铜
B.司母戊鼎是我国目前已发现的最重的青铜器
C.目前世界上使用量最大的合金是铝合金
D.目前世界上用途最广的合金是钢
2、除去Na2CO3 固体中少量NaHCO3的最佳方法是
A.加入适量盐酸 B.加热
C.加入NaOH溶液 D.配成溶液后通入CO2
3、下列物质的名称和化学式不相符的是
A.磁铁矿(FeO) B.铝土矿(Al2O3)
C.铁红(Fe2O3) D.赤铁矿(Fe2O3)
4、将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A .KSCN B.BaCl2 C. HCl D. NaOH
二、选择题(本题包括8小题,每小题3分,共24分。每小题含有1个或2个正确选项符合或最符合题意,有两个正确选项的答对一个得1分,只要答错一个,该题得0分。)
5、下列有关金属元素特征的叙述正确的是
A.金属元素的原子只有还原性,其阳离子只有氧化性
B.金属元素的单质在常温下都为固体
C.含金属元素的离子都是阳离子
D.金属阳离子被还原不一定得到金属单质
6、下列离子方程式书写正确的是
A.钠和冷水反应 Na+2H2O=Na++2OH(+H2↑
B.Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O
C.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
D.FeCl2溶液通入足量的Cl2反应:Fe2++Cl2=Fe3++2Cl-
7、下列离子在溶液中能大量共存的是
A. B.
C. D.
8、为鉴别K2CO3和NaHCO3两种白色固体,有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中不可行的是
A.分别加入1mol/L的盐酸溶液,看有无气泡产生
B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D.分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
9、下列各组反应中最终肯定不生成白色沉淀的是
A.AlCl3溶液中加入过量氨水
B.Al2(SO4)3溶液中加入过量KOH溶液
C.MgCl2溶液中加入过量氨水
D.MgSO4溶液中加入过量KOH溶液
10、把Ba(OH)2溶液滴入明矾[KAl(SO4)2=K++Al3++2SO42-]溶液中,使SO全部转化成BaSO4沉淀,此时铝元素的主要存在形式是
A.Al3+ B.Al(OH)3 C.AlO D.Al3+和Al(OH)3
11、两种金属的混合物共15g,跟足量的盐酸反应时,恰好得到11.2L氢气(标况)。下列各组金属不可能构成上述条件的混合物的是
A.镁和银 B.铜和锌 C.铝和铁 D.镁和铁
12、将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A.2:1:1 B.1:1:2 C.1:2:1 D.4:3:2
三、选择题(本题包括6小题,每小题3分,共18分。每题只有一个选项符合或最符合题意)
13、把CO2通入含NaOH0.8g的碱溶液中,将产物在减压条件下蒸干后,得固体1.37g,则通入CO2的质量是
A.0.44g B.0.66g C.0.88g D.都不是
14、下列各组中的两种物质作用时,反应条件(温度、反应物用量等)改变,不会引起产物改变的是
A.Na2O2和CO2 B.NaOH和CO2 C.Na和O2 D.Na2CO3和HCl
15、取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为
A.1:1 B.2:3 C.3:2 D.1:6
16、在120℃的条件下,总质量为2.1 g的CO与H2的混合气体在足量的O2中充分燃烧,然后通过足量的Na2O2固体,固体增加的质量为
A. 7.2 g B. 4.2 g C.3.6 g D. 2.1 g
17、某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴滴加1mol/L的NaOH溶液至过量,下列关系图正确的是
A B
C D
18、在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是
A. 不溶物一定是Cu B. 不溶物一定含铜,但不一定含铁
C. 不溶物一定是Fe D. 溶液中一定含有Fe2+,但不一定含有Cu2+
四、填空题(本题包括2小题,每空2分,共10分)
19、怎样用化学方法除去下列物质中混有的少量杂质(用有关反应的离子方程式)。
(1)铜粉中混有铁粉
(2)Na2CO3溶液中混有NaHCO3
(3)FeCl2溶液中混有CuCl2
20、Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个化学反应方程式表示其变化:(1) ,(2) 。
五、推断题(本题包括1小题,共9分)
21、(每空1分,方程式2分,共9分)如图,已知有以下物质相互转化
(1) A转化为B及气体这步反应中应加入的试剂是(填化学式) 。
(2)写出B的化学式 ,F的化学式 。
(3)写出由G转变成H的化学方程式 。
(4)写出检验I溶液中阳离子的离子方程式 ;向I溶液中加入A的有关离子反应方程式是 。
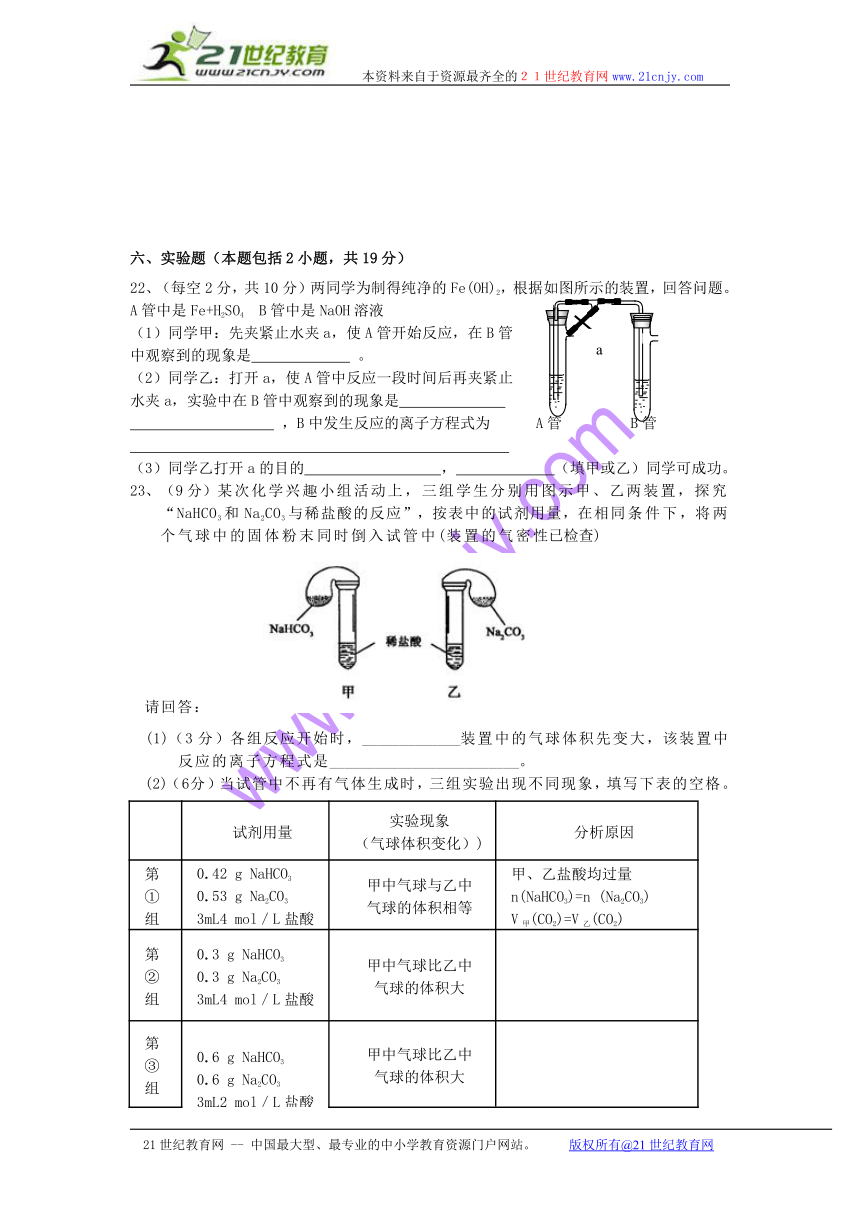
六、实验题(本题包括2小题,共19分)
22、(每空2分,共10分)两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题。A管中是Fe+H2SO4 B管中是NaOH溶液
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管
中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间后再夹紧止
水夹a,实验中在B管中观察到的现象是
,B中发生反应的离子方程式为 A管 B管
(3)同学乙打开a的目的 , (填甲或乙)同学可成功。
23、(9分)某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)
请回答:
(1)(3分)各组反应开始时,_____________装置中的气球体积先变大,该装置中反应的离子方程式是_________________________。
(2)(6分)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
试剂用量
实验现象
(气球体积变化))
分析原因
第
①
组
0.42 g NaHCO3
0.53 g Na2CO3
3mL4 mol/L盐酸
甲中气球与乙中
气球的体积相等
甲、乙盐酸均过量
n(NaHCO3)=n (Na2CO3)
V甲(CO2)=V乙(CO2)
第
②
组
0.3 g NaHCO3
0.3 g Na2CO3
3mL4 mol/L盐酸
甲中气球比乙中
气球的体积大
第
③
组
0.6 g NaHCO3
0.6 g Na2CO3
3mL2 mol/L盐酸
甲中气球比乙中
气球的体积大
片刻后,乙中气球
又缩小,甲中气球
的体积基本不变
(用离子方程式表示)
七、计算题(本题包括1小题,共8分)
24、将3.9gMg、Al合金溶于一定物质的量浓度的HCl溶液400mL中,刚好完全反应,经检测合金和盐酸都无剩余,再向反应后的溶液中加入1mol/L的NaOH溶液后,生成沉淀,如果加入一定量的NaOH溶液后沉淀量最大时,溶液的总体积刚好为合金溶解时的体积的两倍,假设完全反应(不考虑体积变化),请求
(1)生成的沉淀的最大值是多少?
(2)原合金中Mg的质量百分含量(计算结果保留一位小数点)。
参考答案:
一、二、三选择题(两题包括18小题,每小题3分,共54分)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
A
D
D
BD
BC
AC
B
C
题号
11
12
13
14
15
16
17
18
答案
B
AD
B
A
A
D
C
B
四、填空题(本题包括2小题,每空2分,共10分)
19、(1)Fe+2H+=Fe2++H2(
(2)HCO3- + OH- = H2O+CO32-
(3)Cu2+ +Fe=Fe2++Cu
20、(1)2Na+2H2O=2NaOH +H2(
(2)2Al+2NaOH+2H2O = 2NaAlO2 +3 H2(
五、推断题(本题包括1小题,共9分)
21、(每空1分,方程式2分,共9分)(1) HCl (2) FeCl2 KCl
(3) 4Fe(OH)2 +O2 + 2H2O = 4Fe(OH)3 (4)Fe3+ 3SCN-=Fe(SCN)3 2Fe3++Fe=3Fe2+
六、实验题(本题包括2小题,共19分)
22、(每空2分,共10分)(1)在B管中观察到的现象是:红褐色沉淀 (2)有白色沉淀生成 Fe2++2OH-=Fe(OH)2( (3)使A管中产生的气体通入B管中赶跑空气 乙
23、(9分,第一空1分,其余没空2分)(1)甲 HCO3-+H+=CO2↑+H2O (2)
试剂用量
实验现象
(气球体积变化)
分析原因
第
②
组
甲、乙盐酸均过量n(NaHCO3)>n(Na2CO3)
V(CO2)甲>V(CO2)乙
第
③
组
甲、乙盐酸均不足量,
消耗的n(NaHCO3)>n (Na2CO3)
V(CO2)甲>V(CO2)乙
(用离子方程式表示)
CO2+H2O+CO32-=2HCO3-
七、计算题(本题包括1小题,共8分)
24、(1)10.7g (2)30.8%
21世纪教育网
一、选择题(本题包括4小题,每小题3分,共12分。每题只有一个选项符合或最符合题意)
1、下列说法中不正确的是
A.人类历史上使用最早的合金是青铜
B.司母戊鼎是我国目前已发现的最重的青铜器
C.目前世界上使用量最大的合金是铝合金
D.目前世界上用途最广的合金是钢
2、除去Na2CO3 固体中少量NaHCO3的最佳方法是
A.加入适量盐酸 B.加热
C.加入NaOH溶液 D.配成溶液后通入CO2
3、下列物质的名称和化学式不相符的是
A.磁铁矿(FeO) B.铝土矿(Al2O3)
C.铁红(Fe2O3) D.赤铁矿(Fe2O3)
4、将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A .KSCN B.BaCl2 C. HCl D. NaOH
二、选择题(本题包括8小题,每小题3分,共24分。每小题含有1个或2个正确选项符合或最符合题意,有两个正确选项的答对一个得1分,只要答错一个,该题得0分。)
5、下列有关金属元素特征的叙述正确的是
A.金属元素的原子只有还原性,其阳离子只有氧化性
B.金属元素的单质在常温下都为固体
C.含金属元素的离子都是阳离子
D.金属阳离子被还原不一定得到金属单质
6、下列离子方程式书写正确的是
A.钠和冷水反应 Na+2H2O=Na++2OH(+H2↑
B.Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O
C.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
D.FeCl2溶液通入足量的Cl2反应:Fe2++Cl2=Fe3++2Cl-
7、下列离子在溶液中能大量共存的是
A. B.
C. D.
8、为鉴别K2CO3和NaHCO3两种白色固体,有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中不可行的是
A.分别加入1mol/L的盐酸溶液,看有无气泡产生
B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D.分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
9、下列各组反应中最终肯定不生成白色沉淀的是
A.AlCl3溶液中加入过量氨水
B.Al2(SO4)3溶液中加入过量KOH溶液
C.MgCl2溶液中加入过量氨水
D.MgSO4溶液中加入过量KOH溶液
10、把Ba(OH)2溶液滴入明矾[KAl(SO4)2=K++Al3++2SO42-]溶液中,使SO全部转化成BaSO4沉淀,此时铝元素的主要存在形式是
A.Al3+ B.Al(OH)3 C.AlO D.Al3+和Al(OH)3
11、两种金属的混合物共15g,跟足量的盐酸反应时,恰好得到11.2L氢气(标况)。下列各组金属不可能构成上述条件的混合物的是
A.镁和银 B.铜和锌 C.铝和铁 D.镁和铁
12、将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A.2:1:1 B.1:1:2 C.1:2:1 D.4:3:2
三、选择题(本题包括6小题,每小题3分,共18分。每题只有一个选项符合或最符合题意)
13、把CO2通入含NaOH0.8g的碱溶液中,将产物在减压条件下蒸干后,得固体1.37g,则通入CO2的质量是
A.0.44g B.0.66g C.0.88g D.都不是
14、下列各组中的两种物质作用时,反应条件(温度、反应物用量等)改变,不会引起产物改变的是
A.Na2O2和CO2 B.NaOH和CO2 C.Na和O2 D.Na2CO3和HCl
15、取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为
A.1:1 B.2:3 C.3:2 D.1:6
16、在120℃的条件下,总质量为2.1 g的CO与H2的混合气体在足量的O2中充分燃烧,然后通过足量的Na2O2固体,固体增加的质量为
A. 7.2 g B. 4.2 g C.3.6 g D. 2.1 g
17、某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴滴加1mol/L的NaOH溶液至过量,下列关系图正确的是
A B
C D
18、在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是
A. 不溶物一定是Cu B. 不溶物一定含铜,但不一定含铁
C. 不溶物一定是Fe D. 溶液中一定含有Fe2+,但不一定含有Cu2+
四、填空题(本题包括2小题,每空2分,共10分)
19、怎样用化学方法除去下列物质中混有的少量杂质(用有关反应的离子方程式)。
(1)铜粉中混有铁粉
(2)Na2CO3溶液中混有NaHCO3
(3)FeCl2溶液中混有CuCl2
20、Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个化学反应方程式表示其变化:(1) ,(2) 。
五、推断题(本题包括1小题,共9分)
21、(每空1分,方程式2分,共9分)如图,已知有以下物质相互转化
(1) A转化为B及气体这步反应中应加入的试剂是(填化学式) 。
(2)写出B的化学式 ,F的化学式 。
(3)写出由G转变成H的化学方程式 。
(4)写出检验I溶液中阳离子的离子方程式 ;向I溶液中加入A的有关离子反应方程式是 。
六、实验题(本题包括2小题,共19分)
22、(每空2分,共10分)两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题。A管中是Fe+H2SO4 B管中是NaOH溶液
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管
中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间后再夹紧止
水夹a,实验中在B管中观察到的现象是
,B中发生反应的离子方程式为 A管 B管
(3)同学乙打开a的目的 , (填甲或乙)同学可成功。
23、(9分)某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)
请回答:
(1)(3分)各组反应开始时,_____________装置中的气球体积先变大,该装置中反应的离子方程式是_________________________。
(2)(6分)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
试剂用量
实验现象
(气球体积变化))
分析原因
第
①
组
0.42 g NaHCO3
0.53 g Na2CO3
3mL4 mol/L盐酸
甲中气球与乙中
气球的体积相等
甲、乙盐酸均过量
n(NaHCO3)=n (Na2CO3)
V甲(CO2)=V乙(CO2)
第
②
组
0.3 g NaHCO3
0.3 g Na2CO3
3mL4 mol/L盐酸
甲中气球比乙中
气球的体积大
第
③
组
0.6 g NaHCO3
0.6 g Na2CO3
3mL2 mol/L盐酸
甲中气球比乙中
气球的体积大
片刻后,乙中气球
又缩小,甲中气球
的体积基本不变
(用离子方程式表示)
七、计算题(本题包括1小题,共8分)
24、将3.9gMg、Al合金溶于一定物质的量浓度的HCl溶液400mL中,刚好完全反应,经检测合金和盐酸都无剩余,再向反应后的溶液中加入1mol/L的NaOH溶液后,生成沉淀,如果加入一定量的NaOH溶液后沉淀量最大时,溶液的总体积刚好为合金溶解时的体积的两倍,假设完全反应(不考虑体积变化),请求
(1)生成的沉淀的最大值是多少?
(2)原合金中Mg的质量百分含量(计算结果保留一位小数点)。
参考答案:
一、二、三选择题(两题包括18小题,每小题3分,共54分)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
A
D
D
BD
BC
AC
B
C
题号
11
12
13
14
15
16
17
18
答案
B
AD
B
A
A
D
C
B
四、填空题(本题包括2小题,每空2分,共10分)
19、(1)Fe+2H+=Fe2++H2(
(2)HCO3- + OH- = H2O+CO32-
(3)Cu2+ +Fe=Fe2++Cu
20、(1)2Na+2H2O=2NaOH +H2(
(2)2Al+2NaOH+2H2O = 2NaAlO2 +3 H2(
五、推断题(本题包括1小题,共9分)
21、(每空1分,方程式2分,共9分)(1) HCl (2) FeCl2 KCl
(3) 4Fe(OH)2 +O2 + 2H2O = 4Fe(OH)3 (4)Fe3+ 3SCN-=Fe(SCN)3 2Fe3++Fe=3Fe2+
六、实验题(本题包括2小题,共19分)
22、(每空2分,共10分)(1)在B管中观察到的现象是:红褐色沉淀 (2)有白色沉淀生成 Fe2++2OH-=Fe(OH)2( (3)使A管中产生的气体通入B管中赶跑空气 乙
23、(9分,第一空1分,其余没空2分)(1)甲 HCO3-+H+=CO2↑+H2O (2)
试剂用量
实验现象
(气球体积变化)
分析原因
第
②
组
甲、乙盐酸均过量n(NaHCO3)>n(Na2CO3)
V(CO2)甲>V(CO2)乙
第
③
组
甲、乙盐酸均不足量,
消耗的n(NaHCO3)>n (Na2CO3)
V(CO2)甲>V(CO2)乙
(用离子方程式表示)
CO2+H2O+CO32-=2HCO3-
七、计算题(本题包括1小题,共8分)
24、(1)10.7g (2)30.8%
21世纪教育网
