原电池课件
图片预览


文档简介
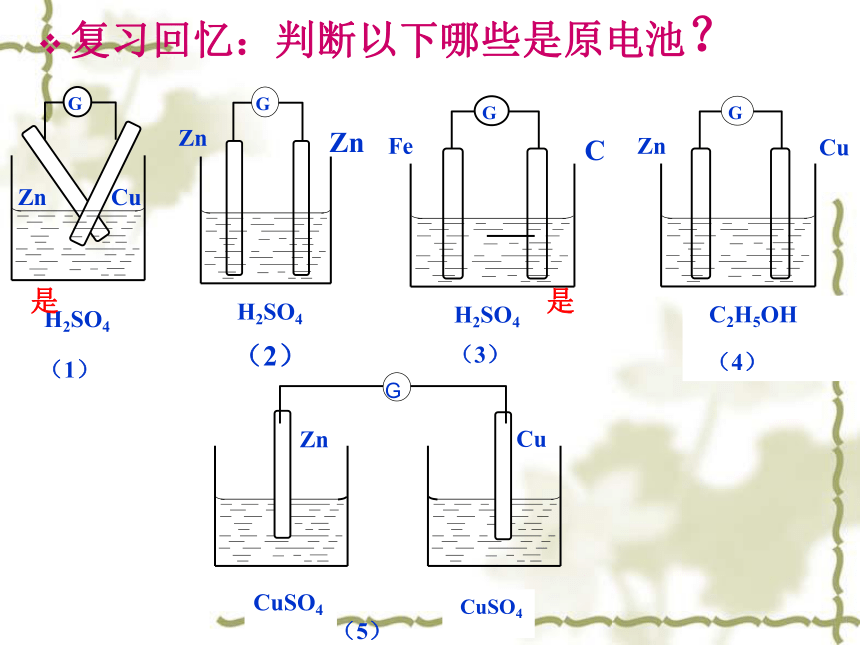
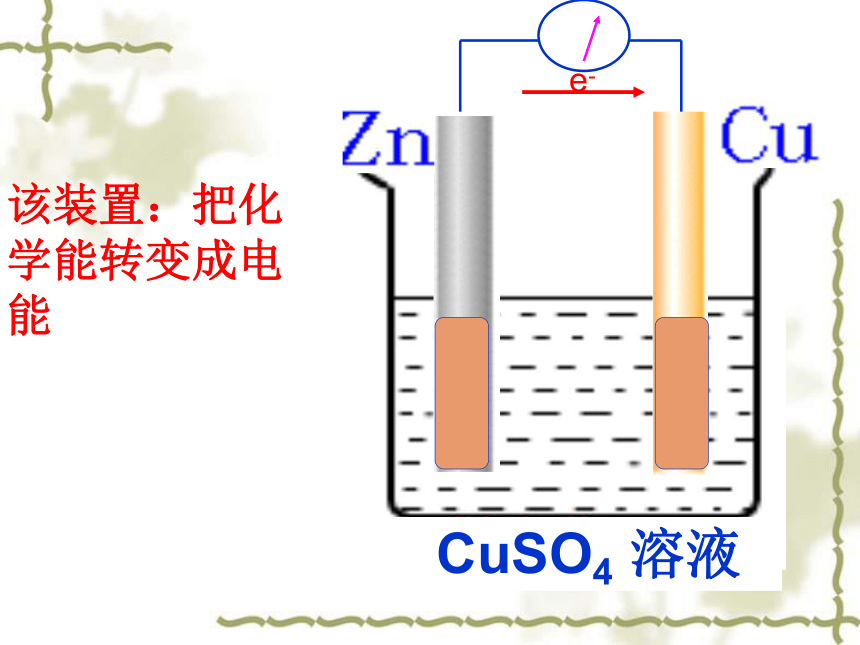
课件13张PPT。第四章 电化学基础第一节 原 电 池复习回忆:判断以下哪些是原电池?是是一、形成原电池的几个条件是 :本质和核心:发生自发氧化还原反应。 1、两个活泼性不同的电极。
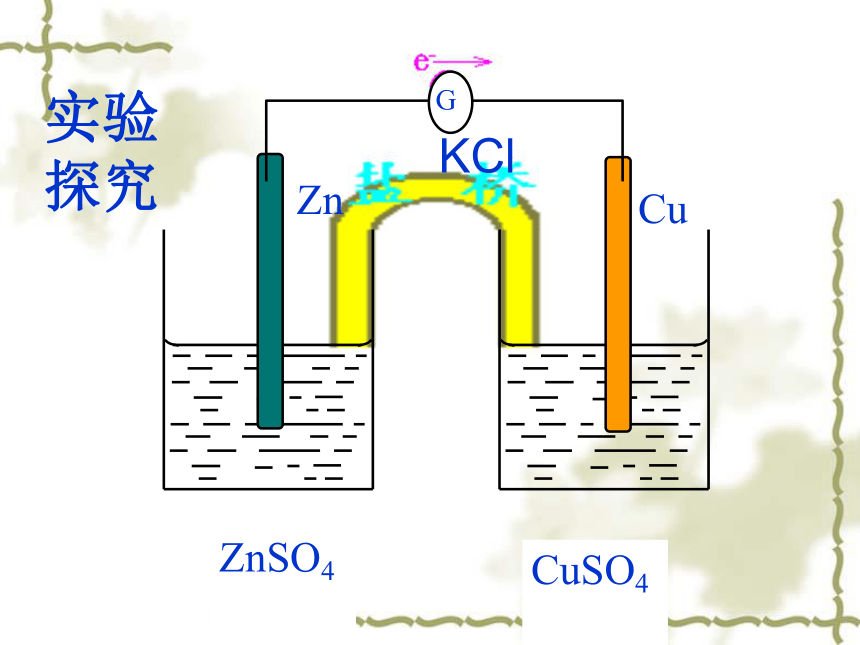
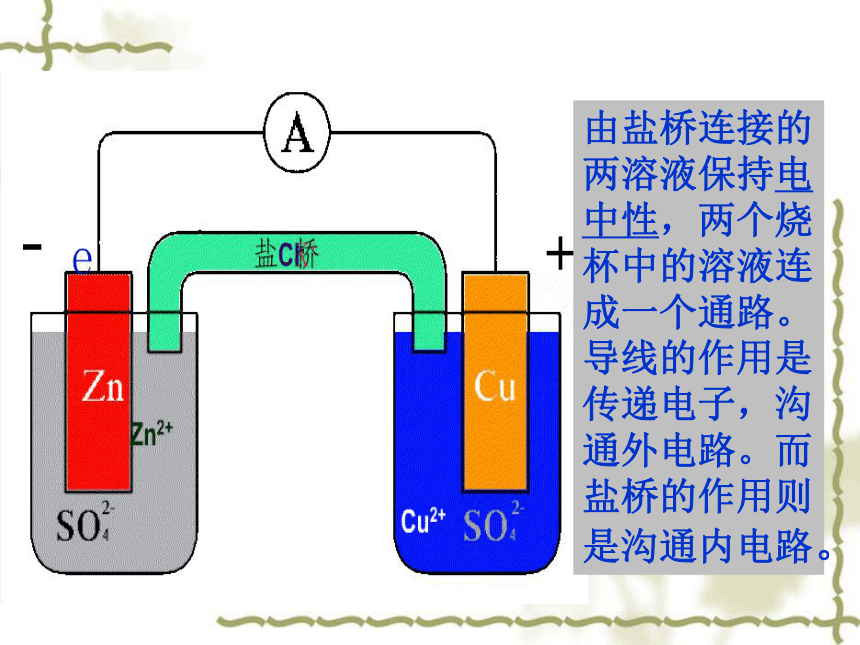
2、电解质溶液 。 3、形成闭合回路。该装置:把化学能转变成电能KCl实验探究由盐桥连接的两溶液保持电中性,两个烧杯中的溶液连成一个通路。
导线的作用是传递电子,沟通外电路。而盐桥的作用则是沟通内电路。写出其电极反应式CuSO4FeSO4Fe
Cu
该原电池反应原理?电极反应式和总方程式.思考讨论1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液 逆向思维:
利用刚才Fe + Cu2+=Fe2+ +Cu,设计一个原电池.CuFeCuSO4FeSO4化合价升高 失2e- 化合价降低 得2e-思考讨论:利用此氧化还原反应来设计原电池,写出电极反应式。并画出装置图
(Cu+ 2 FeCl3 = CuCl2+ 2FeCl2)
化合价降低得2e-Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
化合价升高失2e-
Cu
C
CuCl2
FeCl3
装置图离子方程式Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag化合价升高失2e-化合价降低得2e-电极:负极是Cu,正极可以是Ag或C等。 电极反应式:
负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag电解液: AgNO3 或者: Cu(NO3)2 、AgNO3 思考讨论:利用该反应设计原电池总结1、复习回忆了原电池的形成。
2、进一步了解原电池的反应原理,正确书写电极反应式。
3、利用氧化还原反应原理设计了原电池。
2、电解质溶液 。 3、形成闭合回路。该装置:把化学能转变成电能KCl实验探究由盐桥连接的两溶液保持电中性,两个烧杯中的溶液连成一个通路。
导线的作用是传递电子,沟通外电路。而盐桥的作用则是沟通内电路。写出其电极反应式CuSO4FeSO4Fe
Cu
该原电池反应原理?电极反应式和总方程式.思考讨论1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液 逆向思维:
利用刚才Fe + Cu2+=Fe2+ +Cu,设计一个原电池.CuFeCuSO4FeSO4化合价升高 失2e- 化合价降低 得2e-思考讨论:利用此氧化还原反应来设计原电池,写出电极反应式。并画出装置图
(Cu+ 2 FeCl3 = CuCl2+ 2FeCl2)
化合价降低得2e-Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
化合价升高失2e-
Cu
C
CuCl2
FeCl3
装置图离子方程式Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
Cu+ 2 AgNO3 = Cu(NO3)2 + 2Ag化合价升高失2e-化合价降低得2e-电极:负极是Cu,正极可以是Ag或C等。 电极反应式:
负极:Cu – 2e- = Cu2+ 正极:2Ag+ + 2e- = 2 Ag电解液: AgNO3 或者: Cu(NO3)2 、AgNO3 思考讨论:利用该反应设计原电池总结1、复习回忆了原电池的形成。
2、进一步了解原电池的反应原理,正确书写电极反应式。
3、利用氧化还原反应原理设计了原电池。
