名师一号第二章总结
图片预览






文档简介
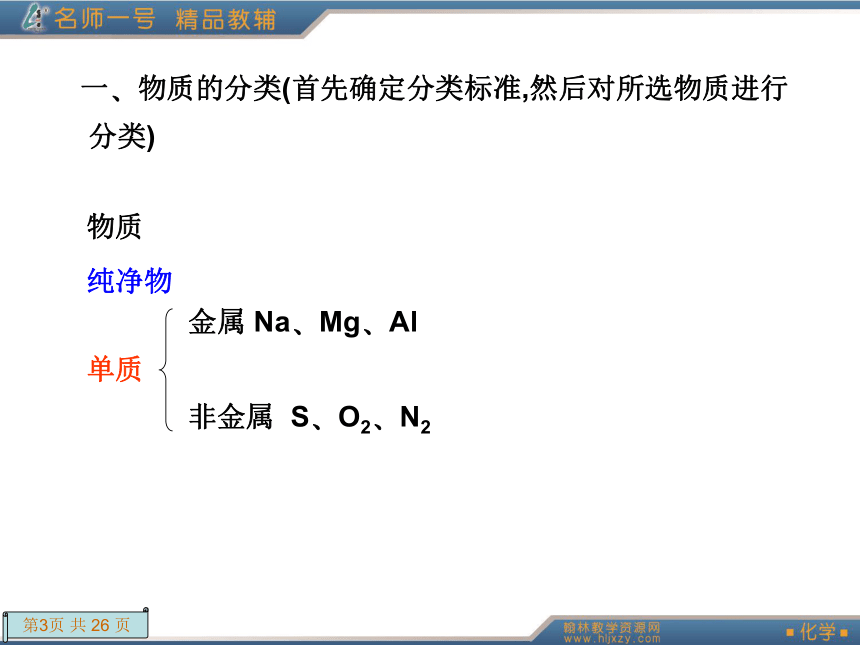
课件26张PPT。章末总结提升本章知识体系展现(学生用书P48) 一?物质的分类(首先确定分类标准,然后对所选物质进行分类)物质 纯净物 单质 金属 Na?Mg?Al非金属 S?O2?N2化合物 按组成分 氧化物 酸性氧化物 SO2?SO3?P2O5碱性氧化物 Na2O?CaO?Fe2O3两性氧化物 Al2O3不成盐氧化物 CO?NO酸 按酸根分含氧酸 HNO3?H2SO4无氧酸 HCl按电离出
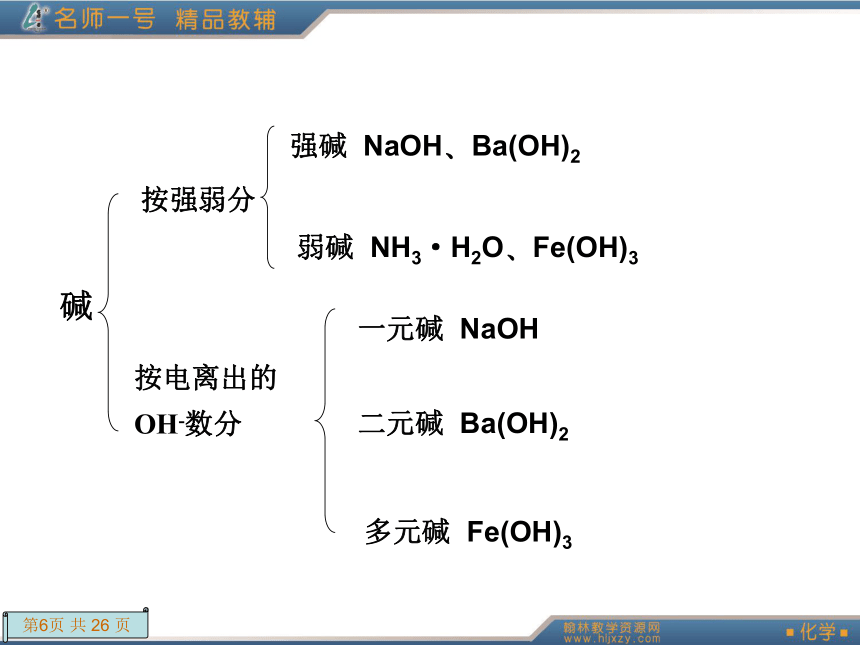
的H+数分 一元酸 HCl?HNO3二元酸 H2SO4?H2SO3多元酸 H3PO4碱 按强弱分 强碱 NaOH?Ba(OH)2弱碱 NH3·H2O?Fe(OH)3按电离出的
OH-数分 一元碱 NaOH二元碱 Ba(OH)2多元碱 Fe(OH)3盐 正盐 Na2CO3酸式盐 NaHCO3碱式盐 Cu2(OH)2CO3按性质分 电解质 溶于水或熔融状态下能自身电离出自由移动的离子的化合
物?酸?碱?盐是电解质非电解质混合物 普通混合物分散系 —— 溶液——分散质粒子直径小于1 nm,可以透过滤纸和半透膜胶体——分散质粒子直径在1~100 nm之间,具有介稳性?丁达尔效应?聚沉?电泳,不能透过半透膜,能透过滤纸浊液——分散质粒子直径大于100 nm,不能透过滤纸和半透膜 二?化学反应根据反应物
和生成物的
类别以及反
应前后物质
种类的多少化合反应:A+B=AB(部分为氧化还原反应)分解反应:AB=A+B(部分为氧化还原反应)置换反应:A+BC=AC+B(全为氧化还原反应)复分解反应:AB+CD=AD+CB(全为非氧化还原反应)根据反应中是否有
离子参加
(离子反应) 定义:有离子参加的一类反应,主要包括复分解反应?有离子参
加的置换反应离子方程式 定义:用实际参加反应的离子符号来表示化学反应的式子书写
方法 写:写出反应的化学方程式拆:把易溶于水?易电离的物质拆写成离子形式删:将不参加反应的离子从化学方程式
两端删去查:查化学方程式两端原子个数和电荷数是否相等意义:不仅表示了某一个化学反应,而且表示了某一类型的所有化学反应正误判断:五“看”
书写原则实质:向着某种离子浓度减小的方向进行类型 离子非氧化还原反应 离子互换反应(生成气体?沉淀或弱电解质)碱性氧化物与酸反应酸性氧化物与碱反应离子氧化
还原反应 置换反应(金属单质或非金属单质的相对活动性)一般离子氧化还原反应(生成氧化性或还原性更弱的物质)根据反应中是否有电子转移 氧化还原反应 实质:有电子转移(得失或偏移)特征:反应前后元素的化合价有变化概念及其相互关系反应物 氧化剂 (有氧化性)得电子 化合价(降低) 发生(还原)反应 (还原)产物同时存在 同时体现 数目相等 同时发生 同时产生 还原剂 (有还原性)失电子 化合价(升高) 发生(氧化)反应 (氧化)产物 生成物 电子转移
表示方法 双线桥法: 失去2e- 得到2e- 单线桥法: 2e- 非氧化还原反应专 题 探 究(学生用书P49) 专题一 离子方程式的正误判断及设错方式
纵观近几年高考试题,离子方程式的正误判断题型的再现率达100%,而且这类试题的失分率居高不下,但所考查的知识并不是无边无际?现对这类试题进行归类?分析?总结如下:
设错方式1:不符合客观事实,错写反应产物
如2Fe3++3S2-=Fe2S3,Fe3+有氧化性,S2-有还原性,Fe3+可将S2-氧化为S,即应写成2Fe3++S2-=2Fe2++S↓? 设错方式2:漏写部分离子反应
如Ba(OH)2溶液与H2SO4溶液反应:Ba2++SO2-4=BaSO4↓, 同学们只注意了Ba2+与SO2-4的反应,而漏掉了H+与OH-的反应?
设错方式3:错写反应物或产物的配比关系
如Ba(OH)2溶液与H2SO4溶液反应:Ba2++OH-+H++SO2- 4=BaSO4↓+H2O,应写成Ba2++2OH-+2H++SO2- 4=BaSO4↓+2H2O? 设错方式4:电荷不守恒或原子不守恒
如Fe2++Cl2=Fe3++2Cl-,应写成2Fe2++Cl2=2Fe3++2Cl-?
设错方式5:氧化还原反应中得失电子不守恒
如2MnO-4+3H2O2+6H+=2Mn2++4O2↑+6H2O,应写成 2MnO-4+5H2O2+6H+=2Mn2++5O2↑+8H2O?
设错方式6:忽视了题设条件及要求
如“过量”?“少量”?“等物质的量”?“适量”?“任意量”以及滴加顺序等对反应方程式或产物的影响? 与量有关的离子方程式的书写,其关键是明确反应原理,量不同,离子方程式不同,以少(不足量的物质)定多(过量的物质),量少的定为1 mol,量 多的物质根据1 mol量少物质的反应用量来确定,即“以少定多”原则?
如:NaHCO3溶液和Ca(OH)2溶液混合,当Ca(OH)2不足时,Ca2+?OH-应完全反应,离子方程式:2HCO-3+Ca2++2OH-=CaCO3↓+2H2O+CO2-3?
当Ca(OH)2过量时,HCO-3应完全反应,Ca2+?OH-有剩余,离子方程式:HCO-3+Ca2++OH-=CaCO3↓+H2O? 例1:下列离子方程式书写正确的是( )
A.碳酸钡和稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.向AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
D.少量CO2通入澄清石灰水:CO2+Ca2++2OH- =CaCO3↓+H2OD 〔解析〕 A中BaCO3与H2SO4反应生成BaSO4沉淀,正确的离子方程式为:BaCO3+2H++SO2- 4=BaSO4↓+H2O+CO2↑;B中离子方程式电荷不守恒,正 确的离子方程式为2Al+6H+=2Al3++3H2↑;C中NH3·H2O是弱碱不能拆成OH-,正确的离子方程式为:Al3++3NH3·H2O=3NH+4+Al(OH)3↓,只有D正确? 专题二 氧化还原反应的计算
氧化还原反应比较典型的计算有:求氧化剂与还原剂的物质的量之比或质量比,计算参加反应的氧化剂或还原剂的量,确定反应前后某一元素的价态变化等,计算的关键是依据氧化剂得电子总数等于还原剂失电子总数,列出守恒关系式求解?计算公式如下:
氧化剂物质的量×变价元素原子的个数×化合价的变化值=还原剂物质的量×变价元素原子的个数×化合价的变化值? 例2:24 mL 0.05 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应?已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3
C.+4 D.+5B 〔解析〕 本题为典型的氧化还原反应计算,能正确表示出氧化剂得电子总数?还原剂失电子总数是解题的关键? 根据氧化还原反应中得失电子总数相等,判断Cr元素在还原产物里的价态?
n(Na2SO3)=0.05 mol·L-1×0.024 L=0.0012 mol
n(K2Cr2O7)=0.02 mol·L-1×0.02 L=0.0004 mol
K2Cr2O7在反应中得电子:0.0004×2×(6-x) mol得2×(6-x)×e- 失2e- Na2SO3在反应中失电子:0.0012×2 mol?根据氧化还原反应中,氧化剂和还原剂得失电子总数相等,则有:0.0004×2×(6-x)=0.0012×2,解得x=3?
的H+数分 一元酸 HCl?HNO3二元酸 H2SO4?H2SO3多元酸 H3PO4碱 按强弱分 强碱 NaOH?Ba(OH)2弱碱 NH3·H2O?Fe(OH)3按电离出的
OH-数分 一元碱 NaOH二元碱 Ba(OH)2多元碱 Fe(OH)3盐 正盐 Na2CO3酸式盐 NaHCO3碱式盐 Cu2(OH)2CO3按性质分 电解质 溶于水或熔融状态下能自身电离出自由移动的离子的化合
物?酸?碱?盐是电解质非电解质混合物 普通混合物分散系 —— 溶液——分散质粒子直径小于1 nm,可以透过滤纸和半透膜胶体——分散质粒子直径在1~100 nm之间,具有介稳性?丁达尔效应?聚沉?电泳,不能透过半透膜,能透过滤纸浊液——分散质粒子直径大于100 nm,不能透过滤纸和半透膜 二?化学反应根据反应物
和生成物的
类别以及反
应前后物质
种类的多少化合反应:A+B=AB(部分为氧化还原反应)分解反应:AB=A+B(部分为氧化还原反应)置换反应:A+BC=AC+B(全为氧化还原反应)复分解反应:AB+CD=AD+CB(全为非氧化还原反应)根据反应中是否有
离子参加
(离子反应) 定义:有离子参加的一类反应,主要包括复分解反应?有离子参
加的置换反应离子方程式 定义:用实际参加反应的离子符号来表示化学反应的式子书写
方法 写:写出反应的化学方程式拆:把易溶于水?易电离的物质拆写成离子形式删:将不参加反应的离子从化学方程式
两端删去查:查化学方程式两端原子个数和电荷数是否相等意义:不仅表示了某一个化学反应,而且表示了某一类型的所有化学反应正误判断:五“看”
书写原则实质:向着某种离子浓度减小的方向进行类型 离子非氧化还原反应 离子互换反应(生成气体?沉淀或弱电解质)碱性氧化物与酸反应酸性氧化物与碱反应离子氧化
还原反应 置换反应(金属单质或非金属单质的相对活动性)一般离子氧化还原反应(生成氧化性或还原性更弱的物质)根据反应中是否有电子转移 氧化还原反应 实质:有电子转移(得失或偏移)特征:反应前后元素的化合价有变化概念及其相互关系反应物 氧化剂 (有氧化性)得电子 化合价(降低) 发生(还原)反应 (还原)产物同时存在 同时体现 数目相等 同时发生 同时产生 还原剂 (有还原性)失电子 化合价(升高) 发生(氧化)反应 (氧化)产物 生成物 电子转移
表示方法 双线桥法: 失去2e- 得到2e- 单线桥法: 2e- 非氧化还原反应专 题 探 究(学生用书P49) 专题一 离子方程式的正误判断及设错方式
纵观近几年高考试题,离子方程式的正误判断题型的再现率达100%,而且这类试题的失分率居高不下,但所考查的知识并不是无边无际?现对这类试题进行归类?分析?总结如下:
设错方式1:不符合客观事实,错写反应产物
如2Fe3++3S2-=Fe2S3,Fe3+有氧化性,S2-有还原性,Fe3+可将S2-氧化为S,即应写成2Fe3++S2-=2Fe2++S↓? 设错方式2:漏写部分离子反应
如Ba(OH)2溶液与H2SO4溶液反应:Ba2++SO2-4=BaSO4↓, 同学们只注意了Ba2+与SO2-4的反应,而漏掉了H+与OH-的反应?
设错方式3:错写反应物或产物的配比关系
如Ba(OH)2溶液与H2SO4溶液反应:Ba2++OH-+H++SO2- 4=BaSO4↓+H2O,应写成Ba2++2OH-+2H++SO2- 4=BaSO4↓+2H2O? 设错方式4:电荷不守恒或原子不守恒
如Fe2++Cl2=Fe3++2Cl-,应写成2Fe2++Cl2=2Fe3++2Cl-?
设错方式5:氧化还原反应中得失电子不守恒
如2MnO-4+3H2O2+6H+=2Mn2++4O2↑+6H2O,应写成 2MnO-4+5H2O2+6H+=2Mn2++5O2↑+8H2O?
设错方式6:忽视了题设条件及要求
如“过量”?“少量”?“等物质的量”?“适量”?“任意量”以及滴加顺序等对反应方程式或产物的影响? 与量有关的离子方程式的书写,其关键是明确反应原理,量不同,离子方程式不同,以少(不足量的物质)定多(过量的物质),量少的定为1 mol,量 多的物质根据1 mol量少物质的反应用量来确定,即“以少定多”原则?
如:NaHCO3溶液和Ca(OH)2溶液混合,当Ca(OH)2不足时,Ca2+?OH-应完全反应,离子方程式:2HCO-3+Ca2++2OH-=CaCO3↓+2H2O+CO2-3?
当Ca(OH)2过量时,HCO-3应完全反应,Ca2+?OH-有剩余,离子方程式:HCO-3+Ca2++OH-=CaCO3↓+H2O? 例1:下列离子方程式书写正确的是( )
A.碳酸钡和稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.向AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
D.少量CO2通入澄清石灰水:CO2+Ca2++2OH- =CaCO3↓+H2OD 〔解析〕 A中BaCO3与H2SO4反应生成BaSO4沉淀,正确的离子方程式为:BaCO3+2H++SO2- 4=BaSO4↓+H2O+CO2↑;B中离子方程式电荷不守恒,正 确的离子方程式为2Al+6H+=2Al3++3H2↑;C中NH3·H2O是弱碱不能拆成OH-,正确的离子方程式为:Al3++3NH3·H2O=3NH+4+Al(OH)3↓,只有D正确? 专题二 氧化还原反应的计算
氧化还原反应比较典型的计算有:求氧化剂与还原剂的物质的量之比或质量比,计算参加反应的氧化剂或还原剂的量,确定反应前后某一元素的价态变化等,计算的关键是依据氧化剂得电子总数等于还原剂失电子总数,列出守恒关系式求解?计算公式如下:
氧化剂物质的量×变价元素原子的个数×化合价的变化值=还原剂物质的量×变价元素原子的个数×化合价的变化值? 例2:24 mL 0.05 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应?已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3
C.+4 D.+5B 〔解析〕 本题为典型的氧化还原反应计算,能正确表示出氧化剂得电子总数?还原剂失电子总数是解题的关键? 根据氧化还原反应中得失电子总数相等,判断Cr元素在还原产物里的价态?
n(Na2SO3)=0.05 mol·L-1×0.024 L=0.0012 mol
n(K2Cr2O7)=0.02 mol·L-1×0.02 L=0.0004 mol
K2Cr2O7在反应中得电子:0.0004×2×(6-x) mol得2×(6-x)×e- 失2e- Na2SO3在反应中失电子:0.0012×2 mol?根据氧化还原反应中,氧化剂和还原剂得失电子总数相等,则有:0.0004×2×(6-x)=0.0012×2,解得x=3?
