钠和钠的化合物课件
图片预览








文档简介
课件22张PPT。第二节 几种重要的金属化合物第一课时 钠的化合物?已有知识储备 钠的化合物有很多,用途也很广泛.在初中已过NaOH和NaCl,其中NaCl是食盐中的主要成分。
在一定条件下钠跟氧气可以分别生成氧化钠和过氧化钠。
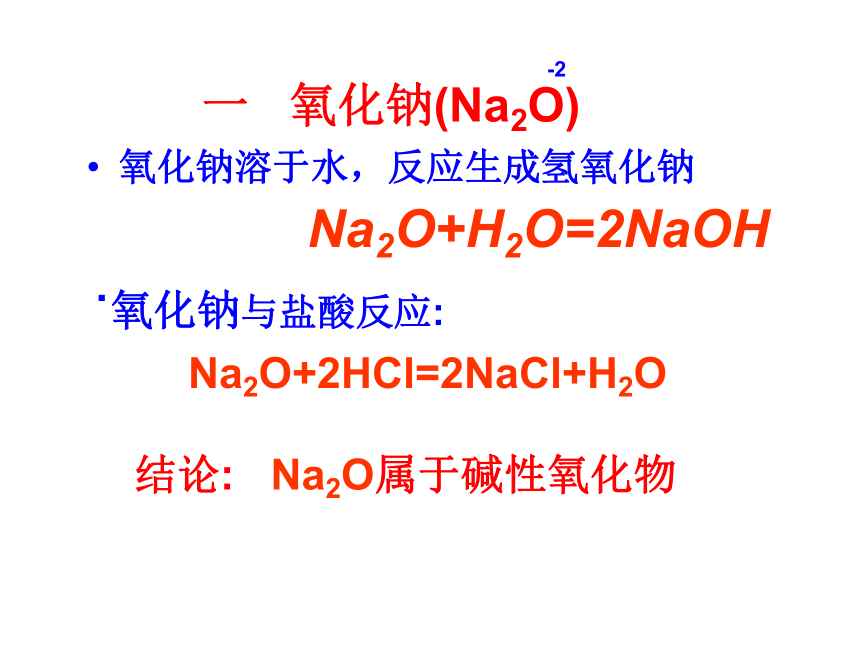
4Na +O2 === 2Na2O (白色)常温2 Na +O2 Na2O2 (淡黄色)Na2O+H2O=2NaOH氧化钠溶于水,反应生成氢氧化钠Na2O+2HCl=2NaCl+H2O
.氧化钠与盐酸反应:
一 氧化钠(Na2O)结论: Na2O属于碱性氧化物-2二 过氧化钠 (Na2O2) 颜色:淡黄色
状态:粉末状固体 思考:溶解度 钠的另一个含氧化合物——Na2O与水发生化学反应,已经是属于Na2O的化学性质。
Na2O2是否也会表现出类似的性质呢?退 出过氧化钠的物理性质-1过氧化钠的化学性质1、取一支装有Na2O2的试管,打开试管胶塞 缓慢加入少量水,并用拇指堵住试管口。
(观察到有什么现象?)
(用手摸一下试管,有什么感觉?)
2、? 用带火星的木条伸入试管。
(观察到什么现象?)
3、? 向试管中加入几滴无色酚酞。
(观察到什么现象?)
(振荡后又是什么现象?)1、跟水反应 过氧化钠的化学性质反应生成有O2;反应放热;反应生成 NaOH;Na2O2具有漂白性;(2)实验结论:1、试管中发生剧烈反应, 产生大量无色气泡,且此气体能使带火星木条复燃;
2、试管发烫;
3、无色酚酞变红;
4、振荡后红色褪去; 过氧化钠的化学性质(3)实验结论: 2 Na2O2 + 2H2O === 4NaOH + O2↑ 既是氧化剂,又是还原剂。那么Na2O2在这个反应中充当了什么角色呢? 有哪些元素发生了化合价的变化了呢? 只有氧元素;失2e-得2e-1-20 2 与二氧化碳的反应2Na2O2 + 2CO2 == 2Na2CO3 + O2 放热
失2e-得2e-Na2O2既是氧化剂,又是还原剂实验Na2O2的用途 潜水艇漂白剂 →漂白某些物质例.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,可观察到的现象为( )
A 溶液仍为紫色
B 溶液最终变为蓝色
C 最终溶液褪色,无其他现象
D 有气泡产生,溶液最终为无色D[思考] ???1.根据Na2O2性质,想一想Na2O2应如何保存??2.把Na2O2投入到FeSO4溶液中,会观察到哪些现象? 为什么?三 碳酸钠和碳酸氢钠俗 名纯碱或苏打小苏打Na2CO3.10H2O——思考:
通过滴加酚酞的对比实验,能说明一个什么问题?Na2CO3NaHCO3Na2CO3和NaHCO3在水中的溶解性 Na2CO3和NaHCO3在水中的溶解性 __总结仍有固体残留溶液变微红色 白色粉未,加水结块成晶体,放热 白色粉未,加水部分溶解,感受不到热量变化振荡长时间可溶解溶液变红色 加水先变成含结晶水的晶体,溶液的碱性比NaHCO3强
加水部分溶解,溶液的碱性比Na2CO3弱初步结论(1)Na2CO3和NaHCO3的热稳定性 化学性质
热稳定性
现象:1号试管: 澄 清石灰水变浑浊2号试管: 澄 清石灰水不变浑浊② Na2CO3 稳定, 受热不分解① NaHCO3不稳定,受热可分解结论:2NaHCO3===Na2CO3+H2O+CO2总结 : 热稳定性:Na2CO3 > NaHCO3应用: 此性质可鉴别NaHCO3固体和NaHCO3固体(2)与 酸 反 应与酸反应化学性质
碳酸钠和碳酸氢钠都易与酸反应,但是
碳酸氢钠与酸反应比碳酸钠更剧裂为什么?结论:〖讨 论〗
1、如何除去Na2CO3中少量的NaHCO3?
加热用 途制玻璃制皂造纸纺织等 发酵剂灭火剂等Na2CO3NaHCO3制药课堂练习某化学兴趣小组欲制作一泡沫灭火器。现有:盐酸、碳酸钠、碳酸氢钠,请问他们最好选用 和 反应,为什么?
盐酸 碳酸氢钠谢谢大家!
在一定条件下钠跟氧气可以分别生成氧化钠和过氧化钠。
4Na +O2 === 2Na2O (白色)常温2 Na +O2 Na2O2 (淡黄色)Na2O+H2O=2NaOH氧化钠溶于水,反应生成氢氧化钠Na2O+2HCl=2NaCl+H2O
.氧化钠与盐酸反应:
一 氧化钠(Na2O)结论: Na2O属于碱性氧化物-2二 过氧化钠 (Na2O2) 颜色:淡黄色
状态:粉末状固体 思考:溶解度 钠的另一个含氧化合物——Na2O与水发生化学反应,已经是属于Na2O的化学性质。
Na2O2是否也会表现出类似的性质呢?退 出过氧化钠的物理性质-1过氧化钠的化学性质1、取一支装有Na2O2的试管,打开试管胶塞 缓慢加入少量水,并用拇指堵住试管口。
(观察到有什么现象?)
(用手摸一下试管,有什么感觉?)
2、? 用带火星的木条伸入试管。
(观察到什么现象?)
3、? 向试管中加入几滴无色酚酞。
(观察到什么现象?)
(振荡后又是什么现象?)1、跟水反应 过氧化钠的化学性质反应生成有O2;反应放热;反应生成 NaOH;Na2O2具有漂白性;(2)实验结论:1、试管中发生剧烈反应, 产生大量无色气泡,且此气体能使带火星木条复燃;
2、试管发烫;
3、无色酚酞变红;
4、振荡后红色褪去; 过氧化钠的化学性质(3)实验结论: 2 Na2O2 + 2H2O === 4NaOH + O2↑ 既是氧化剂,又是还原剂。那么Na2O2在这个反应中充当了什么角色呢? 有哪些元素发生了化合价的变化了呢? 只有氧元素;失2e-得2e-1-20 2 与二氧化碳的反应2Na2O2 + 2CO2 == 2Na2CO3 + O2 放热
失2e-得2e-Na2O2既是氧化剂,又是还原剂实验Na2O2的用途 潜水艇漂白剂 →漂白某些物质例.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,可观察到的现象为( )
A 溶液仍为紫色
B 溶液最终变为蓝色
C 最终溶液褪色,无其他现象
D 有气泡产生,溶液最终为无色D[思考] ???1.根据Na2O2性质,想一想Na2O2应如何保存??2.把Na2O2投入到FeSO4溶液中,会观察到哪些现象? 为什么?三 碳酸钠和碳酸氢钠俗 名纯碱或苏打小苏打Na2CO3.10H2O——思考:
通过滴加酚酞的对比实验,能说明一个什么问题?Na2CO3NaHCO3Na2CO3和NaHCO3在水中的溶解性 Na2CO3和NaHCO3在水中的溶解性 __总结仍有固体残留溶液变微红色 白色粉未,加水结块成晶体,放热 白色粉未,加水部分溶解,感受不到热量变化振荡长时间可溶解溶液变红色 加水先变成含结晶水的晶体,溶液的碱性比NaHCO3强
加水部分溶解,溶液的碱性比Na2CO3弱初步结论(1)Na2CO3和NaHCO3的热稳定性 化学性质
热稳定性
现象:1号试管: 澄 清石灰水变浑浊2号试管: 澄 清石灰水不变浑浊② Na2CO3 稳定, 受热不分解① NaHCO3不稳定,受热可分解结论:2NaHCO3===Na2CO3+H2O+CO2总结 : 热稳定性:Na2CO3 > NaHCO3应用: 此性质可鉴别NaHCO3固体和NaHCO3固体(2)与 酸 反 应与酸反应化学性质
碳酸钠和碳酸氢钠都易与酸反应,但是
碳酸氢钠与酸反应比碳酸钠更剧裂为什么?结论:〖讨 论〗
1、如何除去Na2CO3中少量的NaHCO3?
加热用 途制玻璃制皂造纸纺织等 发酵剂灭火剂等Na2CO3NaHCO3制药课堂练习某化学兴趣小组欲制作一泡沫灭火器。现有:盐酸、碳酸钠、碳酸氢钠,请问他们最好选用 和 反应,为什么?
盐酸 碳酸氢钠谢谢大家!
