仁爱版初中化学九年级上册专题3《物质的构成》测试题(解析版)
文档属性
| 名称 | 仁爱版初中化学九年级上册专题3《物质的构成》测试题(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 179.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-30 18:06:07 | ||
图片预览




文档简介
专题3《物质的构成》测试题
一、单选题(每小题只有一个正确答案)
1.用分子观点解释右图漫画中小女孩的话,正确的是( )
(
我又在
被动吸烟!
)
A.分子质量小 B.分子间有间隔 C.分子体积小 D.分子在不断运动
2.油炸和膨化食品中常含有明矾,明矾的主要成分为硫酸铝钾(KAl(SO4)2),其中硫元素的化合价为( )
A.+2 B.+4 C.+6 D.-2
3.加钙牛奶中的“钙”是指( )
A. 元素 B. 原子 C. 分子 D. 单质
4.已知某原子的实际质量为M g,又知C-12原子的质量为N g ,该原子的中子数是P,则该原子的核外电子数为 ( )
A. B. C. D.
5.教材中的图表资料可为我们提供许多信息,下列说法正确的是( )
A.利用元素周期表,可查阅元素符号
B.利用金属活动性顺序表,可判断金属材料的物理性质
C.利用酸、碱、盐的溶解性表,可推知金属与酸、盐能否反应
D.利用相对原子质量表,可直接查出某种元素一个原子的实际质量
6.硒是人体必需的一种微量元素,严重缺硒有可能诱发皮肤疾病。已知硒的原子序34,质子数与中子数之和为79。下列有关硒原子的说法中,不正确的是?(?)
A. 核外电子数为34 B. 中子数为45 C. 质子数为34 D. 核电荷数为79
7.镉属于重金属,会危害人体健康.2013年5月16日,广州市食品药品监管公布的结果显示,抽检大米四成镉超标.这里的镉可理解为( )
A. 镉元素 B. 镉单质 C. 镉离子 D. 镉原子
8.下列物质属于氧化物的是( )
A. 液氧 B. 生石灰 C. 双氧水 D. 火碱
9.已知“塑化剂”的主要成分是邻苯二甲酸二辛酯,化学式为C24H38O4,下列有关邻苯二甲酸二辛酯说法正确的是( )
A.邻苯二甲酸二辛酯是有机物高分子化合物
B.邻苯二甲酸二辛酯是由碳原子、氢原子、氧原子构成
C.邻苯二甲酸二辛酯中碳、氢、氧元素的质量比为12:19:2
D.邻苯二甲酸二辛酯中碳元素的质量分数最大
10.决定元素种类的是( )
A. 核外电子数 B. 中子数 C. 质子数 D. 最外层电子数
11.下列粒子中,不显电性的是( )
A.原子 B.原子核 C.电子 D.离子
12.我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”。铈(Ce)是一种常见的稀土元素,下列关于铈的说法正确的是( )
?
A. 中子数是58 B. 相对原子质量58 C. 铈元素是金属元素 D. 中子数是82
13.葡萄糖中含有的酒石酸(化学式C4H6O6)具有抗氧化性,下列关于酒石酸的说法正确的是( )
A. 它是氧化物 B. 其相对分子质量是150
C. 其中碳元素的质量分数是25% D. 由4个碳元素、6个氧元素和6个氢元素构成
14.HNO3中氮元素的化合价为( )
A.+2 B.+3 C.+4 D.+5
15.下列物质由原子构成的是( )
A. 氯化钠 B. 金刚石 C. 氧气 D. 水蒸气
二、填空题
16.非金属元素的最外层电子数通常_________,在化学反应中容易_________电子; 金属元素的最外层电子数通常_____,在化学反应中较容易_____最外层电 子,成为_____离子.
17.用化学符号填空
(1)两个氮原子
(2)铁离子
(3)小苏打
(4)标出三氧化硫中硫元素的化合价
18.用化学用语填空:
(1)预防骨质疏松应补充的元素是 ;
(2)4个硫酸根离子 ;
(3)香烟烟气中的一种有毒气体 。
19.元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
①第16号元素的化学名称为_______,它在化学反应中容易_______(填“得”或“失”)电子;形成的粒子为_______(填符号)。
②通过上表可推知,19号元素应该属于第______周期,最外层电子数为________,该元素应属于______(填“金属”或“非金属”)元素。
③在同一族中,各元素原子的结构呈现的规律有____________________(任写一点)。
④S、Cl、F三种非金属元素的原子得电子能力逐渐增强,我能根据这三种非金属元素的原子结构推测:非金属元素的原子得电子能力的强弱主要与______、______有关。
⑤居里夫妇在1934年发现了金属镭(Ra),它的原子核内有88个质子, 138个中子,最外层电子数为2。则镭元素的原子序数是________,它与1~18号元素中的_________(填元素符号)元素具有相似的化学性质。
20.为适应不同人群的需要,市场上供应的食盐除普通碘盐外还有无碘竹盐、低钠盐和健康平衡盐等,现有两种品牌的食盐A和B,主要成分的含量见表:(注:两种食盐仅NaCl中含有钠元素:35.1g/100g表示每100g食盐中含钠元素质量为35.1g)
食盐种类 食盐A 食盐B
主要成分的含量 (以钠元素质量计)35.1g/100g (以NaCl质量计)93.0g/100g
(1)加碘盐是通过加入KIO3的方法制成的,KIO3中碘元素的化合价为 。
(2)NaCl中钠元素质量分数以39%计,请比较食盐A、B中NaCl含量高低,其中含量较高的是 (填食盐种类)。
三、推断题
21.A、B、C、D、E、F 是初中化学常见的六种物质,其中A、B、C是单质,且C在常温下是黑色固体,F能使石蕊试液变红色。根据下图中物质的相互转化关系填写下列空白:
(1)A物质是___________,F物质是_______(以上填化学式);
(2)写出生成物质D的化学方程式:___________,反应类型是________。
22.有一包粉末,已知由BaSO4、Cu(NO3)2、BaCl2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行以下实验:
(1)取一定量粉末,加足量水搅拌后过滤,得有色沉淀甲和无色溶液A,原粉末中一定含_____;
(2)向甲中加足量稀盐酸,固体全部消失并得到蓝色溶液,原粉末中一定不含_______;
(3)向A中加入过量BaCl2溶液,出现白色沉淀,过滤,取滤液少量滴加酚酞试液,试液变红。原粉末中一定还不含_______,无色溶液A至少含______种溶质(填数字);
(4)另取步骤③滤液加入过量稀硝酸和硝酸银,出现白色沉淀,则原粉末中_______(选填“一定”或“可能”)含有NaCl。
四、实验题
23.(情景提供)世纪以前,人们一直以为原子是不可分的,直到年,汤姆森发现了带负电的电子后,才引起人们对原子结构模型的探索.
(提出问题)电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
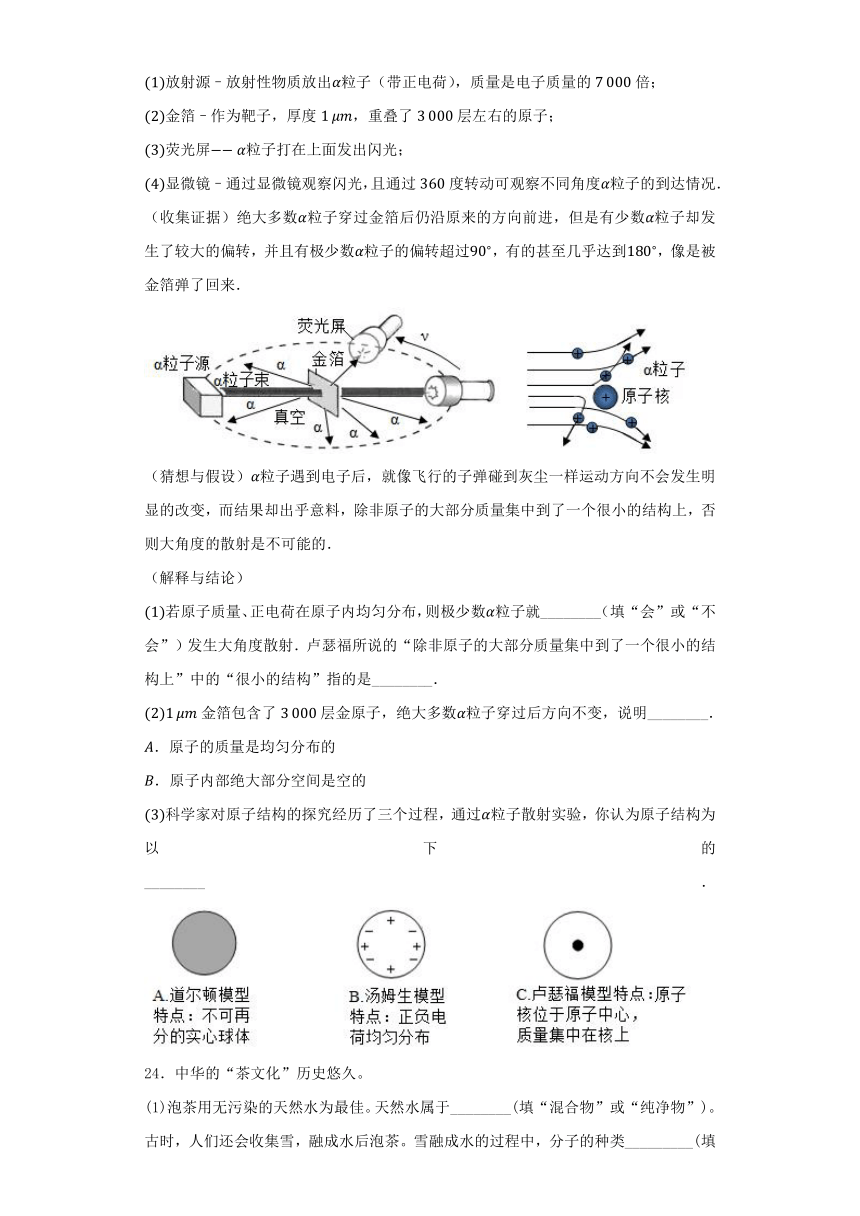
(进行实验)年英国科学家卢瑟福进行了著名的粒子轰击金箔实验.实验做法如图:
放射源–放射性物质放出粒子(带正电荷),质量是电子质量的倍;
金箔–作为靶子,厚度,重叠了层左右的原子;
荧光屏粒子打在上面发出闪光;
显微镜–通过显微镜观察闪光,且通过度转动可观察不同角度粒子的到达情况.
(收集证据)绝大多数粒子穿过金箔后仍沿原来的方向前进,但是有少数粒子却发生了较大的偏转,并且有极少数粒子的偏转超过,有的甚至几乎达到,像是被金箔弹了回来.
(猜想与假设)粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的.
(解释与结论)
若原子质量、正电荷在原子内均匀分布,则极少数粒子就________(填“会”或“不会”)发生大角度散射.卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是________.
金箔包含了层金原子,绝大多数粒子穿过后方向不变,说明________.
.原子的质量是均匀分布的
.原子内部绝大部分空间是空的
科学家对原子结构的探究经历了三个过程,通过粒子散射实验,你认为原子结构为以下的________.
24.中华的“茶文化”历史悠久。
(1)泡茶用无污染的天然水为最佳。天然水属于________(填“混合物”或“纯净物”)。古时,人们还会收集雪,融成水后泡茶。雪融成水的过程中,分子的种类_________(填“改变”或“不变”)。
(2)紫砂壶是珍贵的泡茶壶具。紫砂是指矿石成分中二氧化硅、氧化铝及氧化铁含量较高的陶土。SiO2、Al2O3、Fe2O3都属于________(填“单质”或“氧化物”)。
五、计算题
25.下图是某种品牌的补钙药品的部分说明书。请回答下列问题:
(1) CaCO3的相对分子质量。
(2) 若每天按时服用,可摄入多少克钙元素?
试卷第6页,总6页
参考答案
1.D
【解析】
试题分析:根据微粒的性质分析,由于烟草燃烧后产生的有害物质的分子在不断的运动,最后运动到不吸烟的人的鼻腔中,使不吸烟的人造成被动吸烟。故选D
考点:利用分子与原子的性质分析和解决问题
点评:熟练掌握微观粒子的特征是解题的关键,即粒子的质量和体积都很小,粒子之间有间隙,粒子都是不断运动的,且粒子间的间隔受温度和压强的影响。
2.C
【解析】
试题分析:根据化学式中元素的正负化合价的代数和为零计算,可知,硫酸铝钾中硫元素的化合价为+6价,故答案选择C
考点:化合价的计算
3.A
【解析】
【详解】
加钙牛奶中的“钙”不是指原子、分子、单质,指的是元素,故选A。
4.A
【解析】
【分析】
根据原子的相对原子质量的概念,原子中质子数与电子数的关系,相对原子质量与质子数、中子数的关系进行分析解答。
【详解】
已知某原子的实际质量为Mg,又知C-12原子的质量为Ng,则该原子的相对原子质量=
= ,该原子的中子数是P,相对原子质量=质子数+中子数,则其核内质子数为-P;在原子中:核电荷数=核内质子数=核外电子数,则该原子的核外电子数为-P。故选A。
5.A
【解析】
试题分析:A、根据元素周期表中的一个小格所提供的信息,可知元素符号;故A说法正确;B、金属活动性顺序表是常见的金属在溶液中的活动性大小进行排序得到的表,利用金属活动性顺序表,不能判断金属材料的物理性质,故B说法错误;C、酸、碱、盐的溶解性表,可判断某些复分解反应能否发生,不能推知金属与酸、盐能否反应,故C说法错误;D、根据元素周期表中的一个小格所提供的信息,可知元素的相对原子质量,不能知道元素一个原子的实际质量,故D不符合题意;故选A。
考点:元素周期表的特点及其应用;金属活动性顺序及其应用;酸碱盐的溶解性;相对原子质量的概念及其计算方法
6.D
【解析】
【详解】
A、由题意可知“硒的原子序数为34”,再根据“原子序数=核外电子数”,则可知核外电子数为34,故说法正确;B、由题意可知“硒的原子序数为34,质子数与中子数之和为79”,再根据“原子序数=核内质子数”,则可知中子数为79-34=45,故说法正确;C、由题意可知“硒的原子序数为34”,再根据“原子序数=核内质子数”,则可知质子数为34,故说法正确;D、由题意可知“硒的原子序数为34”,再根据“原子序数=核电荷数”,则可知核电荷数为34,故说法错误。故选D。
【点睛】
了解原子的定义和构成:原子由原子核和核外电子构成,其中原子核由质子和中子构成的;熟记规律“原子序数=核内质子数=核外电子数=核电荷数”。
7.A
【解析】大米中的“镉”等不是以单质、分子、原子、离子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.
8.B
【解析】A、液氧是由一种元素组成的单质,不属于氧化物;B、生石灰是氧化钙的俗称,是由氧元素和钙元素组成的化合物,属于氧化物;C、双氧水是过氧化氢的水溶液,是混合物,不属于氧化物;D、火碱是氢氧化钠的俗称,是由三种元素组成的化合物,不属于氧化物。故选B。
点睛:纯净物由一种物质组成,混合物由两种或两种以上的物质组成;单质是由一种元素组成的纯净物,化合物是由不同种元素组成的纯净物;氧化物是由氧元素和另外一种元素组成的化合物。
9.D
【解析】
试题分析:邻苯二甲酸二辛酯,化学式为C24H38O4,则邻苯二甲酸二辛酯是有机物化合物,但不是高分子;邻苯二甲酸分子二辛酯是由碳原子、氢原子、氧原子构成;邻苯二甲酸二辛酯中碳、氢、氧元素的原子个数比为12:19:2;邻苯二甲酸二辛酯中碳元素的质量分数最大。故选D.
考点:化学式的意义
10.C
【解析】质子数决定元素是种类,核外电子数决定元素的化学性质,故选C。
11.A
【解析】
试题分析:A、在原子中,由于原子核所带的正电荷数和核外电子所带的负电荷数相等,电性相反,所以原子不显电性,故A正确;B、原子核是由中子和质子构成的,质子带正电,中子不带电,所以原子核带正电,故B错;C、每一个电子带一个单位的负电荷,所以核外电子显负电性,故C错;D、离子是带电荷的原子或原子团,故D错.
考点:原子的定义与构成.
12.C
【解析】
A.通过元素周期表元素信息表格,左上角数字表示原子序数,即质子数为58,故A错误;
B.通过元素周期表元素信息表格,下方数字表示相对原子质量,故铈元素的相对原子质量为140.1,故B错误;
C.由元素信息表格,Ce元素名称为铈,属于金属元素,故C正确;
D.通过元素信息表格,铈元素中质子数为58,不知道铈元素原子的质量数,故中子数无法计算,故D错误。
13.B
【解析】A. C4H6O6是含氧元素的化合物,但不是氧化物,错误;B. C4H6O6的相对分子质量是12×4+1×6+16×6=150,正确;C. C4H6O6中碳元素的质量分数是×100%=32%,错误;D. 元素没有数量的意义,C4H6O6由碳元素、氧元素和氢元素组成,错误。故选B。
14.D
【解析】
试题分析:根据元素化合价的一般规律:在化合物中,正负化合价的代数和为0,在HNO3中H的化合价为+1,O的化合价为-2,故氮元素的化合价为+5,故选D
考点:元素化合价的一般规律
15.B
【解析】A、氯化钠是由钠离子和氯离子构成的,错误;B、金刚石属于固态非金属单质,是由碳原子直接构成的,正确;C、氧气是由氧分子构成的,错误;D、水蒸气是由水分子构成的,错误。故选B。
点睛:掌握常见物质的粒子构成是正确解答本题的关键。
16.大于 4、得、少于 4、失、阳.
【解析】
【详解】
原子都有在化学反应中形成最外电子层达8个电子的趋势。由于不同原子最外层电子数不同,因而分别通过得或失电子来实现。非金属元素的最外层电子数较多,一般多余四个,在化学反应中容易从其它原子中获得电子,从而实现稳定结构;金属元素的最外层电子数较少,一般少于3个,在化学反应中较容易失去最外层电子,使倒数第二层变为最外层,形成带正电荷阳离子。
17.(1)2N (2) Fe3+ (3) NaHCO3 (4)
【解析】试题分析:正确使用化学用语,正确标注化合价和离子的带电量,学会正确书写化学式。
考点:化学用语
18.(1) Ca (2) 4SO42- (3) CO
【解析】
试题分析:(1)预防骨质疏松应补充的元素是钙元素符号为Ca;
(2)4个硫酸根离子的表示方法为4SO42-;(3)香烟烟气中的一种有毒气体为一氧化碳,化学式为CO。
考点:化学符号的书写
19. 硫 得 S2- 四 1 金属 在同一族中,各元素的原子最外层电子数相等(答案合理即可) 最外层电子数 电子层数 88 Mg或Be
【解析】根据所学知识和题中信息知,①第16号元素的化学名称为硫,最外层6个电子,它在化学反应中容易得电子;形成的粒子为S2- 。②通过上表可推知,19号元素应该属于第四周期,最外层电子数为1,该元素应属于金属元素。③在同一族中,各元素原子的结构呈现的规律有各元素的原子最外层电子数相等。④S、Cl、F三种非金属元素的原子得电子能力逐渐增强,根据这三种非金属元素的原子结构推测:非金属元素的原子得电子能力的强弱主要与最外层电子数和电子层数有关。⑤金属镭(Ra),它的原子核内有88个质子, 138个中子,最外层电子数为2。则镭元素的原子序数是88,原子序数在数值上等于核内质子数,最外层由2个电子,它与1~18号元素中的Mg或Be元素具有相似的化学性质。
点睛∶元素周期表包含的信息①相对原子质量②元素名称③原子序数④元素符号。最外层电子数<4,易失去电子;最外层电子数>4,易获得电子。同一周期电子层数相同,同一主族最外层电子数相同。
20.(1)+5 (2)食盐B
【解析】
试题分析:
(1)根据在化合物中正负化合价代数和为零,结合碘酸钾的化学式进行解答本题.钾元素显+1价,氧元素显﹣2价,设碘元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(﹣2)×3=0,则x=+5价.故填:+5。
(2)100g食盐A中含有氯化钠的质量为35.1g÷39%=90g,因此食盐A、B中NaCl含量较高的是食盐B,故填:食盐B。
考点:化合价的计算
21. O2 H2CO3 2H2 + O22H2O 化合反应
【解析】C在常温下是黑色固体,F能使石蕊试液变红色,F溶液呈酸性;DE化合反应生成酸,所以F为碳酸;则C为碳,A为氧气,碳和氧气反应生成二氧化碳;B为氢气,D为氧气和氢气反应生成生成的水,水和二氧化碳反应生成水
点睛:推断题的解题方法是找题眼,物质颜色、用途等,然后结合转化关系,利用反应条件和反应类型,进行推断,最后再将推断的结果检查,看是否符合题中物质间的关系。
22. Cu(NO3)2 NaOH BaSO4 BaCl2 3 可能
【解析】(1)取一定量粉末,加足量水搅拌后过滤,得有色沉淀甲和无色溶液A,原粉末中一定含Cu(NO3)2 和NaOH,它们反应生成氢氧化铜蓝色沉淀。(2)向甲中加足量稀盐酸,固体全部消失并得到蓝色溶液,原粉末中一定不含BaSO4,BaSO4不溶于稀盐酸。(3)向A中加入过量BaCl2溶液,出现白色沉淀,过滤,取滤液少量滴加酚酞试液,试液变红。原粉末中一定还不含BaCl2。无色溶液A至少含Na2SO4、NaOH、BaCl2三种溶质。(4)取步骤③滤液加入过量稀硝酸和硝酸银,出现白色沉淀,则原粉末中可能含有NaCl,氯化银是不溶于酸的白色沉淀,也有可能是过量的氯化钡与硝酸银反应生成氯化银。
点睛∶可溶性铜盐是蓝色或蓝绿色。氯化银和硫酸钡均是不溶于盐酸或硝酸的白色沉淀。
23.不会,原子核;;.
【解析】
【详解】
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就不会发生大角度散射.原子中“很小的结构”指的是原子核;
(2)绝大多数α粒子穿过后方向不变,说明原子内部绝大部分空间是空的;
(3)通过α粒子散射实验,得出的是原子有核模型。
24. 混合物 不变 氧化物
【解析】(1) 由两种或两种以上物质组成的物质叫混合物;由一种物质组成的物质叫纯净物;天然水由多种物质组成,属于混合物。雪融成水的过程是物理变化,分子的种类不变,改变的只是分子的间隔和排列方式;(2)二氧化硅、氧化铝及氧化铁都是由两种元素组成,且其中一种是氧元素的化合物,属于氧化物。
25.(1)100;(2)0.6g
【解析】(1)CaCO3的相对分子质量为: ;
(2)根据题意,每次服用2片,每天3次,每片含碳酸钙的质量为0.25g,则每天服用钙片的质量为0.25g×2×3=1.5g,其中含钙元素的质量为。
一、单选题(每小题只有一个正确答案)
1.用分子观点解释右图漫画中小女孩的话,正确的是( )
(
我又在
被动吸烟!
)
A.分子质量小 B.分子间有间隔 C.分子体积小 D.分子在不断运动
2.油炸和膨化食品中常含有明矾,明矾的主要成分为硫酸铝钾(KAl(SO4)2),其中硫元素的化合价为( )
A.+2 B.+4 C.+6 D.-2
3.加钙牛奶中的“钙”是指( )
A. 元素 B. 原子 C. 分子 D. 单质
4.已知某原子的实际质量为M g,又知C-12原子的质量为N g ,该原子的中子数是P,则该原子的核外电子数为 ( )
A. B. C. D.
5.教材中的图表资料可为我们提供许多信息,下列说法正确的是( )
A.利用元素周期表,可查阅元素符号
B.利用金属活动性顺序表,可判断金属材料的物理性质
C.利用酸、碱、盐的溶解性表,可推知金属与酸、盐能否反应
D.利用相对原子质量表,可直接查出某种元素一个原子的实际质量
6.硒是人体必需的一种微量元素,严重缺硒有可能诱发皮肤疾病。已知硒的原子序34,质子数与中子数之和为79。下列有关硒原子的说法中,不正确的是?(?)
A. 核外电子数为34 B. 中子数为45 C. 质子数为34 D. 核电荷数为79
7.镉属于重金属,会危害人体健康.2013年5月16日,广州市食品药品监管公布的结果显示,抽检大米四成镉超标.这里的镉可理解为( )
A. 镉元素 B. 镉单质 C. 镉离子 D. 镉原子
8.下列物质属于氧化物的是( )
A. 液氧 B. 生石灰 C. 双氧水 D. 火碱
9.已知“塑化剂”的主要成分是邻苯二甲酸二辛酯,化学式为C24H38O4,下列有关邻苯二甲酸二辛酯说法正确的是( )
A.邻苯二甲酸二辛酯是有机物高分子化合物
B.邻苯二甲酸二辛酯是由碳原子、氢原子、氧原子构成
C.邻苯二甲酸二辛酯中碳、氢、氧元素的质量比为12:19:2
D.邻苯二甲酸二辛酯中碳元素的质量分数最大
10.决定元素种类的是( )
A. 核外电子数 B. 中子数 C. 质子数 D. 最外层电子数
11.下列粒子中,不显电性的是( )
A.原子 B.原子核 C.电子 D.离子
12.我国著名化学家徐光宪因在稀土元素等研究领域做出杰出贡献,荣获2008年度“国家最高科学技术奖”。铈(Ce)是一种常见的稀土元素,下列关于铈的说法正确的是( )
?
A. 中子数是58 B. 相对原子质量58 C. 铈元素是金属元素 D. 中子数是82
13.葡萄糖中含有的酒石酸(化学式C4H6O6)具有抗氧化性,下列关于酒石酸的说法正确的是( )
A. 它是氧化物 B. 其相对分子质量是150
C. 其中碳元素的质量分数是25% D. 由4个碳元素、6个氧元素和6个氢元素构成
14.HNO3中氮元素的化合价为( )
A.+2 B.+3 C.+4 D.+5
15.下列物质由原子构成的是( )
A. 氯化钠 B. 金刚石 C. 氧气 D. 水蒸气
二、填空题
16.非金属元素的最外层电子数通常_________,在化学反应中容易_________电子; 金属元素的最外层电子数通常_____,在化学反应中较容易_____最外层电 子,成为_____离子.
17.用化学符号填空
(1)两个氮原子
(2)铁离子
(3)小苏打
(4)标出三氧化硫中硫元素的化合价
18.用化学用语填空:
(1)预防骨质疏松应补充的元素是 ;
(2)4个硫酸根离子 ;
(3)香烟烟气中的一种有毒气体 。
19.元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
①第16号元素的化学名称为_______,它在化学反应中容易_______(填“得”或“失”)电子;形成的粒子为_______(填符号)。
②通过上表可推知,19号元素应该属于第______周期,最外层电子数为________,该元素应属于______(填“金属”或“非金属”)元素。
③在同一族中,各元素原子的结构呈现的规律有____________________(任写一点)。
④S、Cl、F三种非金属元素的原子得电子能力逐渐增强,我能根据这三种非金属元素的原子结构推测:非金属元素的原子得电子能力的强弱主要与______、______有关。
⑤居里夫妇在1934年发现了金属镭(Ra),它的原子核内有88个质子, 138个中子,最外层电子数为2。则镭元素的原子序数是________,它与1~18号元素中的_________(填元素符号)元素具有相似的化学性质。
20.为适应不同人群的需要,市场上供应的食盐除普通碘盐外还有无碘竹盐、低钠盐和健康平衡盐等,现有两种品牌的食盐A和B,主要成分的含量见表:(注:两种食盐仅NaCl中含有钠元素:35.1g/100g表示每100g食盐中含钠元素质量为35.1g)
食盐种类 食盐A 食盐B
主要成分的含量 (以钠元素质量计)35.1g/100g (以NaCl质量计)93.0g/100g
(1)加碘盐是通过加入KIO3的方法制成的,KIO3中碘元素的化合价为 。
(2)NaCl中钠元素质量分数以39%计,请比较食盐A、B中NaCl含量高低,其中含量较高的是 (填食盐种类)。
三、推断题
21.A、B、C、D、E、F 是初中化学常见的六种物质,其中A、B、C是单质,且C在常温下是黑色固体,F能使石蕊试液变红色。根据下图中物质的相互转化关系填写下列空白:
(1)A物质是___________,F物质是_______(以上填化学式);
(2)写出生成物质D的化学方程式:___________,反应类型是________。
22.有一包粉末,已知由BaSO4、Cu(NO3)2、BaCl2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行以下实验:
(1)取一定量粉末,加足量水搅拌后过滤,得有色沉淀甲和无色溶液A,原粉末中一定含_____;
(2)向甲中加足量稀盐酸,固体全部消失并得到蓝色溶液,原粉末中一定不含_______;
(3)向A中加入过量BaCl2溶液,出现白色沉淀,过滤,取滤液少量滴加酚酞试液,试液变红。原粉末中一定还不含_______,无色溶液A至少含______种溶质(填数字);
(4)另取步骤③滤液加入过量稀硝酸和硝酸银,出现白色沉淀,则原粉末中_______(选填“一定”或“可能”)含有NaCl。
四、实验题
23.(情景提供)世纪以前,人们一直以为原子是不可分的,直到年,汤姆森发现了带负电的电子后,才引起人们对原子结构模型的探索.
(提出问题)电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
(进行实验)年英国科学家卢瑟福进行了著名的粒子轰击金箔实验.实验做法如图:
放射源–放射性物质放出粒子(带正电荷),质量是电子质量的倍;
金箔–作为靶子,厚度,重叠了层左右的原子;
荧光屏粒子打在上面发出闪光;
显微镜–通过显微镜观察闪光,且通过度转动可观察不同角度粒子的到达情况.
(收集证据)绝大多数粒子穿过金箔后仍沿原来的方向前进,但是有少数粒子却发生了较大的偏转,并且有极少数粒子的偏转超过,有的甚至几乎达到,像是被金箔弹了回来.
(猜想与假设)粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的.
(解释与结论)
若原子质量、正电荷在原子内均匀分布,则极少数粒子就________(填“会”或“不会”)发生大角度散射.卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是________.
金箔包含了层金原子,绝大多数粒子穿过后方向不变,说明________.
.原子的质量是均匀分布的
.原子内部绝大部分空间是空的
科学家对原子结构的探究经历了三个过程,通过粒子散射实验,你认为原子结构为以下的________.
24.中华的“茶文化”历史悠久。
(1)泡茶用无污染的天然水为最佳。天然水属于________(填“混合物”或“纯净物”)。古时,人们还会收集雪,融成水后泡茶。雪融成水的过程中,分子的种类_________(填“改变”或“不变”)。
(2)紫砂壶是珍贵的泡茶壶具。紫砂是指矿石成分中二氧化硅、氧化铝及氧化铁含量较高的陶土。SiO2、Al2O3、Fe2O3都属于________(填“单质”或“氧化物”)。
五、计算题
25.下图是某种品牌的补钙药品的部分说明书。请回答下列问题:
(1) CaCO3的相对分子质量。
(2) 若每天按时服用,可摄入多少克钙元素?
试卷第6页,总6页
参考答案
1.D
【解析】
试题分析:根据微粒的性质分析,由于烟草燃烧后产生的有害物质的分子在不断的运动,最后运动到不吸烟的人的鼻腔中,使不吸烟的人造成被动吸烟。故选D
考点:利用分子与原子的性质分析和解决问题
点评:熟练掌握微观粒子的特征是解题的关键,即粒子的质量和体积都很小,粒子之间有间隙,粒子都是不断运动的,且粒子间的间隔受温度和压强的影响。
2.C
【解析】
试题分析:根据化学式中元素的正负化合价的代数和为零计算,可知,硫酸铝钾中硫元素的化合价为+6价,故答案选择C
考点:化合价的计算
3.A
【解析】
【详解】
加钙牛奶中的“钙”不是指原子、分子、单质,指的是元素,故选A。
4.A
【解析】
【分析】
根据原子的相对原子质量的概念,原子中质子数与电子数的关系,相对原子质量与质子数、中子数的关系进行分析解答。
【详解】
已知某原子的实际质量为Mg,又知C-12原子的质量为Ng,则该原子的相对原子质量=
= ,该原子的中子数是P,相对原子质量=质子数+中子数,则其核内质子数为-P;在原子中:核电荷数=核内质子数=核外电子数,则该原子的核外电子数为-P。故选A。
5.A
【解析】
试题分析:A、根据元素周期表中的一个小格所提供的信息,可知元素符号;故A说法正确;B、金属活动性顺序表是常见的金属在溶液中的活动性大小进行排序得到的表,利用金属活动性顺序表,不能判断金属材料的物理性质,故B说法错误;C、酸、碱、盐的溶解性表,可判断某些复分解反应能否发生,不能推知金属与酸、盐能否反应,故C说法错误;D、根据元素周期表中的一个小格所提供的信息,可知元素的相对原子质量,不能知道元素一个原子的实际质量,故D不符合题意;故选A。
考点:元素周期表的特点及其应用;金属活动性顺序及其应用;酸碱盐的溶解性;相对原子质量的概念及其计算方法
6.D
【解析】
【详解】
A、由题意可知“硒的原子序数为34”,再根据“原子序数=核外电子数”,则可知核外电子数为34,故说法正确;B、由题意可知“硒的原子序数为34,质子数与中子数之和为79”,再根据“原子序数=核内质子数”,则可知中子数为79-34=45,故说法正确;C、由题意可知“硒的原子序数为34”,再根据“原子序数=核内质子数”,则可知质子数为34,故说法正确;D、由题意可知“硒的原子序数为34”,再根据“原子序数=核电荷数”,则可知核电荷数为34,故说法错误。故选D。
【点睛】
了解原子的定义和构成:原子由原子核和核外电子构成,其中原子核由质子和中子构成的;熟记规律“原子序数=核内质子数=核外电子数=核电荷数”。
7.A
【解析】大米中的“镉”等不是以单质、分子、原子、离子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.
8.B
【解析】A、液氧是由一种元素组成的单质,不属于氧化物;B、生石灰是氧化钙的俗称,是由氧元素和钙元素组成的化合物,属于氧化物;C、双氧水是过氧化氢的水溶液,是混合物,不属于氧化物;D、火碱是氢氧化钠的俗称,是由三种元素组成的化合物,不属于氧化物。故选B。
点睛:纯净物由一种物质组成,混合物由两种或两种以上的物质组成;单质是由一种元素组成的纯净物,化合物是由不同种元素组成的纯净物;氧化物是由氧元素和另外一种元素组成的化合物。
9.D
【解析】
试题分析:邻苯二甲酸二辛酯,化学式为C24H38O4,则邻苯二甲酸二辛酯是有机物化合物,但不是高分子;邻苯二甲酸分子二辛酯是由碳原子、氢原子、氧原子构成;邻苯二甲酸二辛酯中碳、氢、氧元素的原子个数比为12:19:2;邻苯二甲酸二辛酯中碳元素的质量分数最大。故选D.
考点:化学式的意义
10.C
【解析】质子数决定元素是种类,核外电子数决定元素的化学性质,故选C。
11.A
【解析】
试题分析:A、在原子中,由于原子核所带的正电荷数和核外电子所带的负电荷数相等,电性相反,所以原子不显电性,故A正确;B、原子核是由中子和质子构成的,质子带正电,中子不带电,所以原子核带正电,故B错;C、每一个电子带一个单位的负电荷,所以核外电子显负电性,故C错;D、离子是带电荷的原子或原子团,故D错.
考点:原子的定义与构成.
12.C
【解析】
A.通过元素周期表元素信息表格,左上角数字表示原子序数,即质子数为58,故A错误;
B.通过元素周期表元素信息表格,下方数字表示相对原子质量,故铈元素的相对原子质量为140.1,故B错误;
C.由元素信息表格,Ce元素名称为铈,属于金属元素,故C正确;
D.通过元素信息表格,铈元素中质子数为58,不知道铈元素原子的质量数,故中子数无法计算,故D错误。
13.B
【解析】A. C4H6O6是含氧元素的化合物,但不是氧化物,错误;B. C4H6O6的相对分子质量是12×4+1×6+16×6=150,正确;C. C4H6O6中碳元素的质量分数是×100%=32%,错误;D. 元素没有数量的意义,C4H6O6由碳元素、氧元素和氢元素组成,错误。故选B。
14.D
【解析】
试题分析:根据元素化合价的一般规律:在化合物中,正负化合价的代数和为0,在HNO3中H的化合价为+1,O的化合价为-2,故氮元素的化合价为+5,故选D
考点:元素化合价的一般规律
15.B
【解析】A、氯化钠是由钠离子和氯离子构成的,错误;B、金刚石属于固态非金属单质,是由碳原子直接构成的,正确;C、氧气是由氧分子构成的,错误;D、水蒸气是由水分子构成的,错误。故选B。
点睛:掌握常见物质的粒子构成是正确解答本题的关键。
16.大于 4、得、少于 4、失、阳.
【解析】
【详解】
原子都有在化学反应中形成最外电子层达8个电子的趋势。由于不同原子最外层电子数不同,因而分别通过得或失电子来实现。非金属元素的最外层电子数较多,一般多余四个,在化学反应中容易从其它原子中获得电子,从而实现稳定结构;金属元素的最外层电子数较少,一般少于3个,在化学反应中较容易失去最外层电子,使倒数第二层变为最外层,形成带正电荷阳离子。
17.(1)2N (2) Fe3+ (3) NaHCO3 (4)
【解析】试题分析:正确使用化学用语,正确标注化合价和离子的带电量,学会正确书写化学式。
考点:化学用语
18.(1) Ca (2) 4SO42- (3) CO
【解析】
试题分析:(1)预防骨质疏松应补充的元素是钙元素符号为Ca;
(2)4个硫酸根离子的表示方法为4SO42-;(3)香烟烟气中的一种有毒气体为一氧化碳,化学式为CO。
考点:化学符号的书写
19. 硫 得 S2- 四 1 金属 在同一族中,各元素的原子最外层电子数相等(答案合理即可) 最外层电子数 电子层数 88 Mg或Be
【解析】根据所学知识和题中信息知,①第16号元素的化学名称为硫,最外层6个电子,它在化学反应中容易得电子;形成的粒子为S2- 。②通过上表可推知,19号元素应该属于第四周期,最外层电子数为1,该元素应属于金属元素。③在同一族中,各元素原子的结构呈现的规律有各元素的原子最外层电子数相等。④S、Cl、F三种非金属元素的原子得电子能力逐渐增强,根据这三种非金属元素的原子结构推测:非金属元素的原子得电子能力的强弱主要与最外层电子数和电子层数有关。⑤金属镭(Ra),它的原子核内有88个质子, 138个中子,最外层电子数为2。则镭元素的原子序数是88,原子序数在数值上等于核内质子数,最外层由2个电子,它与1~18号元素中的Mg或Be元素具有相似的化学性质。
点睛∶元素周期表包含的信息①相对原子质量②元素名称③原子序数④元素符号。最外层电子数<4,易失去电子;最外层电子数>4,易获得电子。同一周期电子层数相同,同一主族最外层电子数相同。
20.(1)+5 (2)食盐B
【解析】
试题分析:
(1)根据在化合物中正负化合价代数和为零,结合碘酸钾的化学式进行解答本题.钾元素显+1价,氧元素显﹣2价,设碘元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(﹣2)×3=0,则x=+5价.故填:+5。
(2)100g食盐A中含有氯化钠的质量为35.1g÷39%=90g,因此食盐A、B中NaCl含量较高的是食盐B,故填:食盐B。
考点:化合价的计算
21. O2 H2CO3 2H2 + O22H2O 化合反应
【解析】C在常温下是黑色固体,F能使石蕊试液变红色,F溶液呈酸性;DE化合反应生成酸,所以F为碳酸;则C为碳,A为氧气,碳和氧气反应生成二氧化碳;B为氢气,D为氧气和氢气反应生成生成的水,水和二氧化碳反应生成水
点睛:推断题的解题方法是找题眼,物质颜色、用途等,然后结合转化关系,利用反应条件和反应类型,进行推断,最后再将推断的结果检查,看是否符合题中物质间的关系。
22. Cu(NO3)2 NaOH BaSO4 BaCl2 3 可能
【解析】(1)取一定量粉末,加足量水搅拌后过滤,得有色沉淀甲和无色溶液A,原粉末中一定含Cu(NO3)2 和NaOH,它们反应生成氢氧化铜蓝色沉淀。(2)向甲中加足量稀盐酸,固体全部消失并得到蓝色溶液,原粉末中一定不含BaSO4,BaSO4不溶于稀盐酸。(3)向A中加入过量BaCl2溶液,出现白色沉淀,过滤,取滤液少量滴加酚酞试液,试液变红。原粉末中一定还不含BaCl2。无色溶液A至少含Na2SO4、NaOH、BaCl2三种溶质。(4)取步骤③滤液加入过量稀硝酸和硝酸银,出现白色沉淀,则原粉末中可能含有NaCl,氯化银是不溶于酸的白色沉淀,也有可能是过量的氯化钡与硝酸银反应生成氯化银。
点睛∶可溶性铜盐是蓝色或蓝绿色。氯化银和硫酸钡均是不溶于盐酸或硝酸的白色沉淀。
23.不会,原子核;;.
【解析】
【详解】
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就不会发生大角度散射.原子中“很小的结构”指的是原子核;
(2)绝大多数α粒子穿过后方向不变,说明原子内部绝大部分空间是空的;
(3)通过α粒子散射实验,得出的是原子有核模型。
24. 混合物 不变 氧化物
【解析】(1) 由两种或两种以上物质组成的物质叫混合物;由一种物质组成的物质叫纯净物;天然水由多种物质组成,属于混合物。雪融成水的过程是物理变化,分子的种类不变,改变的只是分子的间隔和排列方式;(2)二氧化硅、氧化铝及氧化铁都是由两种元素组成,且其中一种是氧元素的化合物,属于氧化物。
25.(1)100;(2)0.6g
【解析】(1)CaCO3的相对分子质量为: ;
(2)根据题意,每次服用2片,每天3次,每片含碳酸钙的质量为0.25g,则每天服用钙片的质量为0.25g×2×3=1.5g,其中含钙元素的质量为。
同课章节目录
- 专题一 走进化学殿堂
- 单元1 化学使生活更美好
- 单元2 如何学习化学
- 专题二 空气和水
- 单元1 多组分的空气
- 单元2 氧气
- 单元3 自然界的水
- 专题三 物质的构成
- 单元1 构成物质的微粒
- 单元2 组成物质的元素
- 单元3 纯净物组成的表示方法
- 专题四 燃料与燃烧
- 单元1 燃烧与灭火
- 单元2 碳及其化合物
- 单元3 化石燃料的利用
- 专题五 化学变化及其表示
- 单元1 化学变化是有条件的
- 单元2 质量守恒定律
- 单元3 化学方程式
- 专题六 物质的溶解
- 单元1 物质的溶解过程
- 单元2 物质的溶解性
- 单元3 物质的溶解性的改变
- 学生实验
- 实验1 实验基本操作
- 实验2 氧气的实验室制取与性质
- 实验3 燃烧的条件
- 实验4 二氧化碳的实验室制取与性质
- 实验5 一定浓度溶液的配置
