氧化还原反应
图片预览







文档简介
课件21张PPT。§2.3 氧化还原反应普通高中课程标准实验教科书 化学(必修1)高中化学(必修)
第二章 第三节—— 氧化还原反应高中化学(必修)
第二章 第三节—— 氧化还原反应请列举几个在初中学过的氧化还原反应方程式思考交流高中化学(必修)
第二章 第三节—— 氧化还原反应一、氧化还原反应的概念:1、从得氧失氧的角度:失氧发生还原反应得氧发生氧化反应结论:有得氧失氧的反应叫做氧化还原反应。得氧——氧化反应失氧——还原反应高中化学(必修)
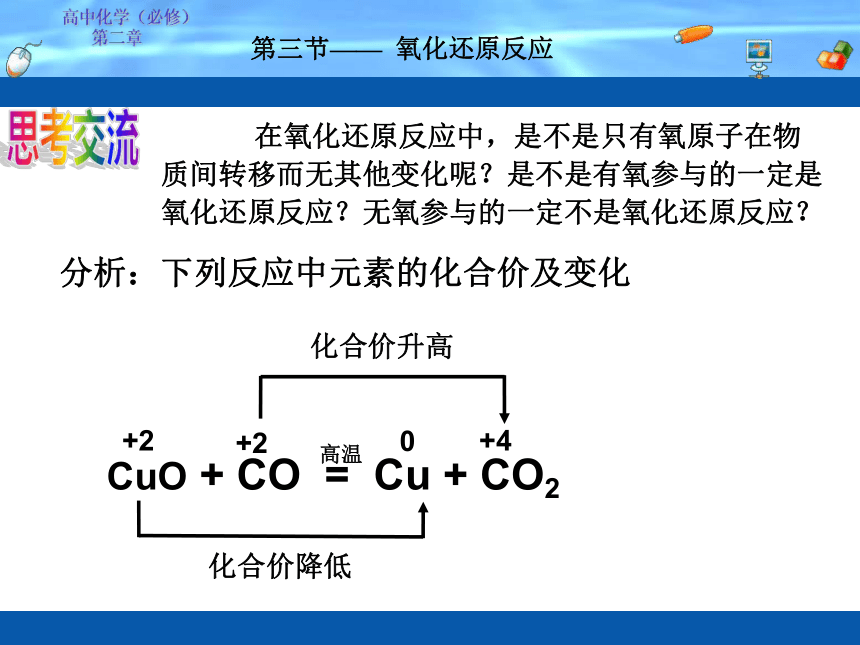
第二章 第三节—— 氧化还原反应思考交流 在氧化还原反应中,是不是只有氧原子在物质间转移而无其他变化呢?是不是有氧参与的一定是氧化还原反应?无氧参与的一定不是氧化还原反应?分析:下列反应中元素的化合价及变化化合价降低+20+4化合价升高+2高中化学(必修)
第二章 第三节—— 氧化还原反应化合价降低+20+4高温化合价升高+22、从化合价变化的角度结论:凡是有元素化合价变化的化学反应叫做氧化还原反应。元素化合价升高 —— 氧化反应元素化合价降低 —— 还原反应CuO + CO = Cu + CO2 失氧被还原高温得氧被氧化CuO + CO = Cu + CO2 被氧化被还原高中化学(必修)
第二章 第三节—— 氧化还原反应 分析下列反应中元素化合价的变化并判断是否是氧化还原反应?练习Fe + CuSO4 = FeSO4 + CuZn + 2HCl = ZnCl2 + H2+20+20+6-2+6-200+2+1-1-1NaOH + HCl = NaCl + H2O-1-1+1+1+1+1+1-2-2是是不是高中化学(必修)
第二章 第三节—— 氧化还原反应+1钾钠氢与银;+2钙镁钡与锌;+3金属元素铝;+2、+3铁元素。Cl:-1、+1、+5、+7S:-2、+4、+6N:-3、+2、+4、+5Mn:+2、+4、+6、+7O:-2、-1一价氯氢钾钠银,二价氧钙钡镁锌;
三铝金,四硅五价磷;
二三铁,二四碳锡铅;
二四六硫都具全,二价铜汞最常见
助记词高中化学(必修)
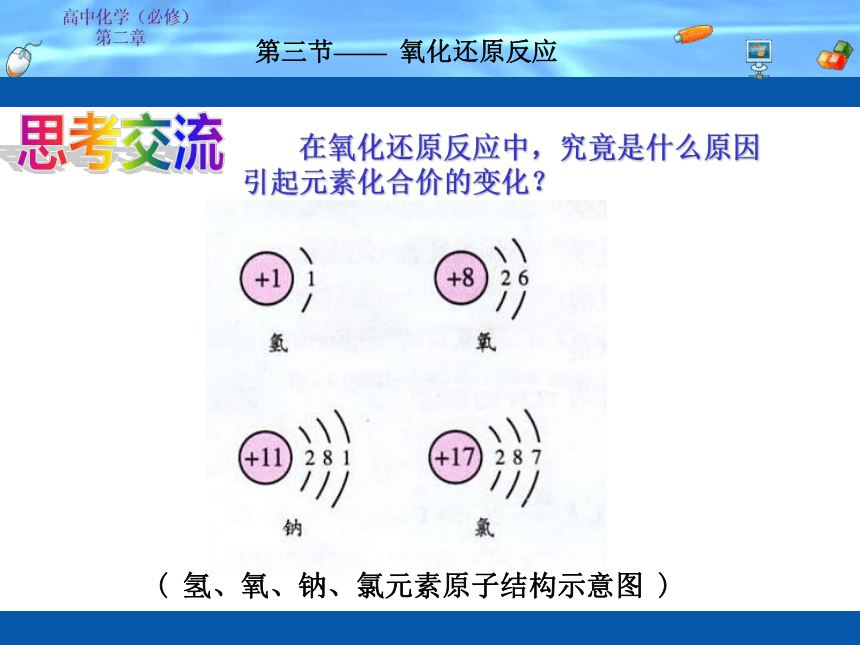
第二章 第三节—— 氧化还原反应思考交流 在氧化还原反应中,究竟是什么原因引起元素化合价的变化?( 氢、氧、钠、氯元素原子结构示意图 )+11+17NaClNa+Cl-+1高中化学(必修)
第二章 第三节—— 氧化还原反应2Na + Cl2 = 2NaCl金属钠能和氯气反应:00-1+1失去电子,化合价升高, 被氧化得到电子,化合价降低,被还原高温发生了电子得失!HCl+1高中化学(必修)
第二章 第三节—— 氧化还原反应氢气能和氯气反应:H2 + Cl2 = 2HCl00-1+1共用电子对偏离,化合价升高,被氧化共用电子对偏向,化合价降低, 被还原点燃共用电子对发生了偏移高中化学(必修)
第二章 第三节—— 氧化还原反应3、从电子转移的角度:结论:凡是有电子转移(得失、偏移)的反应叫氧化还原反应。失去电子的反应得到电子的反应为什么氧化反应与还原反应必须是同时发生?思考交流(共用电子对偏离)(共用电子对偏向)——氧化反应——还原反应高中化学(必修)
第二章 第三节—— 氧化还原反应某元素失去电子(或电子对偏离)化合价升高氧化反应某元素得到电子(或共用电子对偏向)化合价降低还原反应高中化学(必修)
第二章 第三节—— 氧化还原反应 讨论下列反应中电子转移及化合价升降情况并判断哪些是氧化还原反应?练习:+5-1得电子化合价降低,还原反应-20失电子化合价升高,氧化反应+20得电子化合价降低,还原反应失电子化合价升高,氧化反应是是电子无转移,
化合价无变化不是0+200+4+4+1+1-2-2-2-2+1+1高中化学(必修)
第二章 第三节—— 氧化还原反应小结:1、从得氧失氧的角度:得氧——氧化反应失氧——还原反应2、从化合价变化的角度:元素化合价升高 —— 氧化反应元素化合价降低 —— 还原反应3、从电子转移的角度:失去电子的反应——氧化反应得到电子的反应——还原反应(特征)(本质)一、氧化还原反应的概念(共用电子对偏离)(共用电子对偏向)NaCl形成动画示意图高中化学(必修)
第二章 第三节—— 氧化还原反应钠原子与氯原子之间的 电子转移示意图—NaCl静电作用NaCl+高中化学(必修)
第二章 第三节—— 氧化还原反应高中化学(必修)
第二章 第三节—— 氧化还原反应
第二章 第三节—— 氧化还原反应高中化学(必修)
第二章 第三节—— 氧化还原反应请列举几个在初中学过的氧化还原反应方程式思考交流高中化学(必修)
第二章 第三节—— 氧化还原反应一、氧化还原反应的概念:1、从得氧失氧的角度:失氧发生还原反应得氧发生氧化反应结论:有得氧失氧的反应叫做氧化还原反应。得氧——氧化反应失氧——还原反应高中化学(必修)
第二章 第三节—— 氧化还原反应思考交流 在氧化还原反应中,是不是只有氧原子在物质间转移而无其他变化呢?是不是有氧参与的一定是氧化还原反应?无氧参与的一定不是氧化还原反应?分析:下列反应中元素的化合价及变化化合价降低+20+4化合价升高+2高中化学(必修)
第二章 第三节—— 氧化还原反应化合价降低+20+4高温化合价升高+22、从化合价变化的角度结论:凡是有元素化合价变化的化学反应叫做氧化还原反应。元素化合价升高 —— 氧化反应元素化合价降低 —— 还原反应CuO + CO = Cu + CO2 失氧被还原高温得氧被氧化CuO + CO = Cu + CO2 被氧化被还原高中化学(必修)
第二章 第三节—— 氧化还原反应 分析下列反应中元素化合价的变化并判断是否是氧化还原反应?练习Fe + CuSO4 = FeSO4 + CuZn + 2HCl = ZnCl2 + H2+20+20+6-2+6-200+2+1-1-1NaOH + HCl = NaCl + H2O-1-1+1+1+1+1+1-2-2是是不是高中化学(必修)
第二章 第三节—— 氧化还原反应+1钾钠氢与银;+2钙镁钡与锌;+3金属元素铝;+2、+3铁元素。Cl:-1、+1、+5、+7S:-2、+4、+6N:-3、+2、+4、+5Mn:+2、+4、+6、+7O:-2、-1一价氯氢钾钠银,二价氧钙钡镁锌;
三铝金,四硅五价磷;
二三铁,二四碳锡铅;
二四六硫都具全,二价铜汞最常见
助记词高中化学(必修)
第二章 第三节—— 氧化还原反应思考交流 在氧化还原反应中,究竟是什么原因引起元素化合价的变化?( 氢、氧、钠、氯元素原子结构示意图 )+11+17NaClNa+Cl-+1高中化学(必修)
第二章 第三节—— 氧化还原反应2Na + Cl2 = 2NaCl金属钠能和氯气反应:00-1+1失去电子,化合价升高, 被氧化得到电子,化合价降低,被还原高温发生了电子得失!HCl+1高中化学(必修)
第二章 第三节—— 氧化还原反应氢气能和氯气反应:H2 + Cl2 = 2HCl00-1+1共用电子对偏离,化合价升高,被氧化共用电子对偏向,化合价降低, 被还原点燃共用电子对发生了偏移高中化学(必修)
第二章 第三节—— 氧化还原反应3、从电子转移的角度:结论:凡是有电子转移(得失、偏移)的反应叫氧化还原反应。失去电子的反应得到电子的反应为什么氧化反应与还原反应必须是同时发生?思考交流(共用电子对偏离)(共用电子对偏向)——氧化反应——还原反应高中化学(必修)
第二章 第三节—— 氧化还原反应某元素失去电子(或电子对偏离)化合价升高氧化反应某元素得到电子(或共用电子对偏向)化合价降低还原反应高中化学(必修)
第二章 第三节—— 氧化还原反应 讨论下列反应中电子转移及化合价升降情况并判断哪些是氧化还原反应?练习:+5-1得电子化合价降低,还原反应-20失电子化合价升高,氧化反应+20得电子化合价降低,还原反应失电子化合价升高,氧化反应是是电子无转移,
化合价无变化不是0+200+4+4+1+1-2-2-2-2+1+1高中化学(必修)
第二章 第三节—— 氧化还原反应小结:1、从得氧失氧的角度:得氧——氧化反应失氧——还原反应2、从化合价变化的角度:元素化合价升高 —— 氧化反应元素化合价降低 —— 还原反应3、从电子转移的角度:失去电子的反应——氧化反应得到电子的反应——还原反应(特征)(本质)一、氧化还原反应的概念(共用电子对偏离)(共用电子对偏向)NaCl形成动画示意图高中化学(必修)
第二章 第三节—— 氧化还原反应钠原子与氯原子之间的 电子转移示意图—NaCl静电作用NaCl+高中化学(必修)
第二章 第三节—— 氧化还原反应高中化学(必修)
第二章 第三节—— 氧化还原反应
