高中化学苏教版必修二专题1 微观结构与物质的多样性第一单元不同类型的晶体ppt(28张)
文档属性
| 名称 | 高中化学苏教版必修二专题1 微观结构与物质的多样性第一单元不同类型的晶体ppt(28张) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-01-02 20:03:36 | ||
图片预览






文档简介
不同类型的晶体
雪花
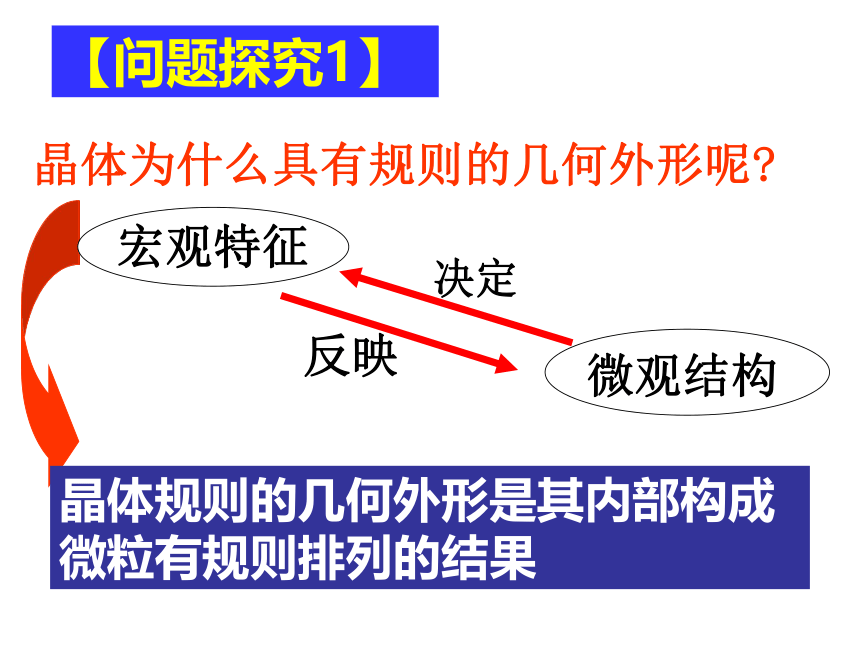
【问题探究1】
晶体为什么具有规则的几何外形呢?
决定
(1)构成物质的基本微粒有哪几种?
(2)微粒之间有哪些类型的相互作用?
原子、分子和离子
离子键、共价键以及分子间作用力
晶体的类型
离子晶体
分子晶体
原子晶体
金属晶体
根据晶体的构成微粒和微粒间作用力不同分为四种类型:
(1)定义:
(4)实例:
NaCl 、
CsCl等
形成离子晶体的物质:
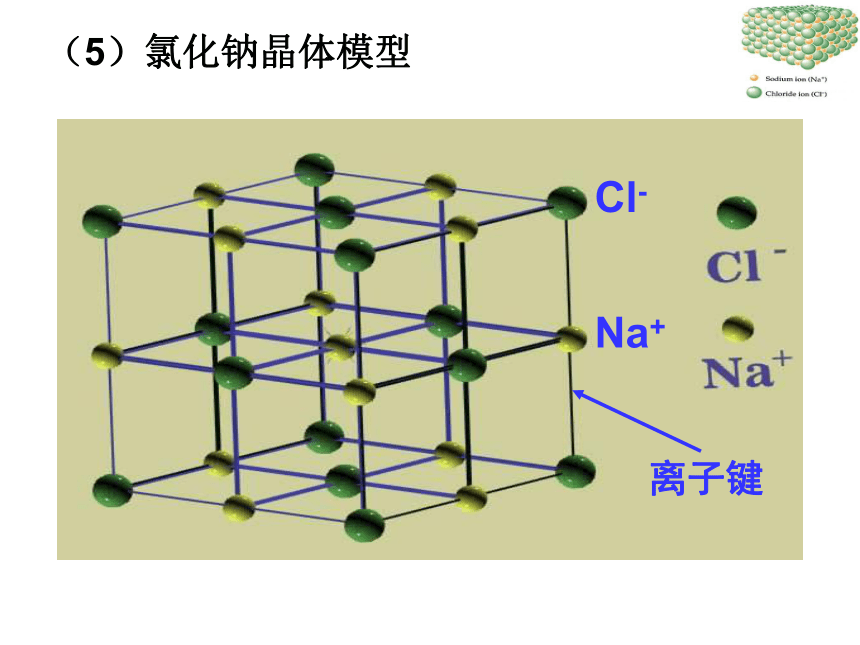
阴、阳离子间通过离子键结合有规则排列而成的
晶体叫做离子晶体。
1、离子晶体
KOH 、CuSO4、NH4Cl 、
CaO等离子化合物
一、不同类型的晶体
(2)构成晶体的微粒:
阴、阳离子
(3)微粒间作用力:
离子键
(5)氯化钠晶体模型
Cl-
Na+
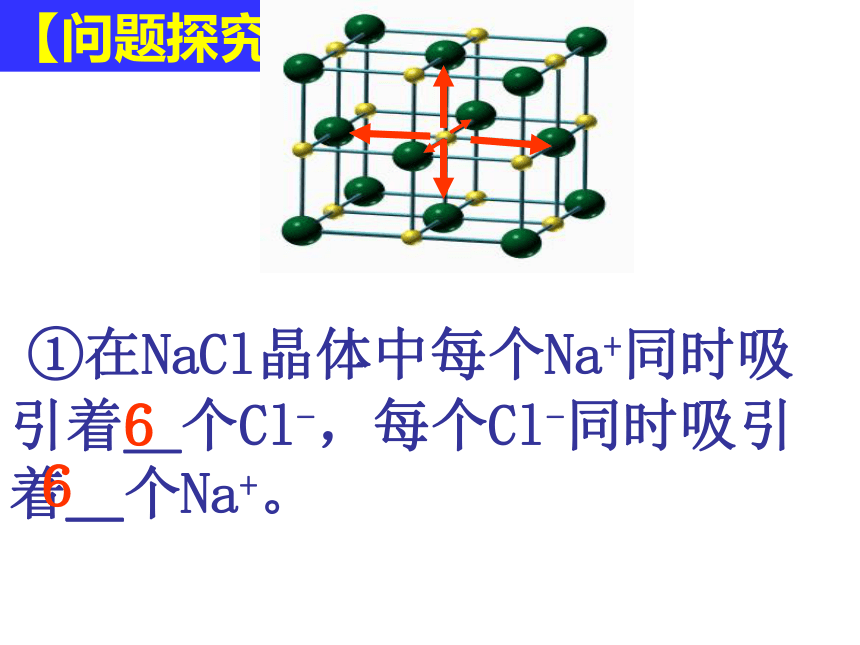
①在NaCl晶体中每个Na+同时吸引着_个Cl-,每个Cl-同时吸引着_个Na+。
【问题探究2】
6
6
【问题探究2】
②在NaCl晶体中是否存在单个的NaCl分子?
不存在
【问题探究3】
影响离子晶体的熔沸点高低、硬度大小因素是什么?
根据“结构决定性质”的观点,请你推测离子晶体可能具有什么样的熔沸点、硬度?
离子键的强弱
离子晶体导电吗?
晶体熔化后导电吗?为什么?
归纳
(6)物理性质
2、分子晶体
(1)定义:
如干冰、冰等共价分子
形成分子晶体的物质:
H2、Cl2、He 、HCl 、H2O、CO2等
分子间通过分子间作用力相结合按一定规则排列
而成的晶体,叫做分子晶体
(4)实例:
(2)构成晶体的微粒:
分子
(3)微粒间作用力:
分子间作用力
大多数共价型的非金属单质和化合物分子
(5)干冰晶体模型
分子间作用力
共价键
【问题探究4】
若发生化学变化时,需克服的又是哪一种作用力?
干冰晶体的熔沸点高低、硬度大小等物理性质取决于哪一种作用力?
归纳
(6)物理性质
讨论:
熔 点
沸 点
干 冰(CO2)
-56.2℃
-78.4℃
SiO2
1723℃
2230℃
CO2和SiO2的一些物理性质有很大差异,为什么?
3、原子晶体
(1)概念:相邻原子间以共价键结合而形成空间网状结构的晶体。
(2)结构特点
★在晶体中,不存在单个分子
★原子通过共价键形成空间网状结构
(3)常见的原子晶体:
金刚石、金刚砂(SiC)、晶体硅、石英(SiO2)
金刚石晶体结构模型
硅晶体结构模型:
金刚石
1.金刚石属于原子晶体,呈空间网状结构。
3.金刚石晶体中碳碳键的键角为
2.金刚石晶体中基
本结构单元:
4.金刚石晶体最小的碳原子环为___元环。
109?28?
共价键
六
正四面体
109°28′
二氧化硅晶体
1.二氧化硅属于原子晶体,呈空间网状结构。
2.二氧化硅晶体中硅氧键的键角为109°28′。
3.在二氧化硅晶体中,
每个Si原子和 个O原子形成共价键,每个O原子和 个Si原子形成共价键。
4、最小的环上有 个硅原子和______个氧原子。
4
2
6
6
原子晶体的熔沸点高低、硬度大小由什么因素决定的?
【问题探究5】
请推测原子晶体可能具有什么样的熔沸点和硬度。
共价键的强弱
归纳
(4)物理性质
石墨的晶体结构
石墨晶体——过渡型晶体或混合型晶体
不同类型的晶体
这些金属制品有哪些相似的物理性质?
大多数金属具有金属光泽、有良好的导热、导电性和延展性
金属晶体
1、下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.SO2和SiO2 B.CO2和H2O
C.NaCl和HCl D.CH4和KCl
B
2、实现下列变化时,需克服相同类型作用力( )
(A)水晶和干冰的熔化 (B)食盐和冰醋酸熔化
(C)液溴和液氨的气化 (D)纯碱和烧碱的熔化
C、D
【小试牛刀】
下列物质所属晶体类型分类正确的是 ( )
3、下列物质所属晶体类型分类正确的是 ( )
D
×
×
×
×
×
×
【小试牛刀】
原子晶体 分子晶体 离子晶体 金属晶体
A 石英 冰 金刚石 硫酸
B 生石灰 固态氨 食盐 汞
C 石膏 氯化钠 碳酸钾 氯化镁
D 金刚石 干冰 烧碱 铁
巩固练习
有下列八种晶体:A.水晶;B.冰醋酸;C.氧化镁;D.碘;E.晶体氩;F.氯化铵;G.铝;H.金刚石。
(1)属于原子晶体的化合物是 ;直接由原子构成的晶是 ;直接由原子构成的分子晶体 。
(2)含有共价键的离子晶体是 ,属于分子晶体的单质是 。
(3)受热熔化后化学键的不发生变化的是 ,受热熔化需克服共价键的是 。
E
A、E、H
F
D、E
BDE
A
A、H
雪花
【问题探究1】
晶体为什么具有规则的几何外形呢?
决定
(1)构成物质的基本微粒有哪几种?
(2)微粒之间有哪些类型的相互作用?
原子、分子和离子
离子键、共价键以及分子间作用力
晶体的类型
离子晶体
分子晶体
原子晶体
金属晶体
根据晶体的构成微粒和微粒间作用力不同分为四种类型:
(1)定义:
(4)实例:
NaCl 、
CsCl等
形成离子晶体的物质:
阴、阳离子间通过离子键结合有规则排列而成的
晶体叫做离子晶体。
1、离子晶体
KOH 、CuSO4、NH4Cl 、
CaO等离子化合物
一、不同类型的晶体
(2)构成晶体的微粒:
阴、阳离子
(3)微粒间作用力:
离子键
(5)氯化钠晶体模型
Cl-
Na+
①在NaCl晶体中每个Na+同时吸引着_个Cl-,每个Cl-同时吸引着_个Na+。
【问题探究2】
6
6
【问题探究2】
②在NaCl晶体中是否存在单个的NaCl分子?
不存在
【问题探究3】
影响离子晶体的熔沸点高低、硬度大小因素是什么?
根据“结构决定性质”的观点,请你推测离子晶体可能具有什么样的熔沸点、硬度?
离子键的强弱
离子晶体导电吗?
晶体熔化后导电吗?为什么?
归纳
(6)物理性质
2、分子晶体
(1)定义:
如干冰、冰等共价分子
形成分子晶体的物质:
H2、Cl2、He 、HCl 、H2O、CO2等
分子间通过分子间作用力相结合按一定规则排列
而成的晶体,叫做分子晶体
(4)实例:
(2)构成晶体的微粒:
分子
(3)微粒间作用力:
分子间作用力
大多数共价型的非金属单质和化合物分子
(5)干冰晶体模型
分子间作用力
共价键
【问题探究4】
若发生化学变化时,需克服的又是哪一种作用力?
干冰晶体的熔沸点高低、硬度大小等物理性质取决于哪一种作用力?
归纳
(6)物理性质
讨论:
熔 点
沸 点
干 冰(CO2)
-56.2℃
-78.4℃
SiO2
1723℃
2230℃
CO2和SiO2的一些物理性质有很大差异,为什么?
3、原子晶体
(1)概念:相邻原子间以共价键结合而形成空间网状结构的晶体。
(2)结构特点
★在晶体中,不存在单个分子
★原子通过共价键形成空间网状结构
(3)常见的原子晶体:
金刚石、金刚砂(SiC)、晶体硅、石英(SiO2)
金刚石晶体结构模型
硅晶体结构模型:
金刚石
1.金刚石属于原子晶体,呈空间网状结构。
3.金刚石晶体中碳碳键的键角为
2.金刚石晶体中基
本结构单元:
4.金刚石晶体最小的碳原子环为___元环。
109?28?
共价键
六
正四面体
109°28′
二氧化硅晶体
1.二氧化硅属于原子晶体,呈空间网状结构。
2.二氧化硅晶体中硅氧键的键角为109°28′。
3.在二氧化硅晶体中,
每个Si原子和 个O原子形成共价键,每个O原子和 个Si原子形成共价键。
4、最小的环上有 个硅原子和______个氧原子。
4
2
6
6
原子晶体的熔沸点高低、硬度大小由什么因素决定的?
【问题探究5】
请推测原子晶体可能具有什么样的熔沸点和硬度。
共价键的强弱
归纳
(4)物理性质
石墨的晶体结构
石墨晶体——过渡型晶体或混合型晶体
不同类型的晶体
这些金属制品有哪些相似的物理性质?
大多数金属具有金属光泽、有良好的导热、导电性和延展性
金属晶体
1、下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.SO2和SiO2 B.CO2和H2O
C.NaCl和HCl D.CH4和KCl
B
2、实现下列变化时,需克服相同类型作用力( )
(A)水晶和干冰的熔化 (B)食盐和冰醋酸熔化
(C)液溴和液氨的气化 (D)纯碱和烧碱的熔化
C、D
【小试牛刀】
下列物质所属晶体类型分类正确的是 ( )
3、下列物质所属晶体类型分类正确的是 ( )
D
×
×
×
×
×
×
【小试牛刀】
原子晶体 分子晶体 离子晶体 金属晶体
A 石英 冰 金刚石 硫酸
B 生石灰 固态氨 食盐 汞
C 石膏 氯化钠 碳酸钾 氯化镁
D 金刚石 干冰 烧碱 铁
巩固练习
有下列八种晶体:A.水晶;B.冰醋酸;C.氧化镁;D.碘;E.晶体氩;F.氯化铵;G.铝;H.金刚石。
(1)属于原子晶体的化合物是 ;直接由原子构成的晶是 ;直接由原子构成的分子晶体 。
(2)含有共价键的离子晶体是 ,属于分子晶体的单质是 。
(3)受热熔化后化学键的不发生变化的是 ,受热熔化需克服共价键的是 。
E
A、E、H
F
D、E
BDE
A
A、H
