高中化学苏教版必修二专题1 微观结构与物质的多样性第三单元从微观结构看物质的多样性 课件ppt(36张)
文档属性
| 名称 | 高中化学苏教版必修二专题1 微观结构与物质的多样性第三单元从微观结构看物质的多样性 课件ppt(36张) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-01-02 00:00:00 | ||
图片预览










文档简介
物质的多样性
同位素
同素异形现象
同分异构现象
不同类型的晶体
第三单元 从微观结构看物质的多样性
1 ﹒知道晶体的分类,识别常见的离子晶体、分子晶体、原子晶体等;
2 ﹒了解常见晶体的结构模型及其性质的一般特点;
3﹒理解晶体类型与性质的关系;
4 ﹒认识现象中蕴含本质,本质通过现象表现的辩证唯物主义观点。
具有规则几何外形的固体叫晶体
整齐的队列
规则的排列
一、晶体
一、晶体
1.自然界固态物质的分类: 和 .
2.晶体的定义:具有 的固体叫晶体如: 、 、 、 等
3.晶体有规则几何外形的原因:
晶态
非晶态
规则的几何外形
金刚石
水晶
氯化钠
雪花
晶体规则几何外形是内部构成
微粒 的结果。
4.构成晶体的微粒可以是 、 、 。
有规则排列
离子
分子
原子
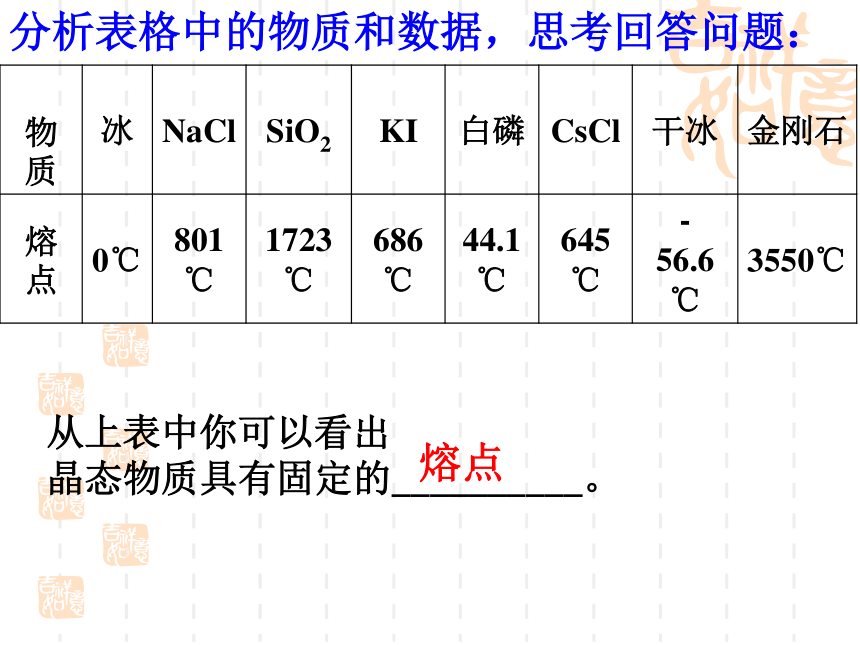
分析表格中的物质和数据,思考回答问题:
从上表中你可以看出
晶态物质具有固定的__________。
熔点
物质 冰 NaCl SiO2 KI 白磷 CsCl 干冰 金刚石
熔点 0℃ 801℃ 1723℃ 686℃ 44.1℃ 645℃ - 56.6℃ 3550℃
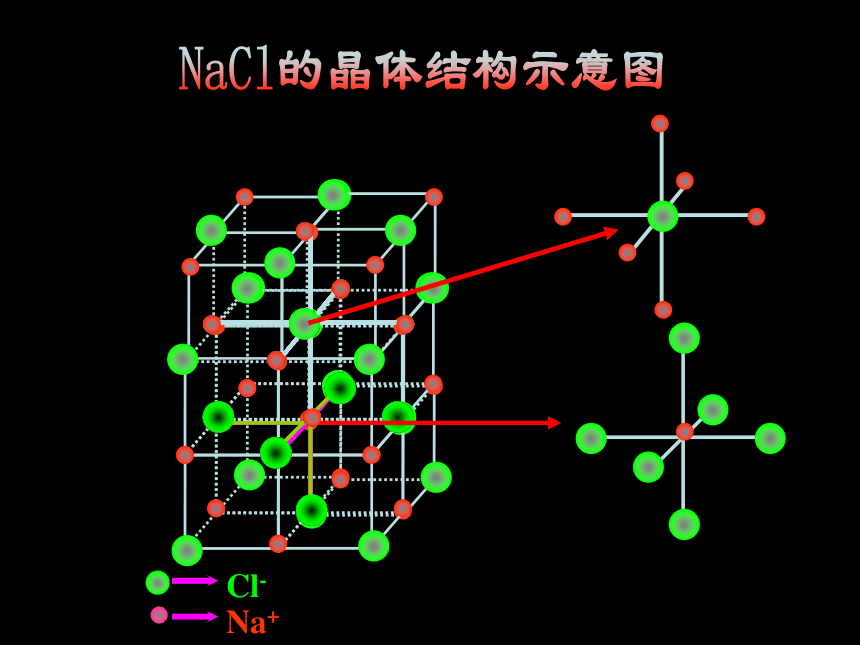
[思考1]:NaCl晶体中存在哪些微粒?如何结合成晶体的?
二、晶体的类型
[小结]:在NaCl晶体中, (填存在或不存在)分子,存在许多 离子和 离子,以 键相结合,阴阳离子的个数比为 ,因此NaCl表示的含义是 。
不存在
Na+
Cl-
离子
1:1
离子化合物中的阴、阳离子按一定的方式有规则地排列而形成的晶体。
1、离子晶体
晶体中钠离子与氯离子个数比为1:1
(1)定义:
每个Na+吸引6个Cl-每个Cl-吸引6个Na+
(2) 说明:①构成微粒: 。
②形成晶体作用力: 。
阴阳离子
离子键
(3)离子晶体的特点:
①无单个分子存在;NaCl不表示分子式。
②熔沸点较高,硬度较大。
③水溶液(易溶)或者熔融状态下能导电。
(4)物质范围或实例
强碱、部分金属氧化物、部分盐类。
离子化合物形成的晶体
[思考2]:干冰晶体中存在哪些微粒?如何结合成晶体的?
2、分子晶体
分子间通过分子间作用力按一定规则排列而成的晶体。
分子间作用力
共价键
(1)定义:
(2)说明
①构成微粒:___________
②形成晶体作用力:_____________
分子
分子间作用力
(3)分子晶体的特点:
①熔沸点较低,硬度较小。
②分子晶体以及它熔化成的液体不导电,分子晶体溶于水时,水溶液有的能导电,如HCl溶于水能导电,而乙醇(C2H5OH)溶于水不能导电。
(4)物质范围或实例
大多数共价化合物(酸、部分非金属氧化物、有机物)和大多数非金属单质
讨论:
CO2和SiO2的一些物理性质如下表所示,通过比较判断SiO2晶体是否属于分子晶体.
熔 点
沸 点
干 冰(CO2)
-56.2℃
-78.4℃
SiO2
1723℃
2230℃
[思考3]:金刚石晶体中存在哪些微粒?如何结合成晶体的?
3、原子晶体
相邻原子通过共价键结合而形成空间网状结构的晶体。
(1).定义:
109?28?
共价键
返回
晶
体
硅
180?
109?28?
Si
o
共价键
返回
(2)说明
①构成微粒:___________
②形成晶体作用力:_________________
(3)原子晶体的特点:
①无单个分子存在;如SiO2不表示分子式。
②原子晶体一般具有很高的熔点和沸点,并难溶于水。
③原子晶体的硬度大,一般不能导电。
原子
共价键
(4)物质范围或实例
金刚石、晶体硅、石英、SiC 、BN 、Si3N4 、 Al2O3(α型)
不同的金属晶体
金属晶体
金属阳离子
自由电子
金属的延展性
金属阳离子
自由电子
4、金属晶体
金属离子与自由电子通过金属键形成的单质晶体
(2)说明
①构成微粒:___________
②形成晶体作用力:_________________
(3)金属晶体的特点:
①具有良好的导电、导热性。
②一般具有延展性
金属离子与自由电子
金属键
(1)定义:
(4)物质范围或实例
金属、合金
阴、阳离子
离子键
分子
分子间作用力
原子
共价键
金属阳离子和自由电子
金属键
较高
较低
很高
差别较大
较硬
较小
硬度大
差别较大
固态不导电
熔融态导电
不导电
不导电
导电
差
差
差
有延展性
离子晶体 分子晶体 原子晶体 金属晶体
粒子种类
粒子间的相互作用
物理性质 熔沸点
硬度
导电性
延展性
石墨晶体——过渡型晶体或混合型晶体
石墨晶体属于过渡型(混合型)晶体,每一个C原子与3个C原子以共价键相连,但分子间又存在分子间作用力。
三、晶体类型的判断
1 、从性质上判断
熔沸点和硬度;(高:原子晶体;中:离子体;低:分子晶体)
2 、熔融状态的导电性
(导电化合物就是离子晶体)
3 、从组成上判断:
金属单质:金属晶体
化合物中有无金属阳离子或者铵根离子(有:离子晶体)非金属单质和共价化合物除原子晶体则是分子晶体。
3、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
2、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 KOH、 金刚石、
醋酸、 尿素、 水晶、 Na2O
C
4、下列各组物质的晶体中,化学键类型
相同、晶体类型也相同的是
A、SO2和SiO2 B、CO2和H2O
C、NaCl和HCl D、CCl4和KCl
B
5、下列四种晶体①金刚石 ②氯化钠 ③干冰 ④钠,它们的熔点由低到高的顺序排列正确的是 。
6、下列各组物质中,按熔点由低到高排列正确的是( )
A.O2 I2 Hg
B.CO2 KCl SiO2
C.Na K Rb
D.SiC NaCl SO2
③ ④ ② ①
B
1、下表给出几种氯化物的熔沸点:
对此有下列说法,错误的是:
D
返回
NaCl MgCl2 CaCl2 SiCl4
熔点(℃) 801 712 782 -68
沸点(℃) 1465 1418 1600 57
同位素
同素异形现象
同分异构现象
不同类型的晶体
第三单元 从微观结构看物质的多样性
1 ﹒知道晶体的分类,识别常见的离子晶体、分子晶体、原子晶体等;
2 ﹒了解常见晶体的结构模型及其性质的一般特点;
3﹒理解晶体类型与性质的关系;
4 ﹒认识现象中蕴含本质,本质通过现象表现的辩证唯物主义观点。
具有规则几何外形的固体叫晶体
整齐的队列
规则的排列
一、晶体
一、晶体
1.自然界固态物质的分类: 和 .
2.晶体的定义:具有 的固体叫晶体如: 、 、 、 等
3.晶体有规则几何外形的原因:
晶态
非晶态
规则的几何外形
金刚石
水晶
氯化钠
雪花
晶体规则几何外形是内部构成
微粒 的结果。
4.构成晶体的微粒可以是 、 、 。
有规则排列
离子
分子
原子
分析表格中的物质和数据,思考回答问题:
从上表中你可以看出
晶态物质具有固定的__________。
熔点
物质 冰 NaCl SiO2 KI 白磷 CsCl 干冰 金刚石
熔点 0℃ 801℃ 1723℃ 686℃ 44.1℃ 645℃ - 56.6℃ 3550℃
[思考1]:NaCl晶体中存在哪些微粒?如何结合成晶体的?
二、晶体的类型
[小结]:在NaCl晶体中, (填存在或不存在)分子,存在许多 离子和 离子,以 键相结合,阴阳离子的个数比为 ,因此NaCl表示的含义是 。
不存在
Na+
Cl-
离子
1:1
离子化合物中的阴、阳离子按一定的方式有规则地排列而形成的晶体。
1、离子晶体
晶体中钠离子与氯离子个数比为1:1
(1)定义:
每个Na+吸引6个Cl-每个Cl-吸引6个Na+
(2) 说明:①构成微粒: 。
②形成晶体作用力: 。
阴阳离子
离子键
(3)离子晶体的特点:
①无单个分子存在;NaCl不表示分子式。
②熔沸点较高,硬度较大。
③水溶液(易溶)或者熔融状态下能导电。
(4)物质范围或实例
强碱、部分金属氧化物、部分盐类。
离子化合物形成的晶体
[思考2]:干冰晶体中存在哪些微粒?如何结合成晶体的?
2、分子晶体
分子间通过分子间作用力按一定规则排列而成的晶体。
分子间作用力
共价键
(1)定义:
(2)说明
①构成微粒:___________
②形成晶体作用力:_____________
分子
分子间作用力
(3)分子晶体的特点:
①熔沸点较低,硬度较小。
②分子晶体以及它熔化成的液体不导电,分子晶体溶于水时,水溶液有的能导电,如HCl溶于水能导电,而乙醇(C2H5OH)溶于水不能导电。
(4)物质范围或实例
大多数共价化合物(酸、部分非金属氧化物、有机物)和大多数非金属单质
讨论:
CO2和SiO2的一些物理性质如下表所示,通过比较判断SiO2晶体是否属于分子晶体.
熔 点
沸 点
干 冰(CO2)
-56.2℃
-78.4℃
SiO2
1723℃
2230℃
[思考3]:金刚石晶体中存在哪些微粒?如何结合成晶体的?
3、原子晶体
相邻原子通过共价键结合而形成空间网状结构的晶体。
(1).定义:
109?28?
共价键
返回
晶
体
硅
180?
109?28?
Si
o
共价键
返回
(2)说明
①构成微粒:___________
②形成晶体作用力:_________________
(3)原子晶体的特点:
①无单个分子存在;如SiO2不表示分子式。
②原子晶体一般具有很高的熔点和沸点,并难溶于水。
③原子晶体的硬度大,一般不能导电。
原子
共价键
(4)物质范围或实例
金刚石、晶体硅、石英、SiC 、BN 、Si3N4 、 Al2O3(α型)
不同的金属晶体
金属晶体
金属阳离子
自由电子
金属的延展性
金属阳离子
自由电子
4、金属晶体
金属离子与自由电子通过金属键形成的单质晶体
(2)说明
①构成微粒:___________
②形成晶体作用力:_________________
(3)金属晶体的特点:
①具有良好的导电、导热性。
②一般具有延展性
金属离子与自由电子
金属键
(1)定义:
(4)物质范围或实例
金属、合金
阴、阳离子
离子键
分子
分子间作用力
原子
共价键
金属阳离子和自由电子
金属键
较高
较低
很高
差别较大
较硬
较小
硬度大
差别较大
固态不导电
熔融态导电
不导电
不导电
导电
差
差
差
有延展性
离子晶体 分子晶体 原子晶体 金属晶体
粒子种类
粒子间的相互作用
物理性质 熔沸点
硬度
导电性
延展性
石墨晶体——过渡型晶体或混合型晶体
石墨晶体属于过渡型(混合型)晶体,每一个C原子与3个C原子以共价键相连,但分子间又存在分子间作用力。
三、晶体类型的判断
1 、从性质上判断
熔沸点和硬度;(高:原子晶体;中:离子体;低:分子晶体)
2 、熔融状态的导电性
(导电化合物就是离子晶体)
3 、从组成上判断:
金属单质:金属晶体
化合物中有无金属阳离子或者铵根离子(有:离子晶体)非金属单质和共价化合物除原子晶体则是分子晶体。
3、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
2、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 KOH、 金刚石、
醋酸、 尿素、 水晶、 Na2O
C
4、下列各组物质的晶体中,化学键类型
相同、晶体类型也相同的是
A、SO2和SiO2 B、CO2和H2O
C、NaCl和HCl D、CCl4和KCl
B
5、下列四种晶体①金刚石 ②氯化钠 ③干冰 ④钠,它们的熔点由低到高的顺序排列正确的是 。
6、下列各组物质中,按熔点由低到高排列正确的是( )
A.O2 I2 Hg
B.CO2 KCl SiO2
C.Na K Rb
D.SiC NaCl SO2
③ ④ ② ①
B
1、下表给出几种氯化物的熔沸点:
对此有下列说法,错误的是:
D
返回
NaCl MgCl2 CaCl2 SiCl4
熔点(℃) 801 712 782 -68
沸点(℃) 1465 1418 1600 57
