原电池
图片预览







文档简介
课件21张PPT。人教版高中化学选修4第四章第一节 原 电 池
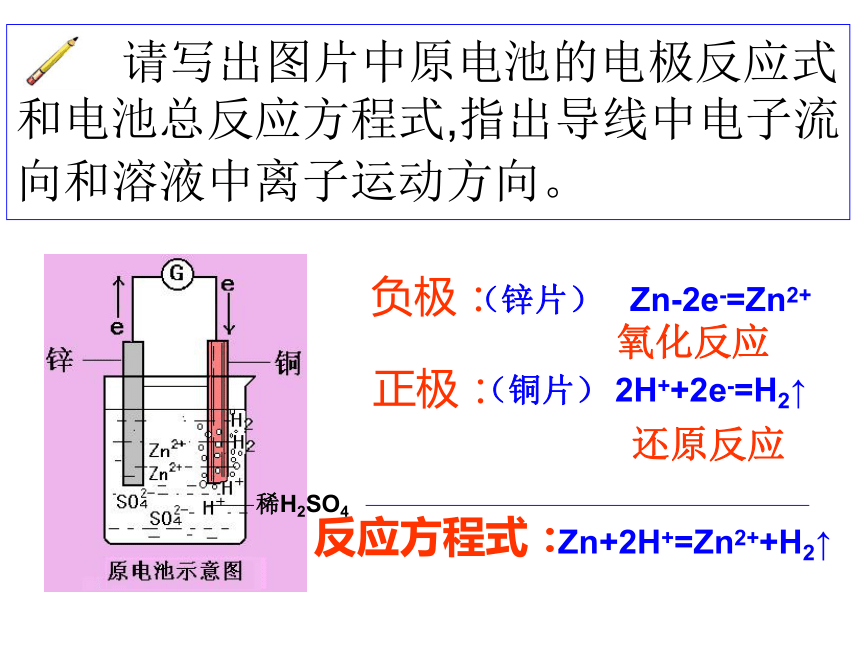
Primary battery授课人:郭佰春弓棚高级中学2.原电池的构成条件①两个活性不同的电极②电解质溶液③形成闭合回路1.原电池反应的本质:自发的氧化还原反应 请写出图片中原电池的电极反应式和电池总反应方程式,指出导线中电子流向和溶液中离子运动方向。 负极:(锌片) Zn-2e-=Zn2+
氧化反应正极:(铜片) 2H++2e-=H2↑稀H2SO4还原反应根据Zn+CuSO4=ZnSO4+Cu这个氧化还原反应设计原电池正极(铜电极):Cu2+ + 2e- = Cu
负极(锌电极):Zn-2e- = Zn2+
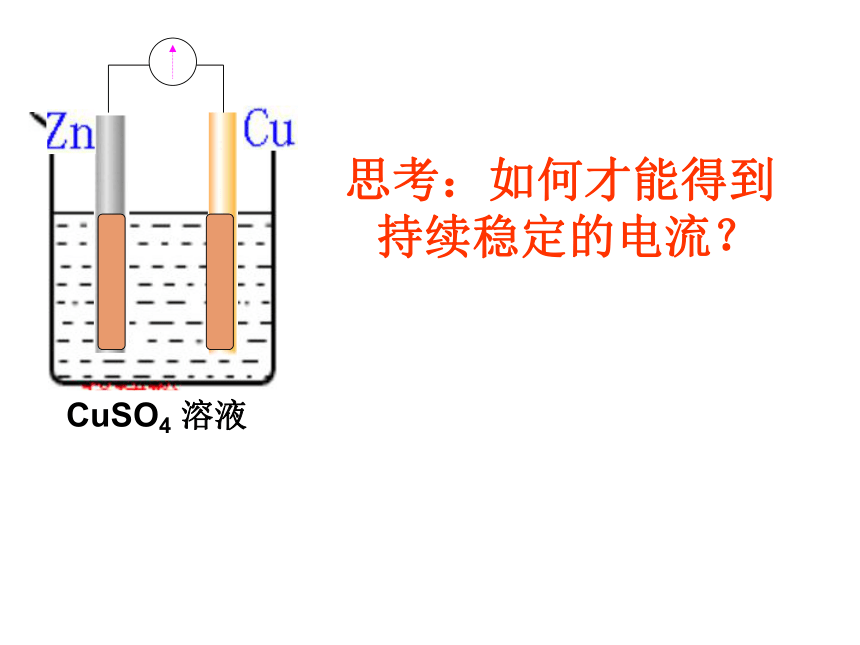
电池总反应:Zn+ Cu2+ = Cu+ Zn2+电流表指针发生偏转,但不稳定。
两个电极上都有红色的铜生成
电池为我们的生活带来的方便!!!手机电池MP3电子表笔记本电池计算器思考:如何才能得到持续稳定的电流?分析:
由于锌片与硫酸铜溶液直接接触,铜在锌片表面析出,锌表面也构成了原电池,进一步加速铜在锌表面析出,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,不再构成原电池,也就没有电流产生。在原有实验基础上进行改进,设计成一个能产生持续稳定电流的原电池。
实验探究根据Zn+2AgNO3=Zn(NO3)2+2Ag设计能产生持续稳定电流的原电池装置原电池供电能力:取决于组成原电池的反应物的氧化还原能力;氧化、还原能力越强,其放电能力越强。本节小结原电池以氧化还原反应为依据,使氧化反应和还原反应分别在两个半电池内进行,再以适当的方式(如盐桥)连接起来。1.根据下表内各组中所提供的条件,你认为放电能力最强的是 ( )
(溶液浓度均相同)C 练习2.下列说法正确的是 ( )
A.原电池是把电能转变为化学能的装置
B.原电池中电子流出的一极是正极,发生氧化反应
C.原电池两极均发生氧化还原反应
D.原电池内部的阳离子向正极移动D3.如下图所示的装置中,能够形成原电池,产生电流的是 ( )B4.请利用:Cu+2Ag+=Cu2++2Ag的反应原理,设计一个能持续产生电流的原电池装置,并写出两极反应式。?KNO3课外作业:课本第72页 第6题
谢谢大家再见!
Primary battery授课人:郭佰春弓棚高级中学2.原电池的构成条件①两个活性不同的电极②电解质溶液③形成闭合回路1.原电池反应的本质:自发的氧化还原反应 请写出图片中原电池的电极反应式和电池总反应方程式,指出导线中电子流向和溶液中离子运动方向。 负极:(锌片) Zn-2e-=Zn2+
氧化反应正极:(铜片) 2H++2e-=H2↑稀H2SO4还原反应根据Zn+CuSO4=ZnSO4+Cu这个氧化还原反应设计原电池正极(铜电极):Cu2+ + 2e- = Cu
负极(锌电极):Zn-2e- = Zn2+
电池总反应:Zn+ Cu2+ = Cu+ Zn2+电流表指针发生偏转,但不稳定。
两个电极上都有红色的铜生成
电池为我们的生活带来的方便!!!手机电池MP3电子表笔记本电池计算器思考:如何才能得到持续稳定的电流?分析:
由于锌片与硫酸铜溶液直接接触,铜在锌片表面析出,锌表面也构成了原电池,进一步加速铜在锌表面析出,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,不再构成原电池,也就没有电流产生。在原有实验基础上进行改进,设计成一个能产生持续稳定电流的原电池。
实验探究根据Zn+2AgNO3=Zn(NO3)2+2Ag设计能产生持续稳定电流的原电池装置原电池供电能力:取决于组成原电池的反应物的氧化还原能力;氧化、还原能力越强,其放电能力越强。本节小结原电池以氧化还原反应为依据,使氧化反应和还原反应分别在两个半电池内进行,再以适当的方式(如盐桥)连接起来。1.根据下表内各组中所提供的条件,你认为放电能力最强的是 ( )
(溶液浓度均相同)C 练习2.下列说法正确的是 ( )
A.原电池是把电能转变为化学能的装置
B.原电池中电子流出的一极是正极,发生氧化反应
C.原电池两极均发生氧化还原反应
D.原电池内部的阳离子向正极移动D3.如下图所示的装置中,能够形成原电池,产生电流的是 ( )B4.请利用:Cu+2Ag+=Cu2++2Ag的反应原理,设计一个能持续产生电流的原电池装置,并写出两极反应式。?KNO3课外作业:课本第72页 第6题
谢谢大家再见!
