人教新课标必修1习题精解( 离子反应)
文档属性
| 名称 | 人教新课标必修1习题精解( 离子反应) |  | |
| 格式 | zip | ||
| 文件大小 | 46.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-12-14 16:50:00 | ||
图片预览


文档简介
习题精解
夯基达标
一、选择题
1.下列物质中能导电的是_______,属于电解质的是_______,属于非电解质的是_______。
①汞 ②氯水 ③氯化钠晶体 ④盐酸 ⑤氧化钠固体 ⑥BaSO4 ⑦液氯 ⑧金刚石 ⑨干冰
思路解析:本题是考查导电性、电解质和非电解质的判断。能导电的物质不一定是电解质,电解质只有电离出自由移动的阴、阳离子才能导电。电解质和非电解质均是化合物。
答案:①②④ ③⑤⑥ ⑨
2.下列电离方程式正确的是( )
A.CH3COOHCH3COO-+H+
B.CaCO3Ca2++CO
C.NaCl====Na+Cl-
D.HClH++Cl-
思路解析:电离方程式中只有强电解质才完全电离,用“====”,弱电解质在水中部分电离用“”。CH3COOH是弱电解质,CaCO3、NaCl、HCl是强电解质。
答案:AC
3.下列物质都能导电,其中属于电解质的是( )
A.NaCl溶液
B.铁
C.稀硫酸
D.熔融的NaOH
思路解析:电解质是溶于水或熔融状态下能导电的化合物。
答案:D
4.在某无色透明的酸性溶液中,能共存的离子组是 …( )
A.Na+、K+、SO、HCO
B.Cu2+、K+、SO、NO
C.Na+、K+、Cl-、NO
D.Fe3+、K+、SO、Cl-
思路解析:由于氢离子能够与碳酸氢根离子反应,所以A项不满足,B中铜离子使溶液呈蓝色,D中铁离子使溶液呈黄色。
答案:C
5.下列各电离方程式书写正确的是( )
A.C2H5OH====C2H+OH-
B.H2SO4====H+SO
C.MgCl2====
D.Al(NO3)3====Al3++3NO
思路解析:A.酒精的水溶液不能导电,酒精在水中不电离,没有电离方程式;B.每个硫酸分子电离生成两个氢离子和一个硫酸根离子,个数应写在化学计量数位置上,不能用H表示,硫酸电离方程式为:H2SO4====2H++SO;C?镁离子符号Mg2+,不能用价标Mg+2表示,同理不能用Cl-1表示Cl-,氯化镁电离方程式为:MgCl2=====Mg2++2Cl-。
答案:D
6.下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液 CH3COOH+NH3====CH3COONH4
B.澄清的石灰水跟盐酸反应 H++OH-====H2O
C.碳酸钡溶于醋酸 BaCO3+2H+====Ba2++H2O+CO2↑
D.金属钠跟水反应 2Na+2H2O====2Na++2OH-+H2↑
思路解析:因醋酸铵为强电解质,故在溶液中应完全电离;又醋酸为弱酸,所以应该用化学式表示。
答案:BD
7.能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与盐酸的反应 H++OH-====H2O
B.澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+====Ca2++2H2O
C.铜片插入硝酸银溶液中 Cu+Ag+====Cu2++Ag
D.碳酸钙溶于稀盐酸中 CaCO3+2H+====Ca2++H2O+CO2↑
思路解析:由于澄清石灰水中氢氧化钙完全电离,所以应用离子表示;C项则不满足电荷守恒。
答案:AD
8.在pH=1的溶液中,可以大量共存的离子是( )
A.Na+ K+ HCO Cl-
B.NH Mg2+ SO Cl-
C.K+ Na+ SO CO
D.K+ Na+ SO NO
思路解析:由于HCO、CO和SO与氢离子能够反应,所以不能大量共存。
答案:B
二、填空题
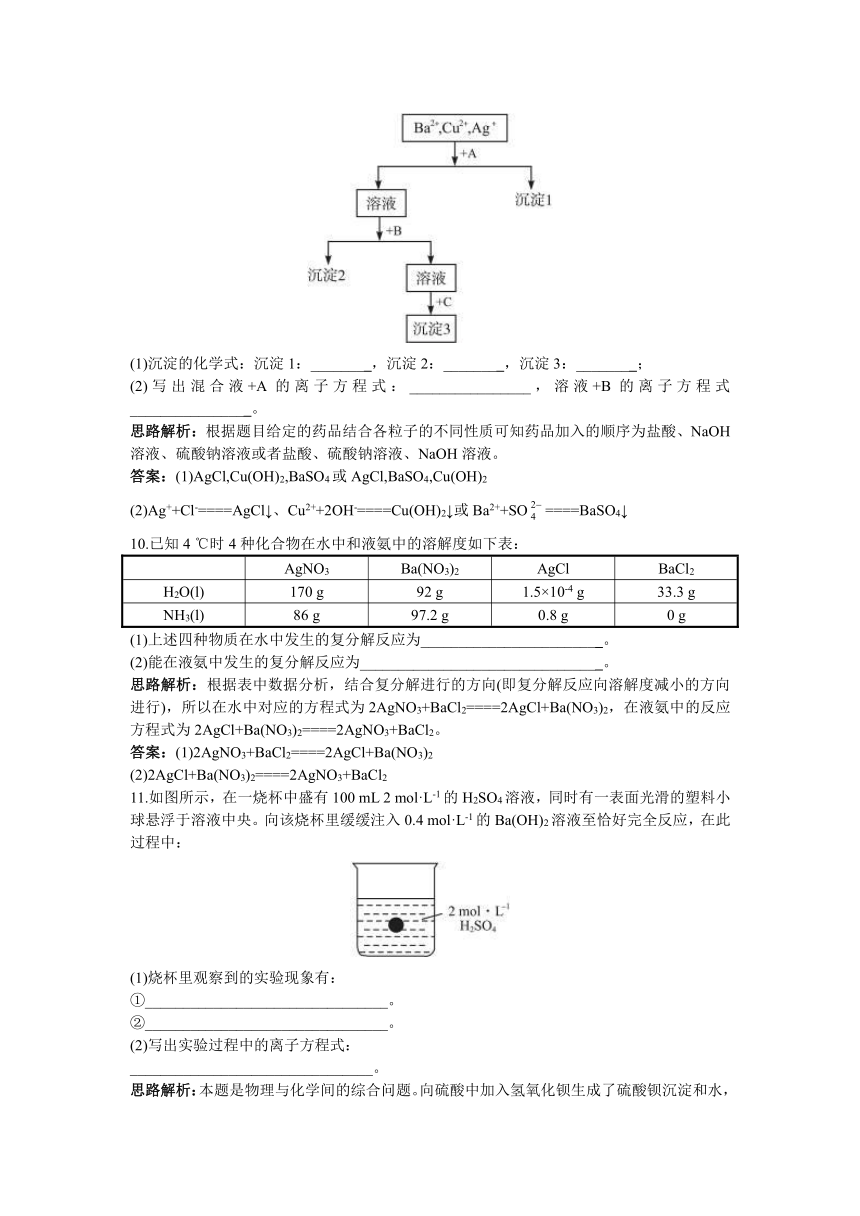
9.某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(写出最佳答案)
(1)沉淀的化学式:沉淀1:________,沉淀2:________,沉淀3:________;
(2)写出混合液+A的离子方程式:________________,溶液+B的离子方程式________________。
思路解析:根据题目给定的药品结合各粒子的不同性质可知药品加入的顺序为盐酸、NaOH溶液、硫酸钠溶液或者盐酸、硫酸钠溶液、NaOH溶液。
答案:(1)AgCl,Cu(OH)2,BaSO4或AgCl,BaSO4,Cu(OH)2
(2)Ag++Cl-====AgCl↓、Cu2++2OH-====Cu(OH)2↓或Ba2++SO====BaSO4↓
10.已知4 ℃时4种化合物在水中和液氨中的溶解度如下表:
AgNO3 Ba(NO3)2 AgCl BaCl2
H2O(l) 170 g 92 g 1.5×10-4 g 33.3 g
NH3(l) 86 g 97.2 g 0.8 g 0 g
(1)上述四种物质在水中发生的复分解反应为________________________。
(2)能在液氨中发生的复分解反应为________________________________。
思路解析:根据表中数据分析,结合复分解进行的方向(即复分解反应向溶解度减小的方向进行),所以在水中对应的方程式为2AgNO3+BaCl2====2AgCl+Ba(NO3)2,在液氨中的反应方程式为2AgCl+Ba(NO3)2====2AgNO3+BaCl2。
答案:(1)2AgNO3+BaCl2====2AgCl+Ba(NO3)2
(2)2AgCl+Ba(NO3)2====2AgNO3+BaCl2
11.如图所示,在一烧杯中盛有100 mL 2 mol·L-1的H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央。向该烧杯里缓缓注入0.4 mol·L-1的Ba(OH)2溶液至恰好完全反应,在此过程中:
(1)烧杯里观察到的实验现象有:
①________________________________。
②________________________________。
(2)写出实验过程中的离子方程式:
________________________________。
思路解析:本题是物理与化学间的综合问题。向硫酸中加入氢氧化钡生成了硫酸钡沉淀和水,溶液的密度减小,小球受到的浮力也随之减小,所以小球就会下沉。
答案:(1)①产生白色沉淀 ②小球下沉至烧杯底部?
(2)Ba2++2OH-+2H++SO====BaSO4↓+2H2O
走近
一、选择题
1.(2010辽宁大综合) 下列反应不能发生的是( )
A.CaCO2+2CH3COOH====(CH3COO)2Ca+H2O+CO2↑
B.SiO2+2NaOH====Na2SiO3+H2O
C.AgNO3+HCl====AgCl↓+HNO3
D.2HCl+Cu====CuCl2+H2↑
思路解析:由于金属铜位于金属活动顺序表的氢之后,所以不能与盐酸反应。
答案:D
2.(2010天津,8) 下列各组离子在溶液中能大量共存的是( )
A.酸性溶液 Na+、K+、MnO、Br-
B.酸性溶液 Fe3+、NH、SCN-、NO
C.碱性溶液 Na+、K+、AlO、SO
D.碱性溶液 Ba2+、Na+、CO、Cl-
思路解析:本题考查离子共存问题。A项中MnO和Br-在酸性条件下发生氧化还原反应而不能大量共存;B项中Fe3+和SCN-发生络合反应而不能大量共存;D项中Ba2+和CO不能大量共存。
答案:C
3.(2010广东大综合,22) 下列反应的现象描述与离子方程式都正确的是( )
A.金属镁与稀盐酸反应,有氢气产生 Mg+2H++2Cl-====MgCl2+H2↑
B.氯化钡溶液与硫酸反应,有白色沉淀产生 Ba2++SO====BaSO4↓
C.碳酸钠溶液与盐酸反应,有气泡逸出 Na2CO3+2H+====2Na++H2O+CO2↑
D.过量铁粉与氯化铁溶液反应,溶液变浅绿色 Fe+Fe3+====2Fe2+
思路解析:A项离子方程式中Cl-未参与反应,应删除;C项中Na2CO3必须拆开;D项方程式左右电荷不相等。
答案:B
4.(2010四川理综,10) 室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
A.NH、Cu2+、Cl-、NO
B.K+、Na+、SO、S2-
C.K+、Na+、AlO、SO
D.Ba2+、Fe2+、NO、Br-
思路解析:本题考查离子共存问题,A中在强碱性条件下不能大量共存;B项在酸性条件下不能大量共存;C项在酸性条件下不能大量共存。
答案:D
5.(2010江苏,5) 下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3+3H2OFe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO+H+====CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu====Fe2++Cu2+
思路解析:A项产生的是Fe(OH)3胶体,不能用沉淀符号;C、D项中方程式两边电荷均不守恒。
答案:B
6.下列各组物质中,按能导电、是强电解质、是弱电解质、是非电解质的顺序排列的是 ( )
A.Cu CaCO3 冰醋酸 SO2
B.CuSO4晶体 NaOH NH3·H2O CH3CH2OH
C.石墨 NaCl H3PO4 Cu
D.熔融NaCl Na2O AlCl3 CCl4
思路解析:本题考查导电性、电解质和非电解质的判断。B项中CuSO4晶体不能导电;C项中Cu为单质,不是非电解质;D项中AlCl3在水中能完全电离,是强电解质。
答案:A
7.下列叙述正确的是( )
A.氯化钠溶液能导电,所以氯化钠溶液是电解质
B.固体氯化钠不导电,但氯化钠是电解质
C.氯化氢水溶液能导电,所以氯化氢是电解质
D.氯气溶于水能导电,所以氯气是电解质
思路解析:本题主要考查电解质的概念。可根据电解质的定义对选项逐一分析便可找到答案。选项A不正确。因为氯化钠溶液是混合物,电解质定义是指化合物。选项B正确。固态氯化钠不导电,是因为NaCl晶体中Na+和Cl-之间离子键的作用使Na+和Cl-不能自由移动,所以不能导电。若在外因条件(水溶液或熔化)下NaCl就能导电,所以NaCl是电解质。选项C正确。氯化氢是强极性共价键形成的化合物,在水分子作用下能完全电离成自由移动的H+和Cl-,氯化氢在水溶液中能导电,所以氯化氢是电解质。选项D不正确。氯气的水溶液能导电,是因为在溶液中存在如下反应:Cl2+H2O====H++Cl-+HClO,且Cl2是单质,而不是化合物,所以氯气不是电解质。注意氯气也不是非电解质,因为非电解质也是指化合物。
答案:BC
8.(2010江苏南通调研) 下列反应的离子方程式书写正确的是( )
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+====Ca2++CO2↑+H2O
B.向过氧化钠固体中滴加水:Na2O2+H2O====2Na++2OH-+O2↑
C.将溶质物质的量之比为4∶3的NaHSO4和Ba(OH)2两溶液混合:4H++3SO+3SO+3Ba2++4OH-====3BaSO4↓+4H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2+2H++H2O2====Fe3++2H2O
思路解析:本题考查离子方程式的正误判断。A中醋酸是弱酸,应写成分子形式,B中电荷不守恒,D中电荷不守恒,因此,只有C是正确的。
答案:C
9.(2010全国理综Ⅱ,8) 下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O====AlO+4NH+2H2O
B.澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO====CaCO3↓+H2O
C.碳酸钙溶于醋酸:CaCO3+2H+====Ca2+CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2====2Fe3++2Cl-
思路解析:A项生成物应该是Al(OH)3;B项苏打是Na2CO3不是NaHCO3;C项醋酸是弱酸,应写成分子式。
答案:D
二、填空题
10.(2010全国理综Ⅱ,27) A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
① A与B反应有气体生成
② B与C反应有沉淀生成
③ C与D反应有沉淀生成
④ D与E反应有沉淀生成
⑤ A与E反应有气体生成
⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是________。
(2)A是________,B是________,C是________,D是________,E是________。
(3)A与E反应的离子方程式是________。
思路解析:本题考查物质鉴别,根据信息①⑤知A为Na2CO3,由信息⑥知产生的沉淀为AgCl,所以C物质为AgNO3,结合其他信息知E为NaHSO4,D为BaCl2,B为盐酸。
答案:(1)AgCl?
(2)Na2CO3 HCl AgNO3 BaCl2 NaHSO4?
(3)2H++CO====CO2↑+H2O
11.某化工厂排放的污水中含有Al3+、Hg2+、Fe3+、Cu2+四种离子,甲、乙、丙三位同学设计从污水中回收铜的方案如下:
(1)以上实验方案能否得到铜(填“能”或“不能”):甲_______,乙_______,丙_______。
(2)在制得铜的方案中会导致环境污染的一步操作是_______,其原因是________________。
(3)在可制得铜的方案中,主要的离子方程式是________________________。
思路解析:由于甲中加入NaOH溶液后Hg2+、Fe3+、Cu2+均沉淀下来,加热沉淀后所得固体物质应为CuO和Fe2O3的混合物(氧化汞加热分解产生汞,加热过程中挥发),用氢气还原后所得物质为铜和铁的混合物;乙中加入铁粉后因发生氧化还原反应产生铜和过量的铁,过滤,在滤渣中加入盐酸,此时铁溶解,再次过滤,加热汞挥发,最终得到铜单质;丙中加入铁粉后过滤,其中会混有铁粉,直接对滤渣加热,再用氢气还原导致制得的铜中混有铁粉。
答案:(1)不能 能 不能?
(2)③ 加热乙中操作②后的滤渣,此时汞蒸气将挥发进入空气中?
(3)Fe+2Fe3+====3Fe2+,Fe+Hg2+====Fe2++Hg,Fe+Cu2+====Fe2++Cu,Fe+2H+====Fe2++H2↑
夯基达标
一、选择题
1.下列物质中能导电的是_______,属于电解质的是_______,属于非电解质的是_______。
①汞 ②氯水 ③氯化钠晶体 ④盐酸 ⑤氧化钠固体 ⑥BaSO4 ⑦液氯 ⑧金刚石 ⑨干冰
思路解析:本题是考查导电性、电解质和非电解质的判断。能导电的物质不一定是电解质,电解质只有电离出自由移动的阴、阳离子才能导电。电解质和非电解质均是化合物。
答案:①②④ ③⑤⑥ ⑨
2.下列电离方程式正确的是( )
A.CH3COOHCH3COO-+H+
B.CaCO3Ca2++CO
C.NaCl====Na+Cl-
D.HClH++Cl-
思路解析:电离方程式中只有强电解质才完全电离,用“====”,弱电解质在水中部分电离用“”。CH3COOH是弱电解质,CaCO3、NaCl、HCl是强电解质。
答案:AC
3.下列物质都能导电,其中属于电解质的是( )
A.NaCl溶液
B.铁
C.稀硫酸
D.熔融的NaOH
思路解析:电解质是溶于水或熔融状态下能导电的化合物。
答案:D
4.在某无色透明的酸性溶液中,能共存的离子组是 …( )
A.Na+、K+、SO、HCO
B.Cu2+、K+、SO、NO
C.Na+、K+、Cl-、NO
D.Fe3+、K+、SO、Cl-
思路解析:由于氢离子能够与碳酸氢根离子反应,所以A项不满足,B中铜离子使溶液呈蓝色,D中铁离子使溶液呈黄色。
答案:C
5.下列各电离方程式书写正确的是( )
A.C2H5OH====C2H+OH-
B.H2SO4====H+SO
C.MgCl2====
D.Al(NO3)3====Al3++3NO
思路解析:A.酒精的水溶液不能导电,酒精在水中不电离,没有电离方程式;B.每个硫酸分子电离生成两个氢离子和一个硫酸根离子,个数应写在化学计量数位置上,不能用H表示,硫酸电离方程式为:H2SO4====2H++SO;C?镁离子符号Mg2+,不能用价标Mg+2表示,同理不能用Cl-1表示Cl-,氯化镁电离方程式为:MgCl2=====Mg2++2Cl-。
答案:D
6.下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液 CH3COOH+NH3====CH3COONH4
B.澄清的石灰水跟盐酸反应 H++OH-====H2O
C.碳酸钡溶于醋酸 BaCO3+2H+====Ba2++H2O+CO2↑
D.金属钠跟水反应 2Na+2H2O====2Na++2OH-+H2↑
思路解析:因醋酸铵为强电解质,故在溶液中应完全电离;又醋酸为弱酸,所以应该用化学式表示。
答案:BD
7.能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与盐酸的反应 H++OH-====H2O
B.澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+====Ca2++2H2O
C.铜片插入硝酸银溶液中 Cu+Ag+====Cu2++Ag
D.碳酸钙溶于稀盐酸中 CaCO3+2H+====Ca2++H2O+CO2↑
思路解析:由于澄清石灰水中氢氧化钙完全电离,所以应用离子表示;C项则不满足电荷守恒。
答案:AD
8.在pH=1的溶液中,可以大量共存的离子是( )
A.Na+ K+ HCO Cl-
B.NH Mg2+ SO Cl-
C.K+ Na+ SO CO
D.K+ Na+ SO NO
思路解析:由于HCO、CO和SO与氢离子能够反应,所以不能大量共存。
答案:B
二、填空题
9.某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(写出最佳答案)
(1)沉淀的化学式:沉淀1:________,沉淀2:________,沉淀3:________;
(2)写出混合液+A的离子方程式:________________,溶液+B的离子方程式________________。
思路解析:根据题目给定的药品结合各粒子的不同性质可知药品加入的顺序为盐酸、NaOH溶液、硫酸钠溶液或者盐酸、硫酸钠溶液、NaOH溶液。
答案:(1)AgCl,Cu(OH)2,BaSO4或AgCl,BaSO4,Cu(OH)2
(2)Ag++Cl-====AgCl↓、Cu2++2OH-====Cu(OH)2↓或Ba2++SO====BaSO4↓
10.已知4 ℃时4种化合物在水中和液氨中的溶解度如下表:
AgNO3 Ba(NO3)2 AgCl BaCl2
H2O(l) 170 g 92 g 1.5×10-4 g 33.3 g
NH3(l) 86 g 97.2 g 0.8 g 0 g
(1)上述四种物质在水中发生的复分解反应为________________________。
(2)能在液氨中发生的复分解反应为________________________________。
思路解析:根据表中数据分析,结合复分解进行的方向(即复分解反应向溶解度减小的方向进行),所以在水中对应的方程式为2AgNO3+BaCl2====2AgCl+Ba(NO3)2,在液氨中的反应方程式为2AgCl+Ba(NO3)2====2AgNO3+BaCl2。
答案:(1)2AgNO3+BaCl2====2AgCl+Ba(NO3)2
(2)2AgCl+Ba(NO3)2====2AgNO3+BaCl2
11.如图所示,在一烧杯中盛有100 mL 2 mol·L-1的H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央。向该烧杯里缓缓注入0.4 mol·L-1的Ba(OH)2溶液至恰好完全反应,在此过程中:
(1)烧杯里观察到的实验现象有:
①________________________________。
②________________________________。
(2)写出实验过程中的离子方程式:
________________________________。
思路解析:本题是物理与化学间的综合问题。向硫酸中加入氢氧化钡生成了硫酸钡沉淀和水,溶液的密度减小,小球受到的浮力也随之减小,所以小球就会下沉。
答案:(1)①产生白色沉淀 ②小球下沉至烧杯底部?
(2)Ba2++2OH-+2H++SO====BaSO4↓+2H2O
走近
一、选择题
1.(2010辽宁大综合) 下列反应不能发生的是( )
A.CaCO2+2CH3COOH====(CH3COO)2Ca+H2O+CO2↑
B.SiO2+2NaOH====Na2SiO3+H2O
C.AgNO3+HCl====AgCl↓+HNO3
D.2HCl+Cu====CuCl2+H2↑
思路解析:由于金属铜位于金属活动顺序表的氢之后,所以不能与盐酸反应。
答案:D
2.(2010天津,8) 下列各组离子在溶液中能大量共存的是( )
A.酸性溶液 Na+、K+、MnO、Br-
B.酸性溶液 Fe3+、NH、SCN-、NO
C.碱性溶液 Na+、K+、AlO、SO
D.碱性溶液 Ba2+、Na+、CO、Cl-
思路解析:本题考查离子共存问题。A项中MnO和Br-在酸性条件下发生氧化还原反应而不能大量共存;B项中Fe3+和SCN-发生络合反应而不能大量共存;D项中Ba2+和CO不能大量共存。
答案:C
3.(2010广东大综合,22) 下列反应的现象描述与离子方程式都正确的是( )
A.金属镁与稀盐酸反应,有氢气产生 Mg+2H++2Cl-====MgCl2+H2↑
B.氯化钡溶液与硫酸反应,有白色沉淀产生 Ba2++SO====BaSO4↓
C.碳酸钠溶液与盐酸反应,有气泡逸出 Na2CO3+2H+====2Na++H2O+CO2↑
D.过量铁粉与氯化铁溶液反应,溶液变浅绿色 Fe+Fe3+====2Fe2+
思路解析:A项离子方程式中Cl-未参与反应,应删除;C项中Na2CO3必须拆开;D项方程式左右电荷不相等。
答案:B
4.(2010四川理综,10) 室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
A.NH、Cu2+、Cl-、NO
B.K+、Na+、SO、S2-
C.K+、Na+、AlO、SO
D.Ba2+、Fe2+、NO、Br-
思路解析:本题考查离子共存问题,A中在强碱性条件下不能大量共存;B项在酸性条件下不能大量共存;C项在酸性条件下不能大量共存。
答案:D
5.(2010江苏,5) 下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3+3H2OFe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO+H+====CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu====Fe2++Cu2+
思路解析:A项产生的是Fe(OH)3胶体,不能用沉淀符号;C、D项中方程式两边电荷均不守恒。
答案:B
6.下列各组物质中,按能导电、是强电解质、是弱电解质、是非电解质的顺序排列的是 ( )
A.Cu CaCO3 冰醋酸 SO2
B.CuSO4晶体 NaOH NH3·H2O CH3CH2OH
C.石墨 NaCl H3PO4 Cu
D.熔融NaCl Na2O AlCl3 CCl4
思路解析:本题考查导电性、电解质和非电解质的判断。B项中CuSO4晶体不能导电;C项中Cu为单质,不是非电解质;D项中AlCl3在水中能完全电离,是强电解质。
答案:A
7.下列叙述正确的是( )
A.氯化钠溶液能导电,所以氯化钠溶液是电解质
B.固体氯化钠不导电,但氯化钠是电解质
C.氯化氢水溶液能导电,所以氯化氢是电解质
D.氯气溶于水能导电,所以氯气是电解质
思路解析:本题主要考查电解质的概念。可根据电解质的定义对选项逐一分析便可找到答案。选项A不正确。因为氯化钠溶液是混合物,电解质定义是指化合物。选项B正确。固态氯化钠不导电,是因为NaCl晶体中Na+和Cl-之间离子键的作用使Na+和Cl-不能自由移动,所以不能导电。若在外因条件(水溶液或熔化)下NaCl就能导电,所以NaCl是电解质。选项C正确。氯化氢是强极性共价键形成的化合物,在水分子作用下能完全电离成自由移动的H+和Cl-,氯化氢在水溶液中能导电,所以氯化氢是电解质。选项D不正确。氯气的水溶液能导电,是因为在溶液中存在如下反应:Cl2+H2O====H++Cl-+HClO,且Cl2是单质,而不是化合物,所以氯气不是电解质。注意氯气也不是非电解质,因为非电解质也是指化合物。
答案:BC
8.(2010江苏南通调研) 下列反应的离子方程式书写正确的是( )
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+====Ca2++CO2↑+H2O
B.向过氧化钠固体中滴加水:Na2O2+H2O====2Na++2OH-+O2↑
C.将溶质物质的量之比为4∶3的NaHSO4和Ba(OH)2两溶液混合:4H++3SO+3SO+3Ba2++4OH-====3BaSO4↓+4H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2+2H++H2O2====Fe3++2H2O
思路解析:本题考查离子方程式的正误判断。A中醋酸是弱酸,应写成分子形式,B中电荷不守恒,D中电荷不守恒,因此,只有C是正确的。
答案:C
9.(2010全国理综Ⅱ,8) 下列反应的离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O====AlO+4NH+2H2O
B.澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO====CaCO3↓+H2O
C.碳酸钙溶于醋酸:CaCO3+2H+====Ca2+CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2====2Fe3++2Cl-
思路解析:A项生成物应该是Al(OH)3;B项苏打是Na2CO3不是NaHCO3;C项醋酸是弱酸,应写成分子式。
答案:D
二、填空题
10.(2010全国理综Ⅱ,27) A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
① A与B反应有气体生成
② B与C反应有沉淀生成
③ C与D反应有沉淀生成
④ D与E反应有沉淀生成
⑤ A与E反应有气体生成
⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是________。
(2)A是________,B是________,C是________,D是________,E是________。
(3)A与E反应的离子方程式是________。
思路解析:本题考查物质鉴别,根据信息①⑤知A为Na2CO3,由信息⑥知产生的沉淀为AgCl,所以C物质为AgNO3,结合其他信息知E为NaHSO4,D为BaCl2,B为盐酸。
答案:(1)AgCl?
(2)Na2CO3 HCl AgNO3 BaCl2 NaHSO4?
(3)2H++CO====CO2↑+H2O
11.某化工厂排放的污水中含有Al3+、Hg2+、Fe3+、Cu2+四种离子,甲、乙、丙三位同学设计从污水中回收铜的方案如下:
(1)以上实验方案能否得到铜(填“能”或“不能”):甲_______,乙_______,丙_______。
(2)在制得铜的方案中会导致环境污染的一步操作是_______,其原因是________________。
(3)在可制得铜的方案中,主要的离子方程式是________________________。
思路解析:由于甲中加入NaOH溶液后Hg2+、Fe3+、Cu2+均沉淀下来,加热沉淀后所得固体物质应为CuO和Fe2O3的混合物(氧化汞加热分解产生汞,加热过程中挥发),用氢气还原后所得物质为铜和铁的混合物;乙中加入铁粉后因发生氧化还原反应产生铜和过量的铁,过滤,在滤渣中加入盐酸,此时铁溶解,再次过滤,加热汞挥发,最终得到铜单质;丙中加入铁粉后过滤,其中会混有铁粉,直接对滤渣加热,再用氢气还原导致制得的铜中混有铁粉。
答案:(1)不能 能 不能?
(2)③ 加热乙中操作②后的滤渣,此时汞蒸气将挥发进入空气中?
(3)Fe+2Fe3+====3Fe2+,Fe+Hg2+====Fe2++Hg,Fe+Cu2+====Fe2++Cu,Fe+2H+====Fe2++H2↑
