人教新课标选修4名师导航( 原电池)
文档属性
| 名称 | 人教新课标选修4名师导航( 原电池) |  | |
| 格式 | zip | ||
| 文件大小 | 38.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-12-14 17:11:00 | ||
图片预览


文档简介
第一节 原电池
名师导航
知识梳理
1.电化学是_______________________________的科学。从_________与_________的关系来区分,电化学反应过程(及其装置)可以分为两类:__________________和______________。
2.原电池:将_________转化为_________的装置。
3.氧化还原的本质是_________与_________之间发生_________的过程,通常氧化还原反应中并不能获得电流,要使能量直接转变为电能,就要设计_________,使_________反应和_________反应分别在_________进行。
4.原电池的构成条件:_________、_________、_________、_________。
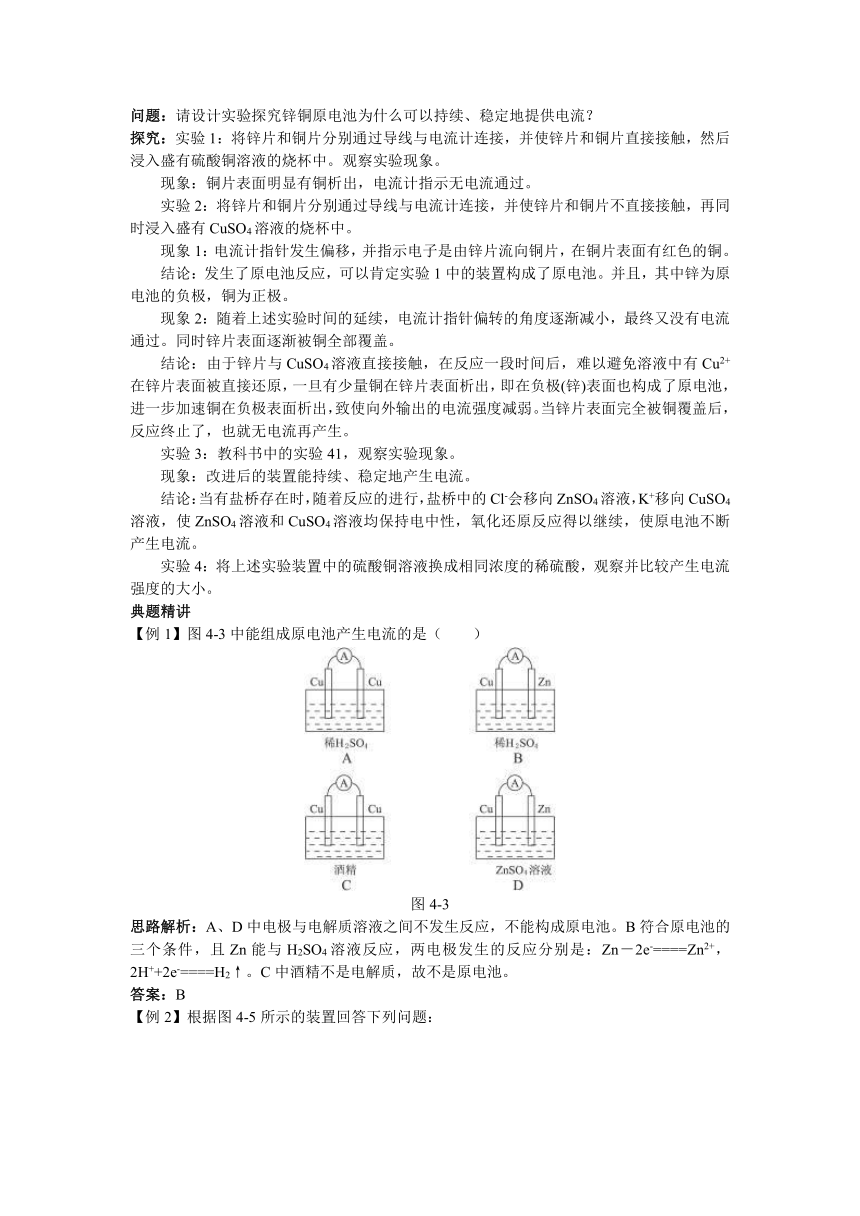
5.原电池的工作原理(以图4-1为例):Zn为_________极,Cu为_________极;负极上发生_________反应,电极反应式为_________,正极上发生_________反应,电极反应式为__________________;电子流出的极是极,电子流入的极是_______极;电流方向_________。盐桥中的盐溶液是_________溶液,其作用为________________________。盐桥中的_______会移向ZnSO4溶液,_________移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性。该原电池工作一段时间后,两电极的质量将会______________________________________。
图4-1
疑难突破
1.原电池的构成条件有哪些?
剖析:①具有不同的电极,较活泼的金属作负极,发生氧化反应;较不活泼金属或非金属(石墨等)作正极,得到电子,发生还原反应,本身不变。
②具有电解质溶液。
③具有导线相连(或直接接触)组成闭合回路,或具备将化学能转变成电能的条件。
④能自发地发生氧化还原反应(有明显电流产生时需具备此条件)。
2.如何判断原电池的正负极?
剖析:原电池有两个电极,一个是正极,一个是负极。判断正极和负极的方法是:
①由组成原电池的两极材料判断。一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断。电流是由正极流向负极;电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向流动方向。在原电池的电解质溶液内,阳离子移向的极是正极,阴离子移向的极为负极。
④根据原电池两极发生的变化来判断。原电池的负极总是失电子发生氧化反应,其正极总是得电子发生还原反应。
问题探究
问题:请设计实验探究锌铜原电池为什么可以持续、稳定地提供电流?
探究:实验1:将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片直接接触,然后浸入盛有硫酸铜溶液的烧杯中。观察实验现象。
现象:铜片表面明显有铜析出,电流计指示无电流通过。
实验2:将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,再同时浸入盛有CuSO4溶液的烧杯中。
现象1:电流计指针发生偏移,并指示电子是由锌片流向铜片,在铜片表面有红色的铜。
结论:发生了原电池反应,可以肯定实验1中的装置构成了原电池。并且,其中锌为原电池的负极,铜为正极。
现象2:随着上述实验时间的延续,电流计指针偏转的角度逐渐减小,最终又没有电流通过。同时锌片表面逐渐被铜全部覆盖。
结论:由于锌片与CuSO4溶液直接接触,在反应一段时间后,难以避免溶液中有Cu2+在锌片表面被直接还原,一旦有少量铜在锌片表面析出,即在负极(锌)表面也构成了原电池,进一步加速铜在负极表面析出,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,反应终止了,也就无电流再产生。
实验3:教科书中的实验41,观察实验现象。
现象:改进后的装置能持续、稳定地产生电流。
结论:当有盐桥存在时,随着反应的进行,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性,氧化还原反应得以继续,使原电池不断产生电流。
实验4:将上述实验装置中的硫酸铜溶液换成相同浓度的稀硫酸,观察并比较产生电流强度的大小。
典题精讲
【例1】图4-3中能组成原电池产生电流的是( )
图4-3
思路解析:A、D中电极与电解质溶液之间不发生反应,不能构成原电池。B符合原电池的三个条件,且Zn能与H2SO4溶液反应,两电极发生的反应分别是:Zn-2e-====Zn2+,2H++2e-====H2↑。C中酒精不是电解质,故不是原电池。
答案:B
【例2】根据图4-5所示的装置回答下列问题:
图4-5
(1)铁片与铜片不用导线连接,有何现象发生?写出反应的化学方程式。
(2)用导线把金属片连接起来,现象有什么不同?用最恰当的化学方程式表示发生的反应。
思路解析:第(1)种情况,铜片不起作用,铁与H+反应,但速率较小,铁片越纯,表面越光滑,反应速率越小。第(2)种情况,用导线连接后构成了原电池,正极产生氢气,所以气泡从铜片表面逸出。原电池的形成使电子得以顺利转移,H+在Cu表面得到电子比在铁表面容易得多,所以反应速率增大,氢气逸出速率增大,铁的溶解速率也增大。
答案:(1)铁片与铜片不用导线连接,则铁片表面有气泡产生,但速率较慢。
Fe+H2SO4====FeSO4+H2↑
(2)①气泡不从铁片表面而是从铜片表面逸出;②产生氢气的速率明显加大。电极反应式:
负极:Fe-2e-====Fe2+
正极:2H++2e-====H2↑
【例3】选择适宜的材料和试剂设计一个原电池,以便完成下列反应:2FeCl3+Cu====2FeCl2+
CuCl2。画出原电池的示意图并写出电极反应。
图4-6
思路解析:根据形成原电池的3个条件,可知必须选择两个电极的材料和电解质溶液。在反应2FeCl3+Cu====2FeCl2+CuCl2中,Cu是被氧化的,应该是原电池负极上发生的反应,Cu作负极材料最适宜,而正极只需选活泼性比Cu弱的金属或非金属电极即可,可选择石墨电极。Fe3+在正极上被还原,所以选择FeCl3溶液作电解液,如图4-6所示。
答案:原电池设计如图4-6所示。
负极:Cu-2e-====Cu2+
正极:2Fe3++2e-====2Fe2+
总反应:Cu+2Fe3+====Cu2++2Fe2+
【例4】 X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断四种金属的活动顺序是( )
A.X>Z>W>Y B.Z>X>Y>W
C.W>X>Y>Z D.Y>W>Z>X
思路解析:在原电池中,活泼金属作为电池的负极,失去电子发生氧化反应;不活泼的金属作为电池的正极,得到电子发生还原反应。电子由负极经导线流向正极,与电流的方向相反(物理学中规定正电荷移动的方向为电流的方向)。因此,X、Y相连时,X为负极,则活泼性X>Y;Z、W相连时,电流方向是W→Z,则活泼性Z>W;X、Z相连时,Z极上产生大量气泡,则活泼性X>Z;W、Y相连时,W极发生氧化反应,则W>Y。综上,可以得出金属的活泼性顺序是X>Z>W>Y。
答案:A
知识导学
本节内容以必修化学2第二章第二节“化学能与电能”为基础,进一步介绍原电池的组成和工作原理,通过对原电池中闭和电路形成过程的分析,引出半电池、盐桥、内电路、外电路等概念,要求能够写出相关的电极反应和电池反应方程式。
学习本节前应复习氧化还原反应的有关知识:氧化反应、还原反应等;金属活泼性的强弱判断;电解质溶液;锌铜原电池原理及构成条件。
对于锌铜原电池的工作原理可以采用图4-2学习:
图4-2
学习中常犯的错误是原电池正负极的判断,不一定是较活泼的金属一定作负极,而要看是否发生氧化反应。如:铁、铜和浓硝酸组成的原电池,虽然铁的活泼性比较强,但不能与浓硝酸反应,而铜可以,因此铜作负极,铁作正极。
疑难导析
对于构成原电池的四个基本条件要注意以下几点:(1)构成原电池的四个基本条件是相互联系的,不能孤立、片面地看待某一条件,在四个基本条件当中,氧化还原反应是核心。(2)判断某装置是否为原电池的问题,要以构成原电池的基本条件为标准判断,不能仅凭装置的外形下结论。(3)构成原电池的基本条件,还是进行原电池设计的基本依据。
原电池的正负极的判断方法虽然比较多,但原电池反应的实质是负极发生氧化反应,失去电子,正极发生还原反应,得到电子,因此,对于具体问题要具体分析,不能想当然,不然就会落入出题者的陷阱当中,如:①铁、铜和浓硝酸组成的原电池,虽然铁的活泼性比较强,但不能与浓硝酸反应,而铜可以,因此铜作负极,铁作正极。②镁、铝和NaOH溶液组成原电池,作负极的应该是铝,而不是镁。
问题导思
可以通过实验逐步进行探讨:根据实验1可以设想本实验装置是否构成了原电池,如果没有发生原电池反应,铜片表面为什么明显有红色的铜析出,并且锌片逐渐溶解 如果实验装置就是原电池,为什么电流计的指针又不动,表现出无电流产生 (实验中可单独置一铜片于该CuSO4溶液中,以作对比,说明铜不与硫酸铜溶液反应。)根据“铜片表面明显有红色的铜析出,并且锌片逐渐溶解”的实验现象,应该表现出原电池中电极反应的特点;借助物理学中的电学知识可以判断,电流计指针不动的原因可能跟锌片与铜片直接接触有关,由此进行实验2。
由实验2现象及结论进一步思考:作为原电池,其功能就是要将化学能转换成电能,上述实验中负极上的变化势必影响原电池的供电效率。能否设法阻止溶液中的Cu2+在负极(锌)表面还原 进行实验3。
然后做对比实验4并思考产生电流强度的大小不同的原因。可借助金属活动性顺序分析上述实验电流强度大小不同的原因,同时也可以说明溶液中H+与Cu2+离子在正极放电的顺序。
典题导考
绿色通道:原电池装置的构成条件:①有活泼性不同的电极;②电解质溶液;③形成闭合回路。只有这三个条件同时具备才有可能产生原电池电流。
【典题变式1】如图4-4装置,电流表G发生偏转,同时a极逐渐变粗,b极逐渐变细,c为电解质溶液,则a、b、c应是下列各组中的( )
图4-4
A.a是Zn、b是Cu、c为稀H2SO4溶液 B.a是Cu、b是Zn、c为稀H2SO4溶液
C.a是Fe、b是Ag、c为AgNO3溶液 D.a是Ag、b是Fe、c为AgNO3溶液
答案:C
绿色通道:若要加快铁片和酸的反应速率,可用铜片与之接触或加少量CuSO4溶液使铁从局部置换出铜,形成原电池。同样,在制备氢气的实验中,为加速锌与酸反应制取氢气的速率,可以在酸中加少量CuSO4溶液,以使锌与CuSO4溶液局部置换出的Cu形成原电池;或用粗锌与酸反应形成原电池加快反应速率。
【典题变式2】1.100 mL浓度为2 mol ·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6 mol ·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
答案:B
2.实验室中用稀硝酸与铜反应制取NO气体,已知该反应很慢,欲提高反应速率,下列方法中正确的是( )
A.加一块Fe片,使之与Cu接触 B.加一块石墨,使之与Cu接触
C.加少量浓硝酸 D.加少量浓硫酸
答案:B
绿色通道:原电池装置是该装置必须能自发地发生氧化还原反应。所以对装置的正、负极材料选择必须要注意该材料在装置中作什么电极,这样才能作出正确的选择。
【典题变式3】某原电池的总反应离子方程式为:2Fe3++Fe====3Fe2+,不能实现该反应的原电池是( )
A.Cu为正极,Fe为负极,电解质溶液为FeCl3溶液
B.石墨为正极,Fe为负极,电解质溶液为Fe(NO3)3溶液
C.Fe为正极,Zn为负极,电解质溶液为Fe2(SO4)3溶液
D.Ag为正极,Fe为负极,电解质溶液为CuSO4溶液
答案:CD
绿色通道:根据原电池的组成判断金属活泼性强弱是原电池原理的重要应用,一定要注意:在原电池中活泼金属作负极,发生氧化反应,被腐蚀;不活泼金属作正极,发生还原反应,常被保护起来;电子移动方向是由负极流向正极,与电流的方向相反。
【典题变式4】 X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M B.X>Y>Z>M
C.M>Z>X>Y D.X>Z>M>Y
答案:A
名师导航
知识梳理
1.电化学是_______________________________的科学。从_________与_________的关系来区分,电化学反应过程(及其装置)可以分为两类:__________________和______________。
2.原电池:将_________转化为_________的装置。
3.氧化还原的本质是_________与_________之间发生_________的过程,通常氧化还原反应中并不能获得电流,要使能量直接转变为电能,就要设计_________,使_________反应和_________反应分别在_________进行。
4.原电池的构成条件:_________、_________、_________、_________。
5.原电池的工作原理(以图4-1为例):Zn为_________极,Cu为_________极;负极上发生_________反应,电极反应式为_________,正极上发生_________反应,电极反应式为__________________;电子流出的极是极,电子流入的极是_______极;电流方向_________。盐桥中的盐溶液是_________溶液,其作用为________________________。盐桥中的_______会移向ZnSO4溶液,_________移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性。该原电池工作一段时间后,两电极的质量将会______________________________________。
图4-1
疑难突破
1.原电池的构成条件有哪些?
剖析:①具有不同的电极,较活泼的金属作负极,发生氧化反应;较不活泼金属或非金属(石墨等)作正极,得到电子,发生还原反应,本身不变。
②具有电解质溶液。
③具有导线相连(或直接接触)组成闭合回路,或具备将化学能转变成电能的条件。
④能自发地发生氧化还原反应(有明显电流产生时需具备此条件)。
2.如何判断原电池的正负极?
剖析:原电池有两个电极,一个是正极,一个是负极。判断正极和负极的方法是:
①由组成原电池的两极材料判断。一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断。电流是由正极流向负极;电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向流动方向。在原电池的电解质溶液内,阳离子移向的极是正极,阴离子移向的极为负极。
④根据原电池两极发生的变化来判断。原电池的负极总是失电子发生氧化反应,其正极总是得电子发生还原反应。
问题探究
问题:请设计实验探究锌铜原电池为什么可以持续、稳定地提供电流?
探究:实验1:将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片直接接触,然后浸入盛有硫酸铜溶液的烧杯中。观察实验现象。
现象:铜片表面明显有铜析出,电流计指示无电流通过。
实验2:将锌片和铜片分别通过导线与电流计连接,并使锌片和铜片不直接接触,再同时浸入盛有CuSO4溶液的烧杯中。
现象1:电流计指针发生偏移,并指示电子是由锌片流向铜片,在铜片表面有红色的铜。
结论:发生了原电池反应,可以肯定实验1中的装置构成了原电池。并且,其中锌为原电池的负极,铜为正极。
现象2:随着上述实验时间的延续,电流计指针偏转的角度逐渐减小,最终又没有电流通过。同时锌片表面逐渐被铜全部覆盖。
结论:由于锌片与CuSO4溶液直接接触,在反应一段时间后,难以避免溶液中有Cu2+在锌片表面被直接还原,一旦有少量铜在锌片表面析出,即在负极(锌)表面也构成了原电池,进一步加速铜在负极表面析出,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,反应终止了,也就无电流再产生。
实验3:教科书中的实验41,观察实验现象。
现象:改进后的装置能持续、稳定地产生电流。
结论:当有盐桥存在时,随着反应的进行,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性,氧化还原反应得以继续,使原电池不断产生电流。
实验4:将上述实验装置中的硫酸铜溶液换成相同浓度的稀硫酸,观察并比较产生电流强度的大小。
典题精讲
【例1】图4-3中能组成原电池产生电流的是( )
图4-3
思路解析:A、D中电极与电解质溶液之间不发生反应,不能构成原电池。B符合原电池的三个条件,且Zn能与H2SO4溶液反应,两电极发生的反应分别是:Zn-2e-====Zn2+,2H++2e-====H2↑。C中酒精不是电解质,故不是原电池。
答案:B
【例2】根据图4-5所示的装置回答下列问题:
图4-5
(1)铁片与铜片不用导线连接,有何现象发生?写出反应的化学方程式。
(2)用导线把金属片连接起来,现象有什么不同?用最恰当的化学方程式表示发生的反应。
思路解析:第(1)种情况,铜片不起作用,铁与H+反应,但速率较小,铁片越纯,表面越光滑,反应速率越小。第(2)种情况,用导线连接后构成了原电池,正极产生氢气,所以气泡从铜片表面逸出。原电池的形成使电子得以顺利转移,H+在Cu表面得到电子比在铁表面容易得多,所以反应速率增大,氢气逸出速率增大,铁的溶解速率也增大。
答案:(1)铁片与铜片不用导线连接,则铁片表面有气泡产生,但速率较慢。
Fe+H2SO4====FeSO4+H2↑
(2)①气泡不从铁片表面而是从铜片表面逸出;②产生氢气的速率明显加大。电极反应式:
负极:Fe-2e-====Fe2+
正极:2H++2e-====H2↑
【例3】选择适宜的材料和试剂设计一个原电池,以便完成下列反应:2FeCl3+Cu====2FeCl2+
CuCl2。画出原电池的示意图并写出电极反应。
图4-6
思路解析:根据形成原电池的3个条件,可知必须选择两个电极的材料和电解质溶液。在反应2FeCl3+Cu====2FeCl2+CuCl2中,Cu是被氧化的,应该是原电池负极上发生的反应,Cu作负极材料最适宜,而正极只需选活泼性比Cu弱的金属或非金属电极即可,可选择石墨电极。Fe3+在正极上被还原,所以选择FeCl3溶液作电解液,如图4-6所示。
答案:原电池设计如图4-6所示。
负极:Cu-2e-====Cu2+
正极:2Fe3++2e-====2Fe2+
总反应:Cu+2Fe3+====Cu2++2Fe2+
【例4】 X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断四种金属的活动顺序是( )
A.X>Z>W>Y B.Z>X>Y>W
C.W>X>Y>Z D.Y>W>Z>X
思路解析:在原电池中,活泼金属作为电池的负极,失去电子发生氧化反应;不活泼的金属作为电池的正极,得到电子发生还原反应。电子由负极经导线流向正极,与电流的方向相反(物理学中规定正电荷移动的方向为电流的方向)。因此,X、Y相连时,X为负极,则活泼性X>Y;Z、W相连时,电流方向是W→Z,则活泼性Z>W;X、Z相连时,Z极上产生大量气泡,则活泼性X>Z;W、Y相连时,W极发生氧化反应,则W>Y。综上,可以得出金属的活泼性顺序是X>Z>W>Y。
答案:A
知识导学
本节内容以必修化学2第二章第二节“化学能与电能”为基础,进一步介绍原电池的组成和工作原理,通过对原电池中闭和电路形成过程的分析,引出半电池、盐桥、内电路、外电路等概念,要求能够写出相关的电极反应和电池反应方程式。
学习本节前应复习氧化还原反应的有关知识:氧化反应、还原反应等;金属活泼性的强弱判断;电解质溶液;锌铜原电池原理及构成条件。
对于锌铜原电池的工作原理可以采用图4-2学习:
图4-2
学习中常犯的错误是原电池正负极的判断,不一定是较活泼的金属一定作负极,而要看是否发生氧化反应。如:铁、铜和浓硝酸组成的原电池,虽然铁的活泼性比较强,但不能与浓硝酸反应,而铜可以,因此铜作负极,铁作正极。
疑难导析
对于构成原电池的四个基本条件要注意以下几点:(1)构成原电池的四个基本条件是相互联系的,不能孤立、片面地看待某一条件,在四个基本条件当中,氧化还原反应是核心。(2)判断某装置是否为原电池的问题,要以构成原电池的基本条件为标准判断,不能仅凭装置的外形下结论。(3)构成原电池的基本条件,还是进行原电池设计的基本依据。
原电池的正负极的判断方法虽然比较多,但原电池反应的实质是负极发生氧化反应,失去电子,正极发生还原反应,得到电子,因此,对于具体问题要具体分析,不能想当然,不然就会落入出题者的陷阱当中,如:①铁、铜和浓硝酸组成的原电池,虽然铁的活泼性比较强,但不能与浓硝酸反应,而铜可以,因此铜作负极,铁作正极。②镁、铝和NaOH溶液组成原电池,作负极的应该是铝,而不是镁。
问题导思
可以通过实验逐步进行探讨:根据实验1可以设想本实验装置是否构成了原电池,如果没有发生原电池反应,铜片表面为什么明显有红色的铜析出,并且锌片逐渐溶解 如果实验装置就是原电池,为什么电流计的指针又不动,表现出无电流产生 (实验中可单独置一铜片于该CuSO4溶液中,以作对比,说明铜不与硫酸铜溶液反应。)根据“铜片表面明显有红色的铜析出,并且锌片逐渐溶解”的实验现象,应该表现出原电池中电极反应的特点;借助物理学中的电学知识可以判断,电流计指针不动的原因可能跟锌片与铜片直接接触有关,由此进行实验2。
由实验2现象及结论进一步思考:作为原电池,其功能就是要将化学能转换成电能,上述实验中负极上的变化势必影响原电池的供电效率。能否设法阻止溶液中的Cu2+在负极(锌)表面还原 进行实验3。
然后做对比实验4并思考产生电流强度的大小不同的原因。可借助金属活动性顺序分析上述实验电流强度大小不同的原因,同时也可以说明溶液中H+与Cu2+离子在正极放电的顺序。
典题导考
绿色通道:原电池装置的构成条件:①有活泼性不同的电极;②电解质溶液;③形成闭合回路。只有这三个条件同时具备才有可能产生原电池电流。
【典题变式1】如图4-4装置,电流表G发生偏转,同时a极逐渐变粗,b极逐渐变细,c为电解质溶液,则a、b、c应是下列各组中的( )
图4-4
A.a是Zn、b是Cu、c为稀H2SO4溶液 B.a是Cu、b是Zn、c为稀H2SO4溶液
C.a是Fe、b是Ag、c为AgNO3溶液 D.a是Ag、b是Fe、c为AgNO3溶液
答案:C
绿色通道:若要加快铁片和酸的反应速率,可用铜片与之接触或加少量CuSO4溶液使铁从局部置换出铜,形成原电池。同样,在制备氢气的实验中,为加速锌与酸反应制取氢气的速率,可以在酸中加少量CuSO4溶液,以使锌与CuSO4溶液局部置换出的Cu形成原电池;或用粗锌与酸反应形成原电池加快反应速率。
【典题变式2】1.100 mL浓度为2 mol ·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6 mol ·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
答案:B
2.实验室中用稀硝酸与铜反应制取NO气体,已知该反应很慢,欲提高反应速率,下列方法中正确的是( )
A.加一块Fe片,使之与Cu接触 B.加一块石墨,使之与Cu接触
C.加少量浓硝酸 D.加少量浓硫酸
答案:B
绿色通道:原电池装置是该装置必须能自发地发生氧化还原反应。所以对装置的正、负极材料选择必须要注意该材料在装置中作什么电极,这样才能作出正确的选择。
【典题变式3】某原电池的总反应离子方程式为:2Fe3++Fe====3Fe2+,不能实现该反应的原电池是( )
A.Cu为正极,Fe为负极,电解质溶液为FeCl3溶液
B.石墨为正极,Fe为负极,电解质溶液为Fe(NO3)3溶液
C.Fe为正极,Zn为负极,电解质溶液为Fe2(SO4)3溶液
D.Ag为正极,Fe为负极,电解质溶液为CuSO4溶液
答案:CD
绿色通道:根据原电池的组成判断金属活泼性强弱是原电池原理的重要应用,一定要注意:在原电池中活泼金属作负极,发生氧化反应,被腐蚀;不活泼金属作正极,发生还原反应,常被保护起来;电子移动方向是由负极流向正极,与电流的方向相反。
【典题变式4】 X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M B.X>Y>Z>M
C.M>Z>X>Y D.X>Z>M>Y
答案:A
