硫酸的工业制法第1课时
图片预览

文档简介
课件18张PPT。专题四
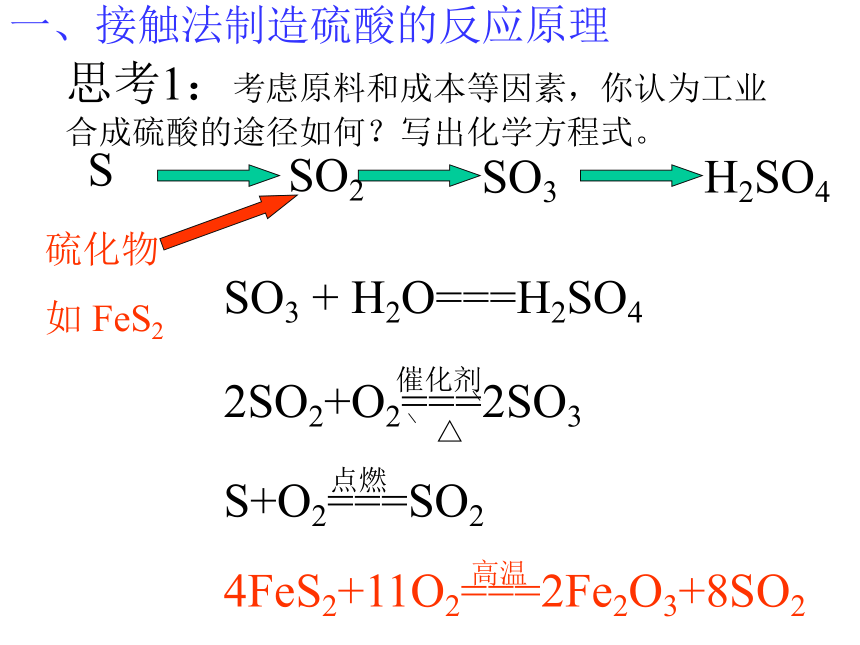
硫酸的工业制法---接触法一、接触法制造硫酸的反应原理H2SO4SO3SO2S硫化物
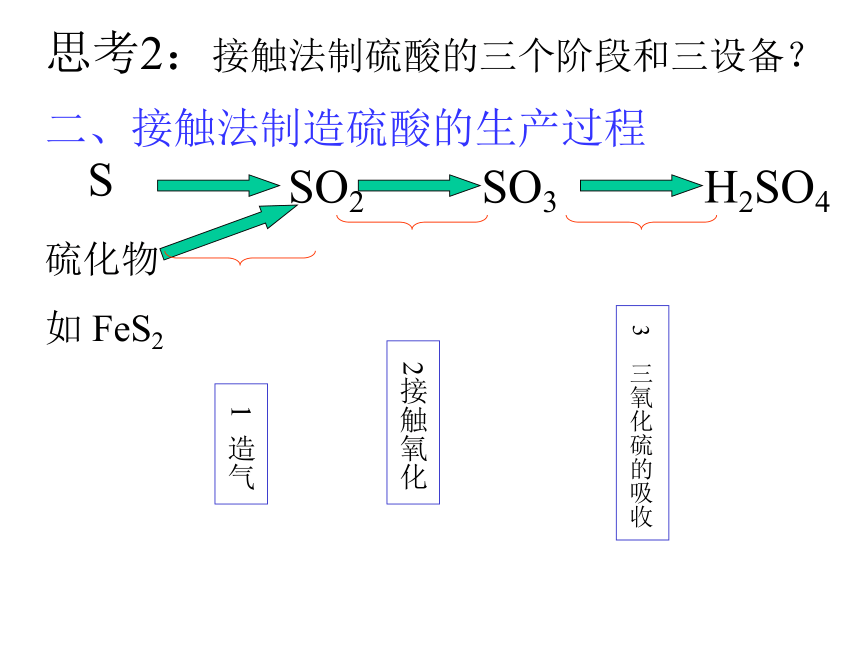
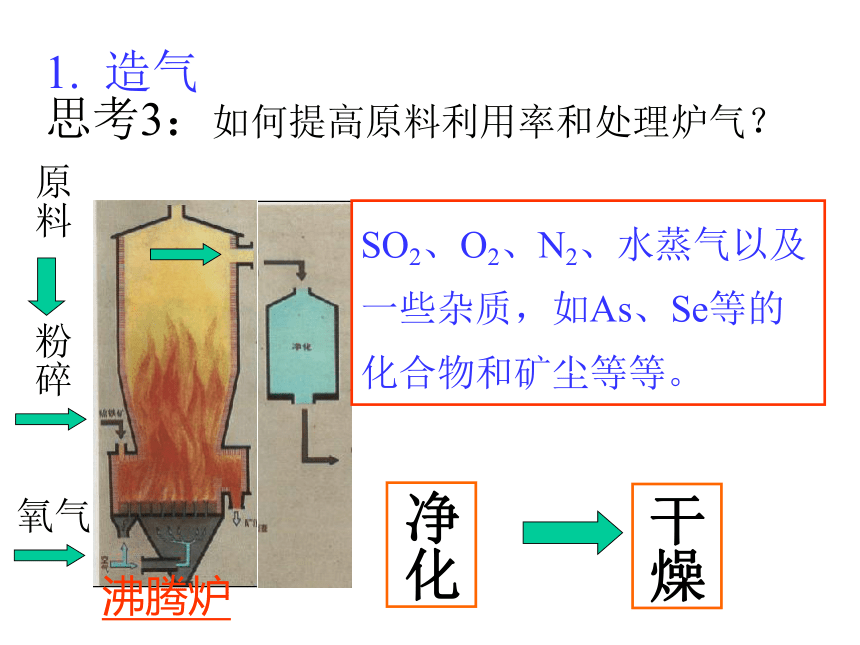
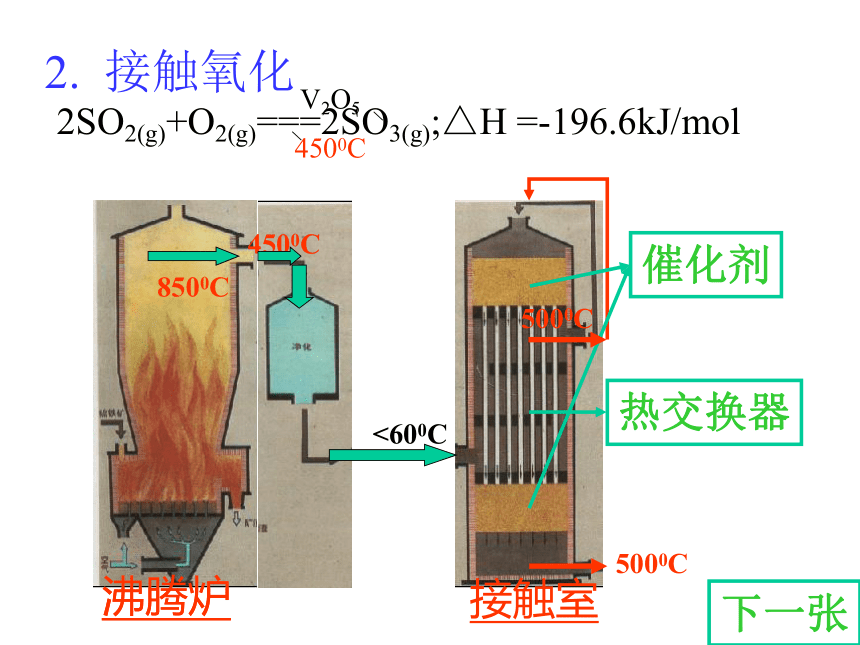
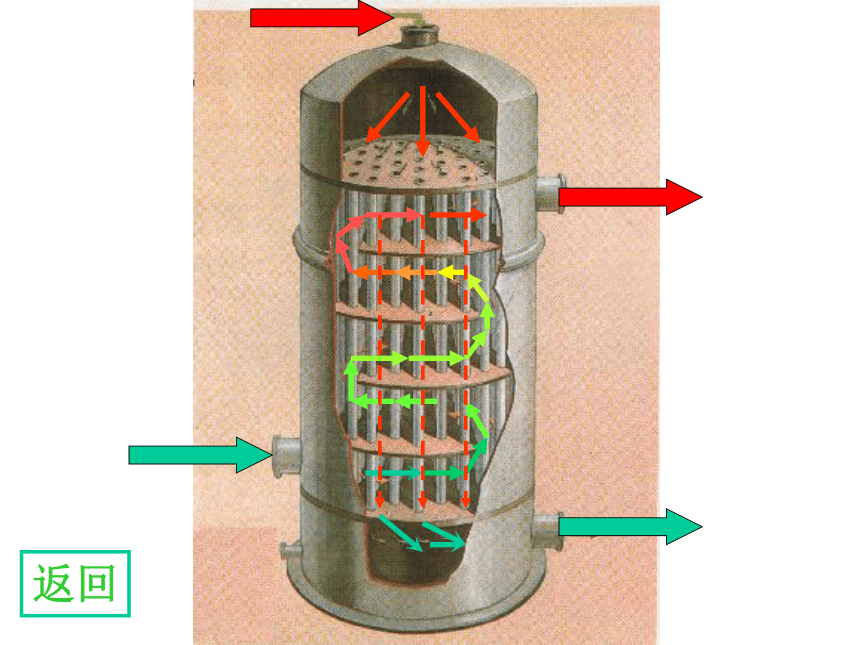
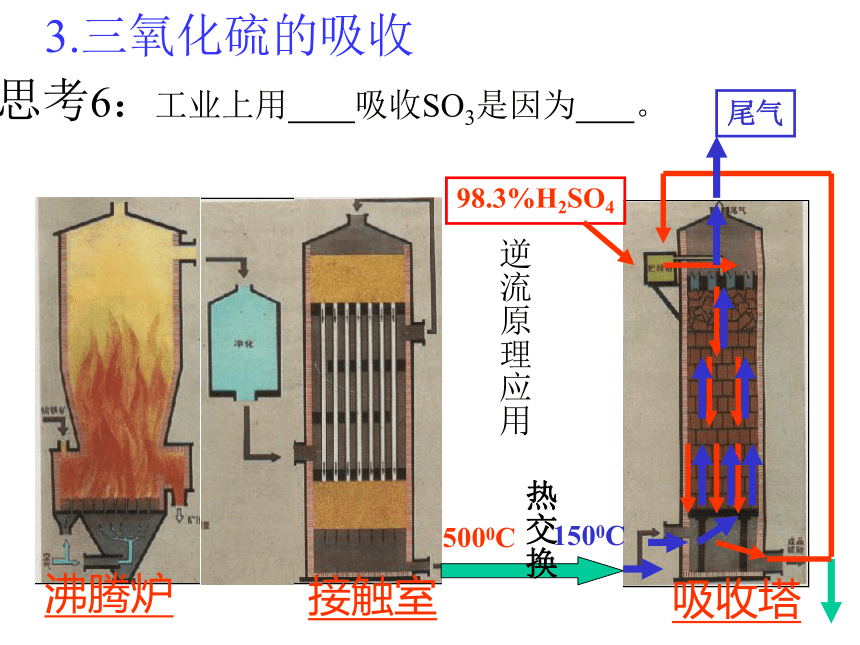
如 FeS2SO3 + H2O===H2SO4思考1:考虑原料和成本等因素,你认为工业合成硫酸的途径如何?写出化学方程式。二、接触法制造硫酸的生产过程 1 造气 2接触氧化 3 三氧化硫的吸收思考2:接触法制硫酸的三个阶段和三设备? 沸腾炉炉气1. 造气SO2、O2、N2、水蒸气以及一些杂质,如As、Se等的化合物和矿尘等等。原料粉碎氧气思考3:如何提高原料利用率和处理炉气? 2. 接触氧化沸腾炉接触室沸腾炉<600C5000C4500C8500C5000C热交换器催化剂下一张返回3.三氧化硫的吸收吸收塔热交换 5000C1500C思考6:工业上用 吸收SO3是因为 。逆流原理应用4.尾气处理尾气的组成:SO2,O2,N2(1)碱法: Na2CO3
Na2CO3+SO2===Na2SO3+CO2(2)氨水法: NH3·H2O
2NH3·H2O+SO2===(NH4)2SO3+H2O工业上用 吸收SO3,是因为 。 思考7:为什么尾气未经处理不准直接排入大气?三、环境保护环境污染:大气污染、水污染、 土壤污染、食品污染、固体废 弃物、放射性污染、噪声污染 等。工业上的三废:废水、废渣、废气请保护我们的环境1.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(如右图),图中在a、b、c处流入或流出的气体正确的是( ) A.a处SO2、N2 B.b处SO2、O2、N2 C.a处SO3、O2 D.c处SO3、N2 B2.在氧气中灼烧0.8g由硫、铁元素组成的化合物,使其中的硫经过一系列变化最终全部转化为硫酸,用20 mL 1 mol·L-1的烧碱溶液恰好能完全中和这些硫酸,则原混合物中硫的质量分数约为( )。
A40% B46% C53.3% D80 %
3.含FeS2 80%的硫铁矿,煅烧时损失硫5%,SO2氧化成SO3时利用率为98%,问生产1 t 98%的硫酸,需要这种硫铁矿多少t?A0.806 t 4.工业上测量SO2、N2、
O2混合气体中SO2含量的
装置如图。反应管中装有
碘的淀粉溶液。SO2和I2
发生的反应为N2、O2不与I2反应):SO2+I2+2H2O=H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于__的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气。则测得的SO2含量_(选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用___代替
(4)若碘溶液体积为VamL,浓度为c mol·L-1,N2与O2的体积为VbmL(已折算成标准状况下的体积)。用Va、c mol·L-1、Vb表示SO2的体积百分含量为:。
硫酸的工业制法接触法:3个原理、3个阶段、3个设备、3次净化、三废成合拟模酸硫
硫酸的工业制法---接触法一、接触法制造硫酸的反应原理H2SO4SO3SO2S硫化物
如 FeS2SO3 + H2O===H2SO4思考1:考虑原料和成本等因素,你认为工业合成硫酸的途径如何?写出化学方程式。二、接触法制造硫酸的生产过程 1 造气 2接触氧化 3 三氧化硫的吸收思考2:接触法制硫酸的三个阶段和三设备? 沸腾炉炉气1. 造气SO2、O2、N2、水蒸气以及一些杂质,如As、Se等的化合物和矿尘等等。原料粉碎氧气思考3:如何提高原料利用率和处理炉气? 2. 接触氧化沸腾炉接触室沸腾炉<600C5000C4500C8500C5000C热交换器催化剂下一张返回3.三氧化硫的吸收吸收塔热交换 5000C1500C思考6:工业上用 吸收SO3是因为 。逆流原理应用4.尾气处理尾气的组成:SO2,O2,N2(1)碱法: Na2CO3
Na2CO3+SO2===Na2SO3+CO2(2)氨水法: NH3·H2O
2NH3·H2O+SO2===(NH4)2SO3+H2O工业上用 吸收SO3,是因为 。 思考7:为什么尾气未经处理不准直接排入大气?三、环境保护环境污染:大气污染、水污染、 土壤污染、食品污染、固体废 弃物、放射性污染、噪声污染 等。工业上的三废:废水、废渣、废气请保护我们的环境1.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(如右图),图中在a、b、c处流入或流出的气体正确的是( ) A.a处SO2、N2 B.b处SO2、O2、N2 C.a处SO3、O2 D.c处SO3、N2 B2.在氧气中灼烧0.8g由硫、铁元素组成的化合物,使其中的硫经过一系列变化最终全部转化为硫酸,用20 mL 1 mol·L-1的烧碱溶液恰好能完全中和这些硫酸,则原混合物中硫的质量分数约为( )。
A40% B46% C53.3% D80 %
3.含FeS2 80%的硫铁矿,煅烧时损失硫5%,SO2氧化成SO3时利用率为98%,问生产1 t 98%的硫酸,需要这种硫铁矿多少t?A0.806 t 4.工业上测量SO2、N2、
O2混合气体中SO2含量的
装置如图。反应管中装有
碘的淀粉溶液。SO2和I2
发生的反应为N2、O2不与I2反应):SO2+I2+2H2O=H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于__的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气。则测得的SO2含量_(选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用___代替
(4)若碘溶液体积为VamL,浓度为c mol·L-1,N2与O2的体积为VbmL(已折算成标准状况下的体积)。用Va、c mol·L-1、Vb表示SO2的体积百分含量为:。
硫酸的工业制法接触法:3个原理、3个阶段、3个设备、3次净化、三废成合拟模酸硫
