二氧化硫的性质和作用
图片预览

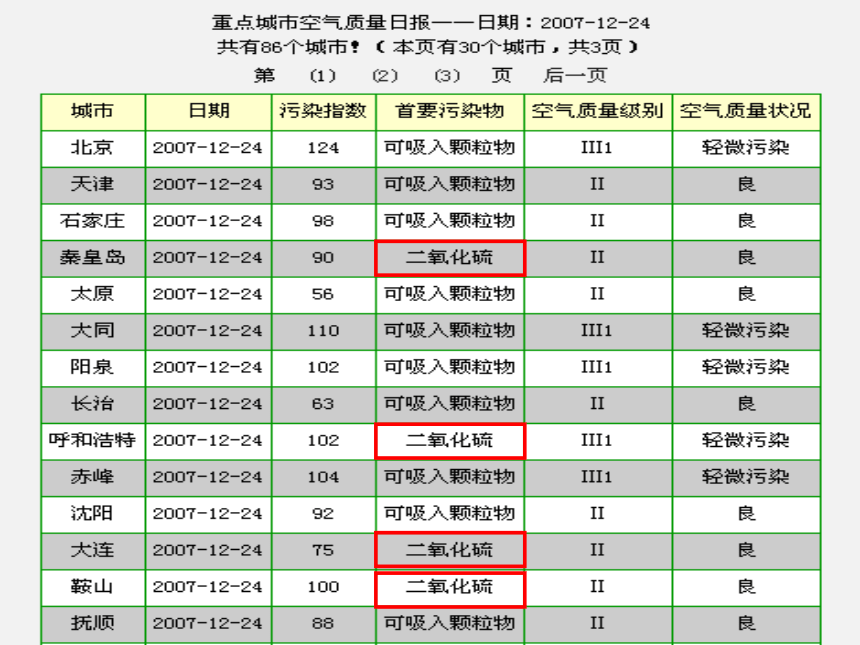







文档简介
课件24张PPT。第一单元 含硫化合物的性质和应用二氧化硫的性质和作用专题4 硫、氮和可持续发展 1.为什么人们谈论酸雨时常常将其与 二氧化硫联系在—起?
2.空气中的二氧化硫主要有哪些来源?
3 .你还知道哪些地方或哪些物质中含硫或硫的化合物? 火山温泉、硫磺香皂、黑火药、硫酸……酸雨对环境的危害60年巨变一、物理性质 状态:
颜色:
气味:
毒性:
密度:
溶解度: 气体无色刺激性有毒比空气大易溶于水,常温、常压下,1体积水溶解40体积SO2探究1:SO2是属于什么氧化物?1、酸性氧化物具有酸性氧化物的通性:表现在与碱、碱性氧化物、部分盐及酸碱指示剂等的反应中探究2:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?发生化学反应的判断依据是什么? SO2+H2O H2SO3(亚硫酸)实验探究3:
向试管中加入品红溶液,通入SO2气体,振荡,观察颜色变化;
然后加热试管,对比加热前后溶液颜色变化.次氯酸和二氧化硫漂白性的比较 氯水中HClO将有色物质氧化成无色物质氧化还原反应永久性可漂白大多数有色物质,能使紫色石蕊试液褪色SO2与某些有色物质结合生成不稳定的无色物质非氧化还原反应暂时性漂白某些有色物质,
能使紫色石蕊试液褪色不 漂白剂的种类吸附性漂白:活性炭;
2. 氧化性漂白:HClO、H2O2、Na2O2、O3等;
3. 非氧化性漂白:SO2特点:化合反应,可逆,漂白不稳定。特点:物理变化特点:氧化还原反应,不可逆,漂白稳定。 实验探究4:
向试管中加入碘水溶液,通入SO2气体,观察颜色变化;
SO2 + I2 + 2H2O = H2SO4 + 2HISO2 + Br2 + 2H2O = H2SO4 + 2HBrSO2 + Cl2 + 2H2O = H2SO4 + 2HCl实验探究5:
向试管中加入酸性高锰酸钾溶液,通入SO2气体,观察颜色变化;
[实验探究6](教材88页实验3)向另一支试管中加入5mL二氧化硫水溶液,滴加氯化钡溶液,再滴加0.5mL 3%的过氧化氢溶液,振荡,放置片刻后滴加稀盐酸,观察实验现象。现象:加BaCl2溶液无明显现象,加H2O2溶液生成白色沉淀,加盐酸沉淀不溶解。H2SO3 + H2O2 = H2SO4 + H2O
H2SO4 + BaCl2 = BaSO4↓+2HCl结论:
SO2( H2SO3)具有较强还原性,能被氧化剂(如H2O2、KMnO4、O2、Cl2、Br2、 I2 )氧化。(注意:会使酸性KMnO4、溴水、碘水等退色不是因为二氧化硫具有漂白性,而是因为其具有较强的还原性。)
3、弱氧化性SO2 + 2H2S = 3S↓ + 2H2O你能解释酸雨是怎样形成的吗?二、酸雨的形成、危害与防治SO2 ?SO3 ?H2SO4O2+2H2SO3=2H2SO4SO3+H2O=H2SO41.对人体健康造成直接危害4.破坏建筑物3.使土壤酸性增强、湖泊酸化,生态环境受损2.破坏森林、草原和农作物酸雨的危害开发新型洁净能源(氢能)含硫燃料脱硫回收利用SO2废气提高环保意识,加强国际合作酸雨的防治氨水法石灰石-石膏法SO2+CaO = CaSO3 △2CaSO3 +O2= 2 CaSO4 △CaCO3 = CO2↑+CaO△so2是产生酸雨的主要原因。那么,so2是不是有百害而无一利呢?换个角度看问题:2.食品和干果防腐剂3.漂白剂1.制造硫酸现象?原因?下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能 B D巩固练习: 一个城市的环保部门采集了一份雨水样品,每隔一段时间测定一次pH,其结果如下:
1.请你写出酸雨开始呈酸性的化学方程式.
2.这种雨水的pH值逐渐减小,其原因何在 ?
(提示:从硫元素的化合价和酸性强弱方面考虑,参考P89图4-1)SO2+H2O=H2SO3 SO3+H2O=H2SO4空气中的氧气在灰尘等存在下能够逐渐将水中的H2SO3
氧化成强酸硫酸.O2+H2SO3= H2SO4巩固练习:二氧化硫能使品红溶液褪色,氯气也能使品红溶液褪色,若将它们按1 :1 比例混合通入品红溶液中,品红溶液也褪色吗?为什么?巩固练习:不会褪色。
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
2.空气中的二氧化硫主要有哪些来源?
3 .你还知道哪些地方或哪些物质中含硫或硫的化合物? 火山温泉、硫磺香皂、黑火药、硫酸……酸雨对环境的危害60年巨变一、物理性质 状态:
颜色:
气味:
毒性:
密度:
溶解度: 气体无色刺激性有毒比空气大易溶于水,常温、常压下,1体积水溶解40体积SO2探究1:SO2是属于什么氧化物?1、酸性氧化物具有酸性氧化物的通性:表现在与碱、碱性氧化物、部分盐及酸碱指示剂等的反应中探究2:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?发生化学反应的判断依据是什么? SO2+H2O H2SO3(亚硫酸)实验探究3:
向试管中加入品红溶液,通入SO2气体,振荡,观察颜色变化;
然后加热试管,对比加热前后溶液颜色变化.次氯酸和二氧化硫漂白性的比较 氯水中HClO将有色物质氧化成无色物质氧化还原反应永久性可漂白大多数有色物质,能使紫色石蕊试液褪色SO2与某些有色物质结合生成不稳定的无色物质非氧化还原反应暂时性漂白某些有色物质,
能使紫色石蕊试液褪色不 漂白剂的种类吸附性漂白:活性炭;
2. 氧化性漂白:HClO、H2O2、Na2O2、O3等;
3. 非氧化性漂白:SO2特点:化合反应,可逆,漂白不稳定。特点:物理变化特点:氧化还原反应,不可逆,漂白稳定。 实验探究4:
向试管中加入碘水溶液,通入SO2气体,观察颜色变化;
SO2 + I2 + 2H2O = H2SO4 + 2HISO2 + Br2 + 2H2O = H2SO4 + 2HBrSO2 + Cl2 + 2H2O = H2SO4 + 2HCl实验探究5:
向试管中加入酸性高锰酸钾溶液,通入SO2气体,观察颜色变化;
[实验探究6](教材88页实验3)向另一支试管中加入5mL二氧化硫水溶液,滴加氯化钡溶液,再滴加0.5mL 3%的过氧化氢溶液,振荡,放置片刻后滴加稀盐酸,观察实验现象。现象:加BaCl2溶液无明显现象,加H2O2溶液生成白色沉淀,加盐酸沉淀不溶解。H2SO3 + H2O2 = H2SO4 + H2O
H2SO4 + BaCl2 = BaSO4↓+2HCl结论:
SO2( H2SO3)具有较强还原性,能被氧化剂(如H2O2、KMnO4、O2、Cl2、Br2、 I2 )氧化。(注意:会使酸性KMnO4、溴水、碘水等退色不是因为二氧化硫具有漂白性,而是因为其具有较强的还原性。)
3、弱氧化性SO2 + 2H2S = 3S↓ + 2H2O你能解释酸雨是怎样形成的吗?二、酸雨的形成、危害与防治SO2 ?SO3 ?H2SO4O2+2H2SO3=2H2SO4SO3+H2O=H2SO41.对人体健康造成直接危害4.破坏建筑物3.使土壤酸性增强、湖泊酸化,生态环境受损2.破坏森林、草原和农作物酸雨的危害开发新型洁净能源(氢能)含硫燃料脱硫回收利用SO2废气提高环保意识,加强国际合作酸雨的防治氨水法石灰石-石膏法SO2+CaO = CaSO3 △2CaSO3 +O2= 2 CaSO4 △CaCO3 = CO2↑+CaO△so2是产生酸雨的主要原因。那么,so2是不是有百害而无一利呢?换个角度看问题:2.食品和干果防腐剂3.漂白剂1.制造硫酸现象?原因?下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能 B D巩固练习: 一个城市的环保部门采集了一份雨水样品,每隔一段时间测定一次pH,其结果如下:
1.请你写出酸雨开始呈酸性的化学方程式.
2.这种雨水的pH值逐渐减小,其原因何在 ?
(提示:从硫元素的化合价和酸性强弱方面考虑,参考P89图4-1)SO2+H2O=H2SO3 SO3+H2O=H2SO4空气中的氧气在灰尘等存在下能够逐渐将水中的H2SO3
氧化成强酸硫酸.O2+H2SO3= H2SO4巩固练习:二氧化硫能使品红溶液褪色,氯气也能使品红溶液褪色,若将它们按1 :1 比例混合通入品红溶液中,品红溶液也褪色吗?为什么?巩固练习:不会褪色。
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
