硫酸的性质与制取
图片预览




文档简介
课件18张PPT。练习:
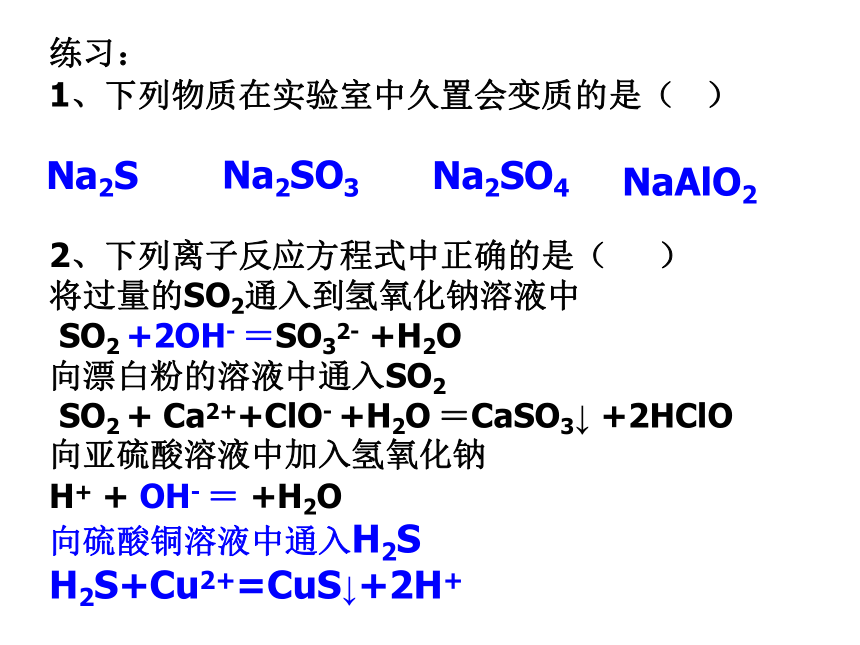
1、下列物质在实验室中久置会变质的是( )
2、下列离子反应方程式中正确的是( )
将过量的SO2通入到氢氧化钠溶液中
SO2 +2OH- =SO32- +H2O
向漂白粉的溶液中通入SO2
SO2 + Ca2++ClO- +H2O =CaSO3↓ +2HClO
向亚硫酸溶液中加入氢氧化钠
H+ + OH- = +H2O
向硫酸铜溶液中通入H2S
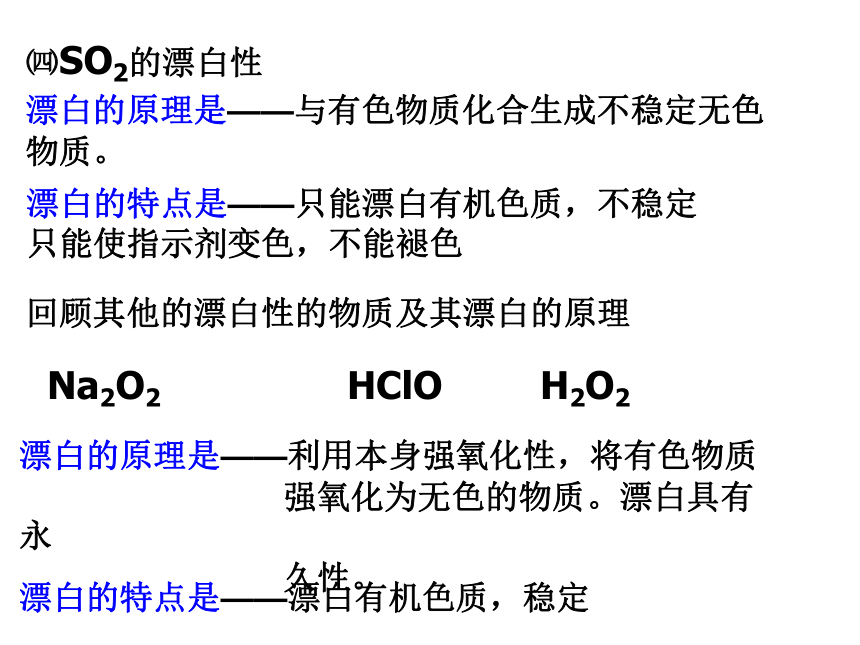
H2S+Cu2+=CuS↓+2H+Na2SNa2SO3Na2SO4NaAlO2㈣SO2的漂白性
漂白的原理是——与有色物质化合生成不稳定无色物质。 漂白的特点是——只能漂白有机色质,不稳定
只能使指示剂变色,不能褪色回顾其他的漂白性的物质及其漂白的原理漂白的原理是——利用本身强氧化性,将有色物质
强氧化为无色的物质。漂白具有永
久性。漂白的特点是——漂白有机色质,稳定探究:
氯水具有漂白性, SO2也具有漂白性,将SO2通入到氯水中,混合溶液却没有漂白性,为什么?SO2+Cl2+2H2O = 2HCl +H2SO4 课本88页问题:实验室如何制取CO2?Na2SO3 +H2SO4问题:实验室是制取SO2是选择Na2SO3固体还是溶
液?为什么?
实验室是制取SO2是选择浓硫酸还是稀硫酸,或是一定
浓度的硫酸?为什么?
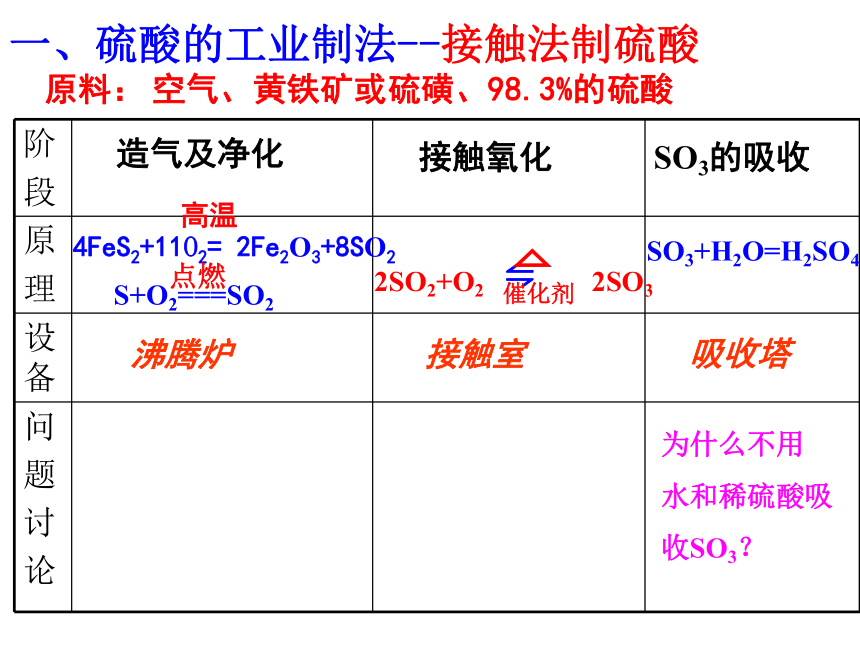
实验室是制取SO2能否用启普发生器?为什么?三、实验室如何制取SO2四、SO2的危害1.硫酸型酸雨的形成SO3+H2O= H2SO42H2SO3+O2= 2H2SO42、SO2+H2O H2SO32.硫酸型酸雨的危害P893.硫酸型酸雨的防治P90硫酸的性质与制取一、硫酸的工业制法--接触法制硫酸造气及净化沸腾炉接触氧化接触室SO3的吸收SO3+H2O=H2SO4 吸收塔为什么不用
水和稀硫酸吸
收SO3?原料:空气、黄铁矿或硫磺、98.3%的硫酸二、硫酸的性质A、稀硫酸的化学通性(1)与指示剂作用
(2)与碱反应
(3)与碱性氧化物反应
(4)与金属反应(氢前)
(5)与某些盐反应B、浓硫酸一) 物理性质:1)色味态:
2)密度:
3)溶解性:
4)沸点:无色、无味、粘稠的油状液体大与水任意比互溶。高,难挥发注:一高:
三大:沸点密度、溶解度、稀释热思考:浓硫酸的稀释?二)浓硫酸的特性1.吸水性实验:在试管中放入少量胆矾,再加入少量浓硫酸现象:由蓝色晶体变为白色粉末应用:作气体干燥剂(氯气、氢气、二氧化碳等)注:浓H2SO4 不可干燥 NH3、 H2S 、 HBr、 HI等CuSO4·5H2O + H2SO4(浓)= CuSO4 + H2SO4·5H2O2.脱水性区分:1)吸水性2)脱水性----吸收现成的水----反应生成水3.强氧化性(1)与非金属思考?如何验证产物?
滴到蓝色石蕊试纸上,现象?滴到皮肤上,如何处理? (2)与金属①常温:与铁、铝钝化
②加热:几乎与所有金属反应(金、铂除外)[实验] 在试管中放入一块铜片,加热。将生成的气体通入到品红溶液,然后加热品红溶液,把试管中反应后的溶液倒在水中稀释。现象:1)生成气体、品红溶液褪色,加热,红色复现2)试管中溶液稀释后呈蓝色反应:表现氧化性酸性1. H2SO4(浓)+ 2HBr = Br2+SO2↑+2H2O
H2SO4(浓)+ 2HI= I2+SO2↑+2H2O
2. H2SO4(浓)+ H2S = S↓+SO2 ↑ +2H2O(3)与低价化合物的反应注意:浓硫酸与金属反应时,产生的是相应的硫酸盐(高价)、二氧化硫和水;与非金属反应时,产物是该非金属的最高价氧化物(或酸)、二氧化硫、和水。4)难挥发性:用于制挥发性强酸(盐酸、硝酸)三、几种重要的硫酸盐1、硫酸钙:石膏(或生石膏)---CaSO4·2H2O
熟石膏---2CaSO4·H2O 2、硫酸钡:俗称“重晶石”、“钡餐”、
白色颜料······3、硫酸亚铁:FeSO4·7H2O 俗称“绿矾”随堂训练一.将下列现象中硫酸表现出来的性质写在空白处 吸水性 吸水性脱水性酸性 强氧化性练习:1、50ml、18mol/L硫酸溶液中,加入足量的铜片并加热,被还原的硫酸的物质的量
A、等于0.9mol B、大于0.45mol小于0.9mol
C、等于0.45mol D、小于0.45mol
2、试列举鉴别浓硫酸和稀硫酸的方法。
3、设计一个实验检验木炭与浓硫酸在加热条件下反应所生成的全部产物。现象:4)生成刺激性气味的气体。反应:结论:体现出浓硫酸的脱水性和氧化性2H2SO4 (浓) + C = CO2↑ + 2SO2↑ + 2H2O△1)蔗糖变黑2)体积膨胀3)放出大量热在烧杯中放入少量蔗糖,用少量水调成糊状,注入浓硫酸,用玻棒搅拌。
1、下列物质在实验室中久置会变质的是( )
2、下列离子反应方程式中正确的是( )
将过量的SO2通入到氢氧化钠溶液中
SO2 +2OH- =SO32- +H2O
向漂白粉的溶液中通入SO2
SO2 + Ca2++ClO- +H2O =CaSO3↓ +2HClO
向亚硫酸溶液中加入氢氧化钠
H+ + OH- = +H2O
向硫酸铜溶液中通入H2S
H2S+Cu2+=CuS↓+2H+Na2SNa2SO3Na2SO4NaAlO2㈣SO2的漂白性
漂白的原理是——与有色物质化合生成不稳定无色物质。 漂白的特点是——只能漂白有机色质,不稳定
只能使指示剂变色,不能褪色回顾其他的漂白性的物质及其漂白的原理漂白的原理是——利用本身强氧化性,将有色物质
强氧化为无色的物质。漂白具有永
久性。漂白的特点是——漂白有机色质,稳定探究:
氯水具有漂白性, SO2也具有漂白性,将SO2通入到氯水中,混合溶液却没有漂白性,为什么?SO2+Cl2+2H2O = 2HCl +H2SO4 课本88页问题:实验室如何制取CO2?Na2SO3 +H2SO4问题:实验室是制取SO2是选择Na2SO3固体还是溶
液?为什么?
实验室是制取SO2是选择浓硫酸还是稀硫酸,或是一定
浓度的硫酸?为什么?
实验室是制取SO2能否用启普发生器?为什么?三、实验室如何制取SO2四、SO2的危害1.硫酸型酸雨的形成SO3+H2O= H2SO42H2SO3+O2= 2H2SO42、SO2+H2O H2SO32.硫酸型酸雨的危害P893.硫酸型酸雨的防治P90硫酸的性质与制取一、硫酸的工业制法--接触法制硫酸造气及净化沸腾炉接触氧化接触室SO3的吸收SO3+H2O=H2SO4 吸收塔为什么不用
水和稀硫酸吸
收SO3?原料:空气、黄铁矿或硫磺、98.3%的硫酸二、硫酸的性质A、稀硫酸的化学通性(1)与指示剂作用
(2)与碱反应
(3)与碱性氧化物反应
(4)与金属反应(氢前)
(5)与某些盐反应B、浓硫酸一) 物理性质:1)色味态:
2)密度:
3)溶解性:
4)沸点:无色、无味、粘稠的油状液体大与水任意比互溶。高,难挥发注:一高:
三大:沸点密度、溶解度、稀释热思考:浓硫酸的稀释?二)浓硫酸的特性1.吸水性实验:在试管中放入少量胆矾,再加入少量浓硫酸现象:由蓝色晶体变为白色粉末应用:作气体干燥剂(氯气、氢气、二氧化碳等)注:浓H2SO4 不可干燥 NH3、 H2S 、 HBr、 HI等CuSO4·5H2O + H2SO4(浓)= CuSO4 + H2SO4·5H2O2.脱水性区分:1)吸水性2)脱水性----吸收现成的水----反应生成水3.强氧化性(1)与非金属思考?如何验证产物?
滴到蓝色石蕊试纸上,现象?滴到皮肤上,如何处理? (2)与金属①常温:与铁、铝钝化
②加热:几乎与所有金属反应(金、铂除外)[实验] 在试管中放入一块铜片,加热。将生成的气体通入到品红溶液,然后加热品红溶液,把试管中反应后的溶液倒在水中稀释。现象:1)生成气体、品红溶液褪色,加热,红色复现2)试管中溶液稀释后呈蓝色反应:表现氧化性酸性1. H2SO4(浓)+ 2HBr = Br2+SO2↑+2H2O
H2SO4(浓)+ 2HI= I2+SO2↑+2H2O
2. H2SO4(浓)+ H2S = S↓+SO2 ↑ +2H2O(3)与低价化合物的反应注意:浓硫酸与金属反应时,产生的是相应的硫酸盐(高价)、二氧化硫和水;与非金属反应时,产物是该非金属的最高价氧化物(或酸)、二氧化硫、和水。4)难挥发性:用于制挥发性强酸(盐酸、硝酸)三、几种重要的硫酸盐1、硫酸钙:石膏(或生石膏)---CaSO4·2H2O
熟石膏---2CaSO4·H2O 2、硫酸钡:俗称“重晶石”、“钡餐”、
白色颜料······3、硫酸亚铁:FeSO4·7H2O 俗称“绿矾”随堂训练一.将下列现象中硫酸表现出来的性质写在空白处 吸水性 吸水性脱水性酸性 强氧化性练习:1、50ml、18mol/L硫酸溶液中,加入足量的铜片并加热,被还原的硫酸的物质的量
A、等于0.9mol B、大于0.45mol小于0.9mol
C、等于0.45mol D、小于0.45mol
2、试列举鉴别浓硫酸和稀硫酸的方法。
3、设计一个实验检验木炭与浓硫酸在加热条件下反应所生成的全部产物。现象:4)生成刺激性气味的气体。反应:结论:体现出浓硫酸的脱水性和氧化性2H2SO4 (浓) + C = CO2↑ + 2SO2↑ + 2H2O△1)蔗糖变黑2)体积膨胀3)放出大量热在烧杯中放入少量蔗糖,用少量水调成糊状,注入浓硫酸,用玻棒搅拌。
