【化学】10-11学年同步学案(人教版选修4):第四章 第一节 原电池
文档属性
| 名称 | 【化学】10-11学年同步学案(人教版选修4):第四章 第一节 原电池 |  | |
| 格式 | rar | ||
| 文件大小 | 268.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2010-12-21 17:04:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第四章 电化学基础
第一节 原电池
重难点一 原电池正负极判断的方法
1.由组成原电池的两极材料判断
较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
2.根据电流方向或电子流向判断
外电路中,电流由正极流向负极,电子由负极流向正极。
3.根据原电池电解质溶液中离子的移动方向判断
在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。
4.根据原电池中两极发生的反应判断
原电池中,负极总是发生氧化反应,正极总是发生还原反应。若给出一个总方程式,则可根据化合价升降来判断。
5.根据电极质量的变化判断
原电池工作后,某一电极质量增加,说明溶液中的阳离子在该电极上放电,该极为正极,活泼性较弱;反之,如果某一电极质量减轻,则该电极溶解,为负极,活泼性较强。
6.根据电极上有气泡产生判断
原电池工作后,如果某一电极上有气体产生,通常是因为该电极发生了析出H2的反应,说明该电极为正极,活泼性较弱。
7.根据某电极(X)附近pH的变化判断
析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,X极附近的pH增大了,说明X极为正极,金属活动性较强。
特别提醒 应用此要点,须注意:
原电池的电极类型不仅跟电极材料有关,还与电解质溶液的性质有关。如镁—铝电极在稀硫酸中构成原电池,镁为负极,铝为正极,但若以氢氧化钠为电解质溶液,则铝为负极,镁为正极。
重难点二 电极反应式的书写方法
书写电极反应式时,按照负极发生氧化反应,正极发生还原反应,首先正确判断出电极反应产物,然后结合反应物及转移电子数量写出反应式,再结合质量守恒、电荷守恒配平各电极反应式。两电极反应式相加则得总反应式。结合具体的情况,我们可以概括为以下两种情况:(1)根据两个电极反应式,写出总反应式。使两个电极反应式得失电子数相等后,将两式相加,消去相同的化学式。(2)根据总反应式,写电极反应式一般分四个步骤:①列物质,标得失,②选离子,配电荷,③配个数,巧用水,④两式加,验总式。
重难点三 原电池原理的应用
1.依据原电池原理比较金属活动性强弱
(1)电子由负极流向正极,由活泼金属流向不活泼金属,而电流方向是由正极流向负极,二者是相反的。
(2)在原电池中,活泼金属作负极,发生氧化反应;不活泼金属作正极,发生还原反应。
(3)原电池的正极通常具备特定的现象:有气体生成,或电极质量增加或不变等;负极通常不断溶解,质量减少。
2.根据原电池原理,把各种氧化还原反应设计成电池
从理论上讲,任何一个自发的氧化还原反应,都可以设计成原电池。关键是选择合适的电解质溶液和两个电极。
(1)电解质溶液的选择
电解质是使负极放电的物质。因此电解质溶液一般要能够与负极发生反应。或者电解质溶液中溶解的其他物质能与负极发生反应(如空气中的氧气)。但如果两个半反应分别在两个容器中进行(中间连接盐桥),则左右两个容器中的电解质溶液选择与电极材料相同的阳离子。如,在铜—锌—硫酸构成的原电池中,负极金属锌浸泡在含有Zn2+的电解质溶液中,而正极铜浸泡在含有Cu2+的溶液中。
(2)电极材料的选择
在原电池中,选择还原性较强的物质作为负极;氧化性较强的物质作为正极。并且,原电池的电极必须导电。电池中的负极必须能够与电解质溶液反应,容易失去电子,因此负极一般是活泼的金属材料(也可以是还原性较强的非金属材料如H2、CH4等)。正极和负极之间
产生的电势差是电子(阴、阳离子)移动的动力。
例1 将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
答案 C21世纪教育网
解析 因乙烧杯中锌片和铜片没有接触,故不能构成原电池,A、B皆错;因甲烧杯中Zn、Cu用导线连接后构成原电池,加快了Zn的溶解,故D错;又因两烧杯中的Zn都能与稀H2SO4反应产生H2而消耗H+,故C正确。
①原电池设计前后并不改变反应进行的方向,甲、乙的总反应相同。②原电池反应将氧化还原反应分成两部分进行,反应速率加快,且将化学能转变为电能。
例2
关于如图所示装置的叙述,正确的是( )
A.铜是负极,铜片上有气泡产生 B.铜片质量逐渐减少[21世纪教育网
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
答案 D
解析 本题主要考查有关原电池的知识。由所给图示可知Zn为原电池负极,失去电子被氧化,电子经导线流向正极铜电极,溶液中的氢离子在正极得到电子而被还原为H2。原电池只分正极、负极,不用阴极、阳极表示,电流与电子流的方向相反。
在判断电流方向时,易与电子流向混淆。在外电路,电流从正极流向负极,而电子流向则与电流方向相反。
例3 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
答案 B
解析 应用原电池原理比较金属活泼性时,注意电子流向、电流方向、正负极、氧化反应、还原反应与活泼性的关系。根据原电池原理,作为负极的金属活动性比正极金属的活动性强。电子流动方向是由负极流向正极,电流方向与电子流动方向相反,因此可依次作出如下判断:活动性:①a>b;②c>d;③a>c;④d>b。综合得结论:金属活动性a>c>d>b,故应选B。
例4 利用反应Zn+2FeCl3===ZnCl2+2FeCl2设计一个原电池。在方格内画出实验装置图,并指出正极为E,电极反应式为
________________________________________________________________________;
负极为________,电极反应式为
________________________________________________________________________。
答案 装置如图
Pt(或其它合理答案) 2Fe3++2e-===2Fe2+ Zn Zn-2e-===Zn2+
解析 本题的创新之处在于将原电池的原理进行逆向思维,以培养同学们的逆向思维能力。其思路为:首先将已知的反应拆成两个半反应(即失电子和得电子的反应):Zn-2e-===Zn2+,2Fe3++2e-===2Fe2+;然后结合原电池的工作原理分析可知,该电极的负极应用锌作材料,正极要保证Fe3+得到负极失去的电子,一般可用不能还原Fe3+的材料(如铂、碳棒等)作正极,电解质溶液只能用FeCl3溶液。
将氧化反应及还原反应通过原电池两极反应进行放大,不仅便于理解和巩固氧化还原反应中的一些概念,而且可通过电子的定向移动更直观、更深入理解电子守恒或化合价升高或
降低数目相等等理论,该处是物理、化学的综合试题的交接点,应引起重视。
1.由化学能转变为电能的装置 氧化反应 负 还原反应 正
2.铜 Cu-2e-===Cu2+ 银 2Ag++2e-===2Ag
3.a>c>d>b
4.B 5.BD
6.(1)装置图
(4)负极:Zn-2e-===Zn2+
正极:Fe2++2e-===Fe
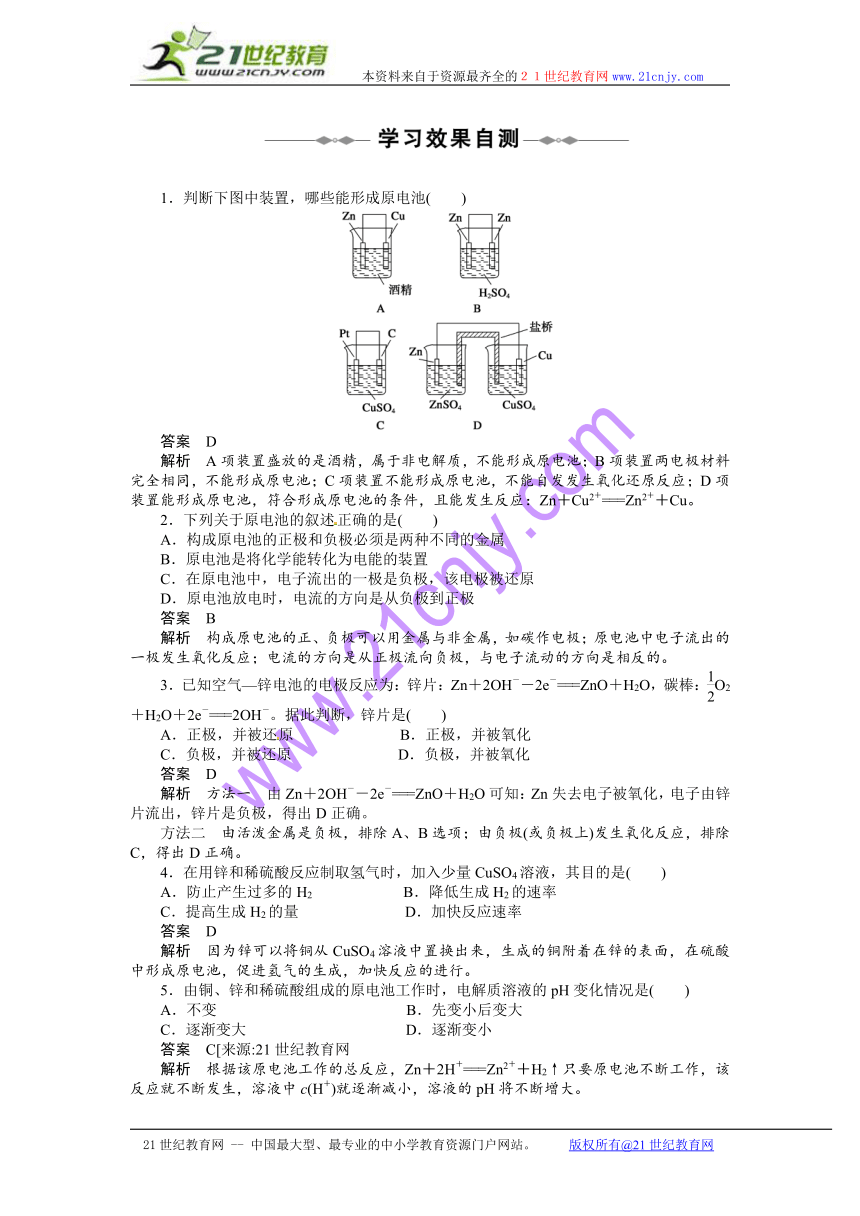
1.判断下图中装置,哪些能形成原电池( )
答案 D
解析 A项装置盛放的是酒精,属于非电解质,不能形成原电池;B项装置两电极材料完全相同,不能形成原电池;C项装置不能形成原电池,不能自发发生氧化还原反应;D项装置能形成原电池,符合形成原电池的条件,且能发生反应:Zn+Cu2+===Zn2++Cu。
2.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
答案 B
解析 构成原电池的正、负极可以用金属与非金属,如碳作电极;原电池中电子流出的一极发生氧化反应;电流的方向是从正极流向负极,与电子流动的方向是相反的。
3.已知空气—锌电池的电极反应为:锌片:Zn+2OH--2e-===ZnO+H2O,碳棒:O2+H2O+2e-===2OH-。据此判断,锌片是( )
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
答案 D
解析 方法一 由Zn+2OH--2e-===ZnO+H2O可知:Zn失去电子被氧化,电子由锌片流出,锌片是负极,得出D正确。
方法二 由活泼金属是负极,排除A、B选项;由负极(或负极上)发生氧化反应,排除C,得出D正确。
4.在用锌和稀硫酸反应制取氢气时,加入少量CuSO4溶液,其目的是( )
A.防止产生过多的H2 B.降低生成H2的速率
C.提高生成H2的量 D.加快反应速率
答案 D
解析 因为锌可以将铜从CuSO4溶液中置换出来,生成的铜附着在锌的表面,在硫酸中形成原电池,促进氢气的生成,加快反应的进行。
5.由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH变化情况是( )
A.不变 B.先变小后变大
C.逐渐变大 D.逐渐变小
答案 C[来源:21世纪教育网
解析 根据该原电池工作的总反应,Zn+2H+===Zn2++H2↑只要原电池不断工作,该反应就不断发生,溶液中c(H+)就逐渐减小,溶液的pH将不断增大。
6.
如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地向烧杯中央滴入CuSO4溶液。21世纪教育网
(1)片刻后可观察到的现象是(指悬吊的金属圈)( )
A.铁圈和银圈左右摇摆不定
B.铁圈和银圈仍保持平衡状态不变
C.铁圈向下倾斜,银圈向上倾斜
D.银圈向下倾斜,铁圈向上倾斜
(2)产生上述现象的原因是什么?
________________________________________________________________________
________________________________________________________________________。
答案 (1)D
(2)铁圈和银圈构成原电池,其中铁圈做负极,发生反应:Fe-2e-===Fe2+,使铁圈质量减小;银圈做正极,发生反应:Cu2++2e-===Cu,生成的铜附着在银圈上,使银圈质量增加
7.(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:
________________________________________________________________________;
银片上发生的电极反应:
________________________________________________________________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023 mol-1,电子电量为1.60×10-19C)
答案 (1)Zn-2e-===Zn2+ 2H++2e-===H2↑
(2)①4.5 L ②3.8×104 C
解析 (1)锌片、银片与稀硫酸构成原电池
锌片为负极,发生氧化反应:Zn-2e-===Zn2+
银片为正极,发生还原反应:2H++2e-===H2↑
(2)①锌片与银片减少的质量等于生成氢气所消耗的锌的质量,设产生的氢气体积为x。
Zn+2H+===Zn2++H2↑
65 g 22.4 L
60 g-47 g=13 g x
x=13 g×22.4 L÷65 g=4.5 L
②反应消耗的锌为:13 g÷65 g·mol-1=0.20 mol
1 mol Zn变为Zn2+时,转移2 mol e-,则通过的电量为:0.20 mol×2×6.02×1023 mol-1×1.6×10-19 C=3.8×104C。
1.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
答案 D
解析 由锌片、铜片、稀H2SO4构成原电池,锌片为负极,Zn-2e-===Zn2+;铜片为正极:2H++2e-===H2↑,SO、OH-等阴离子向负极移动,外电路上,电子通过导线由锌片流向铜片。[来源:21世纪教育网
2.某原电池总反应的离子方程式为:2Fe3++Fe===3Fe2+,不能实现该反应的原电池是( )21世纪教育网
A.正极为Cu,负极为Fe,电解质为FeCl3溶液
B.正极为C,负极为Fe,电解质为Fe(NO3)3溶液
C.正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质为CuSO4溶液
答案 CD
解析 由2Fe3++Fe===3Fe2+得出负极反应式为:
Fe-2e-===Fe2+,正极反应式为:2Fe3++2e-===2Fe2+,可知负极材料为铁,正极材料为比铁不活泼的导体,电解质溶液中必须有Fe3+,答案为CD。[来源:21世纪教育网
点拨 设计原电池,第一要确定化学反应是能自发进行的氧化还原反应;第二是将氧化还原反应拆分为氧化反应和还原反应两个半反应(电极反应式);第三是根据原电池构成的条件确定原电池的正、负极材料和电解质溶液。
3.以锌片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2 mol电子时,下列说法正确的是( )21世纪教育网
A.锌片溶解了1 mol,铜片上析出1 mol H2
B.两极上溶解和析出的物质质量相等
C.锌片溶解31 g,铜片上析出1 g H2
D.锌片溶解了1 mol,硫酸消耗1 mol
答案 AD
解析 在涉及原电池的有关计算中,关键是要把握住一点即两极得、失电子数相等。利用这一特点,我们从电极反应看:负极:Zn-2e-===Zn2+;正极:2H++2e-===H2↑。当溶解1 mol锌失去2 mol电子,铜片上析出1 mol氢气也得到2 mol电子,得失电子守恒,这样即可推出A、D为正确选项。
规律 电化学的有关计算都要遵循电子守恒。
1.有关原电池的下列说法中正确的是( )
A.在外电路中电子由正极流向负极
B.在原电池中,只有金属锌作为负极
C.原电池工作时,阳离子向正极方向移动
D.原电池工作时,阳离子向负极方向移动
答案 C
解析 在原电池中,电子从负极流向正极;原电池中活泼的金属作负极,而不一定是Zn;随着反应的进行,阳离子在正极被还原,所以电解质溶液中的阳离子向正极移动,而阴离子向负极移动。答案为C。
2.根据原电池的有关知识,下列反应不能用于原电池的是( )
A.2H2+O22H2O
B.2CH3OH+3O22CO2+4H2O
C.Zn+2HCl===ZnCl2+H2↑
D.NaOH+HCl===NaCl+H2O
答案 D
解析 原电池反应必须是一个放热的氧化还原反应,两个因素缺一不可,四个选项均为放热反应,但选项D是非氧化还原反应,故它不可以用于原电池反应。
3.银锌电池广泛用作各种电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O===2Ag+Zn(OH)2,则负极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
答案 D
解析 判断原电池的正、负极,要根据总反应式确定失电子物质和得电子物质,然后根据在原电池中失去电子的物质作负极作出判断。由题给总方程式得:Zn+2OH--2e-===Zn(OH)2,故Zn为负极。
4.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在CuSO4溶液中,铜片质量增加
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
答案 C
解析 铜片和铁片紧靠并浸入稀H2SO4中,铜片上的H+获得由铁片传递过来的电子2H++2e-===H2↑,所以可观察到铜片表面出现气泡;锌片作负极,铜片作正极,发生反应Zn+Cu2+===Zn2++Cu,生成的Cu在铜片上析出使其质量增加;铜片插入FeCl3溶液,发生的反应是Cu+2Fe3+===Cu2++2Fe2+,并没有单质铁的析出;向盛有锌粒和盐酸的试管中,滴入几滴CuCl2溶液,发生反应Zn+Cu2+===Zn2++Cu,置换出的Cu与剩余的Zn接触,置于盐酸中,构成了原电池,加速2H++2e-===H2↑反应,可观察到气泡放出速率加快。
5.如图所示,烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )
答案 A
6.在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
A.碳棒上有气体放出,溶液pH变大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极到b极
D.a极上发生了氧化反应
答案 B
解析 本题考查原电池基本知识,难度不大,但概念容易混淆。没有扎实的基础知识容易搞错,显然,电极a、b与电解质溶液稀H2SO4组成原电池。因活泼性a>b(碳棒),所以a为电池的负极,b为正极。电极反应式:
a(负)极:a-ne-===an+(氧化反应)
b(正)极:nH++ne-===H2(还原反应)
由于正极放电消耗H+,溶液中c(H+)减小,pH增大,在外电路中,电子由a极流出经电流计A流向b极。
7.根据下列实验事实:①X+Y2+===X2++Y ②Z+2H2OZ(OH)2+H2↑ ③Z2+的氧化性比X2+弱 ④由Y、W作电极组成的原电池反应为:Y-2e-=Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是( )
A.X>Y>Z>W B.Y>X>W>Z C.Z>X>Y>W D.Z>Y>X>W
答案 C
解析 依据氧化还原反应的规律,由①可知X的还原性大于Y;Z可与冷水反应,因而还原性最强;Z2+的氧化性比X2+弱,其对应的金属Z的还原性大于X;④中Y、W作电极组成的原电池Y作负极,可知Y的还原性大于W。由此可知,X、Y、Z、W的还原性由强到弱的顺序是:Z>X>Y>W。
[来源:21世纪教育网
8.右图是一个原电池装置,请按要求填空。
(1)正极材料是____________负极材料是____________。
(2)电流的方向是:由__________经外电路流向____________。
(3)反应过程中,铁片质量____________,铜片质量____________。
(4)写出电极反应式:
负极:____________,正极____________________。
(5)该电流中发生的总反应方程式为:
________________________________________________________________________。
答案 (1)Cu Fe (2)Cu Fe (3)减小 增大
(4)Fe-2e-===Fe2+ Cu2++2e-===Cu
(5)Fe+Cu2+===Fe2++Cu
9.称取三份锌粉,分别盛于甲、乙、丙三支试管中,向甲中加入50 mL pH=3 的HCl溶液,向乙中加入50 mL pH=3 的醋酸溶液,向丙中加入50 mL pH=3 的醋酸及少量胆矾粉末,反应结束时产生的H2体积一样多,且无锌粉剩余,请用“>”、“=”或“<”填空:
(1)开始反应时速率大小关系为______________;
(2)反应过程中,乙和丙速率不同的理由是
________________________________________________________________________;
(3)反应结束时,所需时间__________;
(4)三支试管中参加反应的锌的质量为____________。
答案 (1)甲=乙=丙 (2)丙形成原电池反应速率加快 (3)甲>乙>丙 (4)甲=乙<丙
解析 Zn与酸反应的实质为:Zn+2H+===Zn2++H2↑,其反应速率取决于c(H+),反应开始时pH相同,即c(H+)相等,故反应速率相等;乙中存在平衡CH3COOH??CH3COO-+H+,反应过程中c(H+)降低稍慢,反应速率甲<乙。丙中发生反应Zn+Cu2+===Zn2++Cu,Zn与置换出的铜构成原电池;反应速率加快,且多消耗一部分Zn。
10.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下。试根据下表中的实验现象回答下列问题:
编号 电极材料 电解质溶液 电流计指针偏转方向
1 Al、Mg 稀盐酸 偏向Al
2 Al、Cu 稀盐酸 偏向Cu
3 Al、石墨 稀盐酸 偏向石墨
4 Al、Mg 氢氧化钠 偏向Mg
5 Al、Zn 浓硝酸 偏向Al
(1)实验1、2中Al所作的电极是否相同?
(2)写出实验3中的电极反应和电池反应。
(3)实验4中Al作正极还是负极?写出Al电极的电极反应。
(4)解释实验5中电流计指针偏向Al的原因。
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极,受到哪些因素的影响?[来源:21世纪教育网
答案 (1)不相同,1中作正极,2中作负极
(2)负极:2Al-6e-===2Al3+
正极:6H++6e-===3H2↑
总反应方程式:2Al+6H+===2Al3++3H2↑
(3)Al作负极
Al+4OH--3e-===AlO+2H2O
(4)常温下Al钝化,Zn能与浓HNO3反应,故Zn作原电池的负极,Al作正极。
(5)①与金属本身活泼性有关,也与另一电极金属活泼性有关;②与电解质溶液的酸碱性和酸的氧化性有关。
解析 实验1中Mg活泼,故Mg作负极;实验2中Al活泼,故Al作负极;实验3中是铝作负极,将盐酸中的氢离子置换出氢气;实验4中Mg虽比Al活泼,但Mg不能与NaOH溶液反应,而Al可与NaOH溶液反应,故Al作负极;实验5中Al虽比Zn活泼,但常温下,Al遇浓硝酸发生钝化,阻止内部的金属继续与酸反应,故Zn为负极。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第四章 电化学基础
第一节 原电池
重难点一 原电池正负极判断的方法
1.由组成原电池的两极材料判断
较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
2.根据电流方向或电子流向判断
外电路中,电流由正极流向负极,电子由负极流向正极。
3.根据原电池电解质溶液中离子的移动方向判断
在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。
4.根据原电池中两极发生的反应判断
原电池中,负极总是发生氧化反应,正极总是发生还原反应。若给出一个总方程式,则可根据化合价升降来判断。
5.根据电极质量的变化判断
原电池工作后,某一电极质量增加,说明溶液中的阳离子在该电极上放电,该极为正极,活泼性较弱;反之,如果某一电极质量减轻,则该电极溶解,为负极,活泼性较强。
6.根据电极上有气泡产生判断
原电池工作后,如果某一电极上有气体产生,通常是因为该电极发生了析出H2的反应,说明该电极为正极,活泼性较弱。
7.根据某电极(X)附近pH的变化判断
析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,X极附近的pH增大了,说明X极为正极,金属活动性较强。
特别提醒 应用此要点,须注意:
原电池的电极类型不仅跟电极材料有关,还与电解质溶液的性质有关。如镁—铝电极在稀硫酸中构成原电池,镁为负极,铝为正极,但若以氢氧化钠为电解质溶液,则铝为负极,镁为正极。
重难点二 电极反应式的书写方法
书写电极反应式时,按照负极发生氧化反应,正极发生还原反应,首先正确判断出电极反应产物,然后结合反应物及转移电子数量写出反应式,再结合质量守恒、电荷守恒配平各电极反应式。两电极反应式相加则得总反应式。结合具体的情况,我们可以概括为以下两种情况:(1)根据两个电极反应式,写出总反应式。使两个电极反应式得失电子数相等后,将两式相加,消去相同的化学式。(2)根据总反应式,写电极反应式一般分四个步骤:①列物质,标得失,②选离子,配电荷,③配个数,巧用水,④两式加,验总式。
重难点三 原电池原理的应用
1.依据原电池原理比较金属活动性强弱
(1)电子由负极流向正极,由活泼金属流向不活泼金属,而电流方向是由正极流向负极,二者是相反的。
(2)在原电池中,活泼金属作负极,发生氧化反应;不活泼金属作正极,发生还原反应。
(3)原电池的正极通常具备特定的现象:有气体生成,或电极质量增加或不变等;负极通常不断溶解,质量减少。
2.根据原电池原理,把各种氧化还原反应设计成电池
从理论上讲,任何一个自发的氧化还原反应,都可以设计成原电池。关键是选择合适的电解质溶液和两个电极。
(1)电解质溶液的选择
电解质是使负极放电的物质。因此电解质溶液一般要能够与负极发生反应。或者电解质溶液中溶解的其他物质能与负极发生反应(如空气中的氧气)。但如果两个半反应分别在两个容器中进行(中间连接盐桥),则左右两个容器中的电解质溶液选择与电极材料相同的阳离子。如,在铜—锌—硫酸构成的原电池中,负极金属锌浸泡在含有Zn2+的电解质溶液中,而正极铜浸泡在含有Cu2+的溶液中。
(2)电极材料的选择
在原电池中,选择还原性较强的物质作为负极;氧化性较强的物质作为正极。并且,原电池的电极必须导电。电池中的负极必须能够与电解质溶液反应,容易失去电子,因此负极一般是活泼的金属材料(也可以是还原性较强的非金属材料如H2、CH4等)。正极和负极之间
产生的电势差是电子(阴、阳离子)移动的动力。
例1 将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
答案 C21世纪教育网
解析 因乙烧杯中锌片和铜片没有接触,故不能构成原电池,A、B皆错;因甲烧杯中Zn、Cu用导线连接后构成原电池,加快了Zn的溶解,故D错;又因两烧杯中的Zn都能与稀H2SO4反应产生H2而消耗H+,故C正确。
①原电池设计前后并不改变反应进行的方向,甲、乙的总反应相同。②原电池反应将氧化还原反应分成两部分进行,反应速率加快,且将化学能转变为电能。
例2
关于如图所示装置的叙述,正确的是( )
A.铜是负极,铜片上有气泡产生 B.铜片质量逐渐减少[21世纪教育网
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
答案 D
解析 本题主要考查有关原电池的知识。由所给图示可知Zn为原电池负极,失去电子被氧化,电子经导线流向正极铜电极,溶液中的氢离子在正极得到电子而被还原为H2。原电池只分正极、负极,不用阴极、阳极表示,电流与电子流的方向相反。
在判断电流方向时,易与电子流向混淆。在外电路,电流从正极流向负极,而电子流向则与电流方向相反。
例3 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
答案 B
解析 应用原电池原理比较金属活泼性时,注意电子流向、电流方向、正负极、氧化反应、还原反应与活泼性的关系。根据原电池原理,作为负极的金属活动性比正极金属的活动性强。电子流动方向是由负极流向正极,电流方向与电子流动方向相反,因此可依次作出如下判断:活动性:①a>b;②c>d;③a>c;④d>b。综合得结论:金属活动性a>c>d>b,故应选B。
例4 利用反应Zn+2FeCl3===ZnCl2+2FeCl2设计一个原电池。在方格内画出实验装置图,并指出正极为E,电极反应式为
________________________________________________________________________;
负极为________,电极反应式为
________________________________________________________________________。
答案 装置如图
Pt(或其它合理答案) 2Fe3++2e-===2Fe2+ Zn Zn-2e-===Zn2+
解析 本题的创新之处在于将原电池的原理进行逆向思维,以培养同学们的逆向思维能力。其思路为:首先将已知的反应拆成两个半反应(即失电子和得电子的反应):Zn-2e-===Zn2+,2Fe3++2e-===2Fe2+;然后结合原电池的工作原理分析可知,该电极的负极应用锌作材料,正极要保证Fe3+得到负极失去的电子,一般可用不能还原Fe3+的材料(如铂、碳棒等)作正极,电解质溶液只能用FeCl3溶液。
将氧化反应及还原反应通过原电池两极反应进行放大,不仅便于理解和巩固氧化还原反应中的一些概念,而且可通过电子的定向移动更直观、更深入理解电子守恒或化合价升高或
降低数目相等等理论,该处是物理、化学的综合试题的交接点,应引起重视。
1.由化学能转变为电能的装置 氧化反应 负 还原反应 正
2.铜 Cu-2e-===Cu2+ 银 2Ag++2e-===2Ag
3.a>c>d>b
4.B 5.BD
6.(1)装置图
(4)负极:Zn-2e-===Zn2+
正极:Fe2++2e-===Fe
1.判断下图中装置,哪些能形成原电池( )
答案 D
解析 A项装置盛放的是酒精,属于非电解质,不能形成原电池;B项装置两电极材料完全相同,不能形成原电池;C项装置不能形成原电池,不能自发发生氧化还原反应;D项装置能形成原电池,符合形成原电池的条件,且能发生反应:Zn+Cu2+===Zn2++Cu。
2.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
答案 B
解析 构成原电池的正、负极可以用金属与非金属,如碳作电极;原电池中电子流出的一极发生氧化反应;电流的方向是从正极流向负极,与电子流动的方向是相反的。
3.已知空气—锌电池的电极反应为:锌片:Zn+2OH--2e-===ZnO+H2O,碳棒:O2+H2O+2e-===2OH-。据此判断,锌片是( )
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
答案 D
解析 方法一 由Zn+2OH--2e-===ZnO+H2O可知:Zn失去电子被氧化,电子由锌片流出,锌片是负极,得出D正确。
方法二 由活泼金属是负极,排除A、B选项;由负极(或负极上)发生氧化反应,排除C,得出D正确。
4.在用锌和稀硫酸反应制取氢气时,加入少量CuSO4溶液,其目的是( )
A.防止产生过多的H2 B.降低生成H2的速率
C.提高生成H2的量 D.加快反应速率
答案 D
解析 因为锌可以将铜从CuSO4溶液中置换出来,生成的铜附着在锌的表面,在硫酸中形成原电池,促进氢气的生成,加快反应的进行。
5.由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH变化情况是( )
A.不变 B.先变小后变大
C.逐渐变大 D.逐渐变小
答案 C[来源:21世纪教育网
解析 根据该原电池工作的总反应,Zn+2H+===Zn2++H2↑只要原电池不断工作,该反应就不断发生,溶液中c(H+)就逐渐减小,溶液的pH将不断增大。
6.
如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地向烧杯中央滴入CuSO4溶液。21世纪教育网
(1)片刻后可观察到的现象是(指悬吊的金属圈)( )
A.铁圈和银圈左右摇摆不定
B.铁圈和银圈仍保持平衡状态不变
C.铁圈向下倾斜,银圈向上倾斜
D.银圈向下倾斜,铁圈向上倾斜
(2)产生上述现象的原因是什么?
________________________________________________________________________
________________________________________________________________________。
答案 (1)D
(2)铁圈和银圈构成原电池,其中铁圈做负极,发生反应:Fe-2e-===Fe2+,使铁圈质量减小;银圈做正极,发生反应:Cu2++2e-===Cu,生成的铜附着在银圈上,使银圈质量增加
7.(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:
________________________________________________________________________;
银片上发生的电极反应:
________________________________________________________________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023 mol-1,电子电量为1.60×10-19C)
答案 (1)Zn-2e-===Zn2+ 2H++2e-===H2↑
(2)①4.5 L ②3.8×104 C
解析 (1)锌片、银片与稀硫酸构成原电池
锌片为负极,发生氧化反应:Zn-2e-===Zn2+
银片为正极,发生还原反应:2H++2e-===H2↑
(2)①锌片与银片减少的质量等于生成氢气所消耗的锌的质量,设产生的氢气体积为x。
Zn+2H+===Zn2++H2↑
65 g 22.4 L
60 g-47 g=13 g x
x=13 g×22.4 L÷65 g=4.5 L
②反应消耗的锌为:13 g÷65 g·mol-1=0.20 mol
1 mol Zn变为Zn2+时,转移2 mol e-,则通过的电量为:0.20 mol×2×6.02×1023 mol-1×1.6×10-19 C=3.8×104C。
1.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
答案 D
解析 由锌片、铜片、稀H2SO4构成原电池,锌片为负极,Zn-2e-===Zn2+;铜片为正极:2H++2e-===H2↑,SO、OH-等阴离子向负极移动,外电路上,电子通过导线由锌片流向铜片。[来源:21世纪教育网
2.某原电池总反应的离子方程式为:2Fe3++Fe===3Fe2+,不能实现该反应的原电池是( )21世纪教育网
A.正极为Cu,负极为Fe,电解质为FeCl3溶液
B.正极为C,负极为Fe,电解质为Fe(NO3)3溶液
C.正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质为CuSO4溶液
答案 CD
解析 由2Fe3++Fe===3Fe2+得出负极反应式为:
Fe-2e-===Fe2+,正极反应式为:2Fe3++2e-===2Fe2+,可知负极材料为铁,正极材料为比铁不活泼的导体,电解质溶液中必须有Fe3+,答案为CD。[来源:21世纪教育网
点拨 设计原电池,第一要确定化学反应是能自发进行的氧化还原反应;第二是将氧化还原反应拆分为氧化反应和还原反应两个半反应(电极反应式);第三是根据原电池构成的条件确定原电池的正、负极材料和电解质溶液。
3.以锌片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2 mol电子时,下列说法正确的是( )21世纪教育网
A.锌片溶解了1 mol,铜片上析出1 mol H2
B.两极上溶解和析出的物质质量相等
C.锌片溶解31 g,铜片上析出1 g H2
D.锌片溶解了1 mol,硫酸消耗1 mol
答案 AD
解析 在涉及原电池的有关计算中,关键是要把握住一点即两极得、失电子数相等。利用这一特点,我们从电极反应看:负极:Zn-2e-===Zn2+;正极:2H++2e-===H2↑。当溶解1 mol锌失去2 mol电子,铜片上析出1 mol氢气也得到2 mol电子,得失电子守恒,这样即可推出A、D为正确选项。
规律 电化学的有关计算都要遵循电子守恒。
1.有关原电池的下列说法中正确的是( )
A.在外电路中电子由正极流向负极
B.在原电池中,只有金属锌作为负极
C.原电池工作时,阳离子向正极方向移动
D.原电池工作时,阳离子向负极方向移动
答案 C
解析 在原电池中,电子从负极流向正极;原电池中活泼的金属作负极,而不一定是Zn;随着反应的进行,阳离子在正极被还原,所以电解质溶液中的阳离子向正极移动,而阴离子向负极移动。答案为C。
2.根据原电池的有关知识,下列反应不能用于原电池的是( )
A.2H2+O22H2O
B.2CH3OH+3O22CO2+4H2O
C.Zn+2HCl===ZnCl2+H2↑
D.NaOH+HCl===NaCl+H2O
答案 D
解析 原电池反应必须是一个放热的氧化还原反应,两个因素缺一不可,四个选项均为放热反应,但选项D是非氧化还原反应,故它不可以用于原电池反应。
3.银锌电池广泛用作各种电子仪器的电源,它的电池反应是:Zn+Ag2O+H2O===2Ag+Zn(OH)2,则负极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
答案 D
解析 判断原电池的正、负极,要根据总反应式确定失电子物质和得电子物质,然后根据在原电池中失去电子的物质作负极作出判断。由题给总方程式得:Zn+2OH--2e-===Zn(OH)2,故Zn为负极。
4.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在CuSO4溶液中,铜片质量增加
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
答案 C
解析 铜片和铁片紧靠并浸入稀H2SO4中,铜片上的H+获得由铁片传递过来的电子2H++2e-===H2↑,所以可观察到铜片表面出现气泡;锌片作负极,铜片作正极,发生反应Zn+Cu2+===Zn2++Cu,生成的Cu在铜片上析出使其质量增加;铜片插入FeCl3溶液,发生的反应是Cu+2Fe3+===Cu2++2Fe2+,并没有单质铁的析出;向盛有锌粒和盐酸的试管中,滴入几滴CuCl2溶液,发生反应Zn+Cu2+===Zn2++Cu,置换出的Cu与剩余的Zn接触,置于盐酸中,构成了原电池,加速2H++2e-===H2↑反应,可观察到气泡放出速率加快。
5.如图所示,烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )
答案 A
6.在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
A.碳棒上有气体放出,溶液pH变大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极到b极
D.a极上发生了氧化反应
答案 B
解析 本题考查原电池基本知识,难度不大,但概念容易混淆。没有扎实的基础知识容易搞错,显然,电极a、b与电解质溶液稀H2SO4组成原电池。因活泼性a>b(碳棒),所以a为电池的负极,b为正极。电极反应式:
a(负)极:a-ne-===an+(氧化反应)
b(正)极:nH++ne-===H2(还原反应)
由于正极放电消耗H+,溶液中c(H+)减小,pH增大,在外电路中,电子由a极流出经电流计A流向b极。
7.根据下列实验事实:①X+Y2+===X2++Y ②Z+2H2OZ(OH)2+H2↑ ③Z2+的氧化性比X2+弱 ④由Y、W作电极组成的原电池反应为:Y-2e-=Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是( )
A.X>Y>Z>W B.Y>X>W>Z C.Z>X>Y>W D.Z>Y>X>W
答案 C
解析 依据氧化还原反应的规律,由①可知X的还原性大于Y;Z可与冷水反应,因而还原性最强;Z2+的氧化性比X2+弱,其对应的金属Z的还原性大于X;④中Y、W作电极组成的原电池Y作负极,可知Y的还原性大于W。由此可知,X、Y、Z、W的还原性由强到弱的顺序是:Z>X>Y>W。
[来源:21世纪教育网
8.右图是一个原电池装置,请按要求填空。
(1)正极材料是____________负极材料是____________。
(2)电流的方向是:由__________经外电路流向____________。
(3)反应过程中,铁片质量____________,铜片质量____________。
(4)写出电极反应式:
负极:____________,正极____________________。
(5)该电流中发生的总反应方程式为:
________________________________________________________________________。
答案 (1)Cu Fe (2)Cu Fe (3)减小 增大
(4)Fe-2e-===Fe2+ Cu2++2e-===Cu
(5)Fe+Cu2+===Fe2++Cu
9.称取三份锌粉,分别盛于甲、乙、丙三支试管中,向甲中加入50 mL pH=3 的HCl溶液,向乙中加入50 mL pH=3 的醋酸溶液,向丙中加入50 mL pH=3 的醋酸及少量胆矾粉末,反应结束时产生的H2体积一样多,且无锌粉剩余,请用“>”、“=”或“<”填空:
(1)开始反应时速率大小关系为______________;
(2)反应过程中,乙和丙速率不同的理由是
________________________________________________________________________;
(3)反应结束时,所需时间__________;
(4)三支试管中参加反应的锌的质量为____________。
答案 (1)甲=乙=丙 (2)丙形成原电池反应速率加快 (3)甲>乙>丙 (4)甲=乙<丙
解析 Zn与酸反应的实质为:Zn+2H+===Zn2++H2↑,其反应速率取决于c(H+),反应开始时pH相同,即c(H+)相等,故反应速率相等;乙中存在平衡CH3COOH??CH3COO-+H+,反应过程中c(H+)降低稍慢,反应速率甲<乙。丙中发生反应Zn+Cu2+===Zn2++Cu,Zn与置换出的铜构成原电池;反应速率加快,且多消耗一部分Zn。
10.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下。试根据下表中的实验现象回答下列问题:
编号 电极材料 电解质溶液 电流计指针偏转方向
1 Al、Mg 稀盐酸 偏向Al
2 Al、Cu 稀盐酸 偏向Cu
3 Al、石墨 稀盐酸 偏向石墨
4 Al、Mg 氢氧化钠 偏向Mg
5 Al、Zn 浓硝酸 偏向Al
(1)实验1、2中Al所作的电极是否相同?
(2)写出实验3中的电极反应和电池反应。
(3)实验4中Al作正极还是负极?写出Al电极的电极反应。
(4)解释实验5中电流计指针偏向Al的原因。
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极,受到哪些因素的影响?[来源:21世纪教育网
答案 (1)不相同,1中作正极,2中作负极
(2)负极:2Al-6e-===2Al3+
正极:6H++6e-===3H2↑
总反应方程式:2Al+6H+===2Al3++3H2↑
(3)Al作负极
Al+4OH--3e-===AlO+2H2O
(4)常温下Al钝化,Zn能与浓HNO3反应,故Zn作原电池的负极,Al作正极。
(5)①与金属本身活泼性有关,也与另一电极金属活泼性有关;②与电解质溶液的酸碱性和酸的氧化性有关。
解析 实验1中Mg活泼,故Mg作负极;实验2中Al活泼,故Al作负极;实验3中是铝作负极,将盐酸中的氢离子置换出氢气;实验4中Mg虽比Al活泼,但Mg不能与NaOH溶液反应,而Al可与NaOH溶液反应,故Al作负极;实验5中Al虽比Zn活泼,但常温下,Al遇浓硝酸发生钝化,阻止内部的金属继续与酸反应,故Zn为负极。
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
