课题二 溶解度 第二课时
文档属性
| 名称 | 课题二 溶解度 第二课时 |

|
|
| 格式 | zip | ||
| 文件大小 | 579.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-01-15 00:00:00 | ||
图片预览





文档简介
课件19张PPT。溶解度
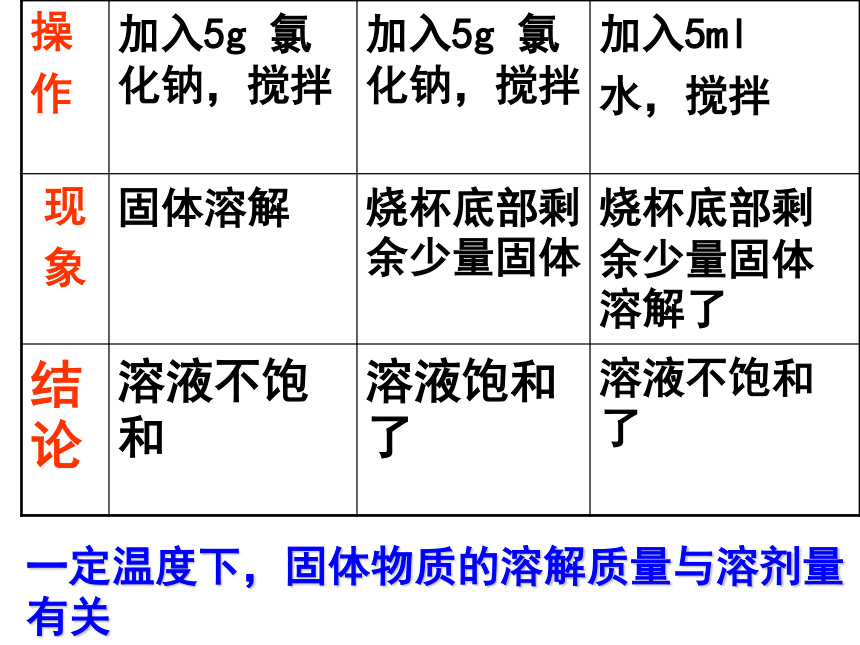
活动与探究1.室温下在一定量水中逐步加入NaCl
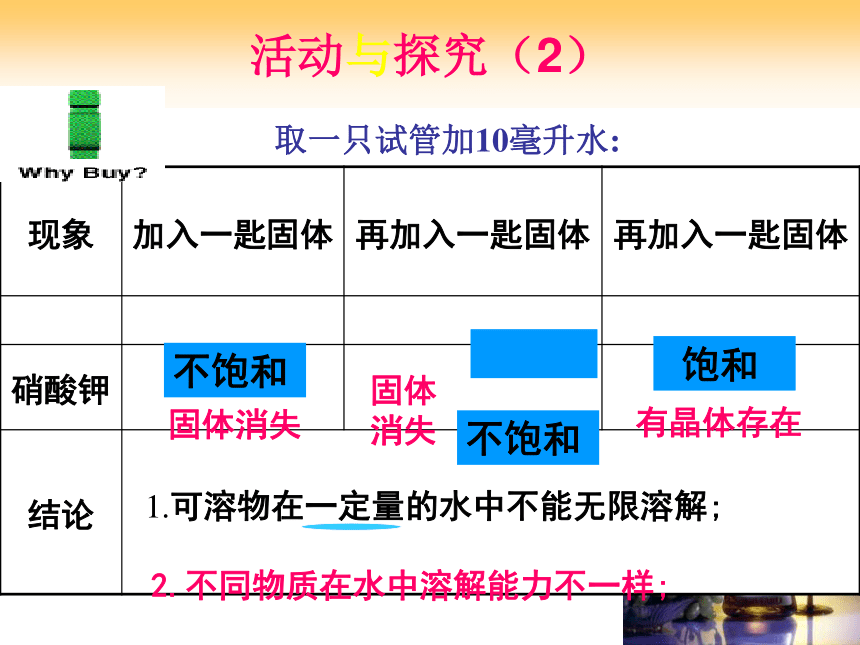
固体,观察实验现象。一定温度下,固体物质的溶解质量与溶剂量有关活动与探究(2)取一只试管加10毫升水:固体消失固体
消失有晶体存在1.可溶物在一定量的水中不能无限溶解;2.不同物质在水中溶解能力不一样;不饱和 不饱和 饱和实验探究二 :用硝酸钾替氯化钠重做上述实验根据溶解情况,一定量的溶剂,和一定的温度下,溶液有哪些状态?(1)溶质能继续溶解的状态(2)溶质不能继续溶解的状态。 在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。 在一定温度下,在一定量的溶剂里,还
能继续溶解某种溶质的溶液,叫做这种溶质
的不饱和溶液。饱和溶液:不饱和溶液: 能力升级 不饱和饱和饱和1362、判断溶液是否饱和最简单的方法想一想,做一做
1、我们在说某溶液是饱和溶液,还是不饱和溶液时,为什么总要强调“一定温度下,一定量的溶剂里,”这两个条件?
2、为什么必须说明是“这种溶质”的饱和溶液?(即为什么必须指明溶质是什么?)不饱和 饱和不饱和实验1.硝酸钾的饱和溶液中还能继续溶解高锰酸钾3、饱和溶液与不饱和溶液的相互转化③蒸发水份①加水①加溶质②降温②升温 从上面的实验,我们可以看出在一定条件下,饱和溶液与不饱和溶液可以相互转化;方法有哪些?1. 20℃时,100g 饱和氯化钠溶液若保持温度不变,使其成为不饱和溶液的方法是 ( ) ;
2. 20℃时,接近饱和的石灰水,使其成为饱和溶液的方法是( )。加水①加氢氧化钙固体实践与应用②蒸发水份③升温溶解在溶液中的溶质从溶液中以晶体
形式析出,这一过程叫做结晶结晶—析出晶体后,溶液仍饱和吗?饱和结晶的方法有哪些?冷却热饱和溶液结晶和蒸发溶剂结晶有甲、乙两杯等量、同温度的水想一想:
哪杯糖水更甜(即:那杯糖水更浓)? 一匙蔗糖 两匙蔗糖三: 浓溶液和稀溶液定义浓溶液: 含溶质较多的溶液。稀溶液: 含溶质较少的溶液。温馨提示:
将溶液分为浓溶液和稀溶液,是根据一定量的溶液中所含溶质的相对多少来分的.讨论 饱和溶液、不饱和溶液与浓溶液、稀溶液之间关系怎样?做一做根据表中数据讨论实验:(80℃)
10克水 + 12克硝酸钾:振荡,现象:
溶液类型:
2.10克水 + 0.2克熟石灰 :振荡,现象:
溶液类型: 硝酸钾
溶解 硝酸钾的不饱和溶液 浓度大熟石灰
未完全
溶解 熟石灰的饱和溶液浓度小1. 饱和溶液不一定是浓溶液,可能是稀溶液.
2. 不饱和溶液不一定是稀溶液,可能是浓溶液.从实验你能得到什么结论?思考:
(1)哪杯溶液达到饱和?
(2)哪杯溶液的浓度更大?
(3)由此,你能得到什么结论?同温度下,同物质的
饱和溶液比它的
不饱和溶液浓. 饱和溶液、不饱和溶液与浓溶液、稀溶液之间有怎样的关系?1. 饱和溶液不一定是浓溶液,可能是稀溶液.
2. 不饱和溶液不一定是稀溶液,可能是浓溶液.
3. 同温度下,同物质的饱和溶液比它的不饱和溶液浓.讨论讨论结论:用图示表示饱和溶液、不饱和溶液和浓溶液、稀溶液的关系; 以及饱和溶液和不饱和溶液的转化(小结)饱和溶液不饱和溶液(对大多数固态溶质的溶液而言)浓溶液稀溶液 1、在温度为t℃时,某物质的饱和溶液一定是 ( )
A、稀溶液 B、含有100g溶剂的溶液
C、浓溶液 D、不能再溶解该物质的溶液 实践与应用 D2.某物质的饱和溶液中,加入一些该溶质的固体,则下列说法正确的是( )
A.溶质质量减少; B.溶液质量增大;
C.固体质量不变; D.溶质质量增加. C3、指出下列各题的错误之处,并加以改正:
1.不能再溶解某种溶质的溶液叫饱和溶液。
2.装有饱和溶液的瓶子的瓶底,一定有这种溶质的固体。
3.使一接近饱和的溶液变成饱和溶液,可将其中的溶
剂倒出一些。
4. 在同一温度下,同体积的某物质的饱和溶液,一定
会比另一物质的不饱和溶液含有的溶质多。
5.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液。
在一定温度.一定量的溶剂中,不能…….不一定,有可能刚好达到饱和.依然是不饱和溶液.不一定,这两种物质的溶解能力有可能不同.浓溶液不一定是饱和溶液
活动与探究1.室温下在一定量水中逐步加入NaCl
固体,观察实验现象。一定温度下,固体物质的溶解质量与溶剂量有关活动与探究(2)取一只试管加10毫升水:固体消失固体
消失有晶体存在1.可溶物在一定量的水中不能无限溶解;2.不同物质在水中溶解能力不一样;不饱和 不饱和 饱和实验探究二 :用硝酸钾替氯化钠重做上述实验根据溶解情况,一定量的溶剂,和一定的温度下,溶液有哪些状态?(1)溶质能继续溶解的状态(2)溶质不能继续溶解的状态。 在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。 在一定温度下,在一定量的溶剂里,还
能继续溶解某种溶质的溶液,叫做这种溶质
的不饱和溶液。饱和溶液:不饱和溶液: 能力升级 不饱和饱和饱和1362、判断溶液是否饱和最简单的方法想一想,做一做
1、我们在说某溶液是饱和溶液,还是不饱和溶液时,为什么总要强调“一定温度下,一定量的溶剂里,”这两个条件?
2、为什么必须说明是“这种溶质”的饱和溶液?(即为什么必须指明溶质是什么?)不饱和 饱和不饱和实验1.硝酸钾的饱和溶液中还能继续溶解高锰酸钾3、饱和溶液与不饱和溶液的相互转化③蒸发水份①加水①加溶质②降温②升温 从上面的实验,我们可以看出在一定条件下,饱和溶液与不饱和溶液可以相互转化;方法有哪些?1. 20℃时,100g 饱和氯化钠溶液若保持温度不变,使其成为不饱和溶液的方法是 ( ) ;
2. 20℃时,接近饱和的石灰水,使其成为饱和溶液的方法是( )。加水①加氢氧化钙固体实践与应用②蒸发水份③升温溶解在溶液中的溶质从溶液中以晶体
形式析出,这一过程叫做结晶结晶—析出晶体后,溶液仍饱和吗?饱和结晶的方法有哪些?冷却热饱和溶液结晶和蒸发溶剂结晶有甲、乙两杯等量、同温度的水想一想:
哪杯糖水更甜(即:那杯糖水更浓)? 一匙蔗糖 两匙蔗糖三: 浓溶液和稀溶液定义浓溶液: 含溶质较多的溶液。稀溶液: 含溶质较少的溶液。温馨提示:
将溶液分为浓溶液和稀溶液,是根据一定量的溶液中所含溶质的相对多少来分的.讨论 饱和溶液、不饱和溶液与浓溶液、稀溶液之间关系怎样?做一做根据表中数据讨论实验:(80℃)
10克水 + 12克硝酸钾:振荡,现象:
溶液类型:
2.10克水 + 0.2克熟石灰 :振荡,现象:
溶液类型: 硝酸钾
溶解 硝酸钾的不饱和溶液 浓度大熟石灰
未完全
溶解 熟石灰的饱和溶液浓度小1. 饱和溶液不一定是浓溶液,可能是稀溶液.
2. 不饱和溶液不一定是稀溶液,可能是浓溶液.从实验你能得到什么结论?思考:
(1)哪杯溶液达到饱和?
(2)哪杯溶液的浓度更大?
(3)由此,你能得到什么结论?同温度下,同物质的
饱和溶液比它的
不饱和溶液浓. 饱和溶液、不饱和溶液与浓溶液、稀溶液之间有怎样的关系?1. 饱和溶液不一定是浓溶液,可能是稀溶液.
2. 不饱和溶液不一定是稀溶液,可能是浓溶液.
3. 同温度下,同物质的饱和溶液比它的不饱和溶液浓.讨论讨论结论:用图示表示饱和溶液、不饱和溶液和浓溶液、稀溶液的关系; 以及饱和溶液和不饱和溶液的转化(小结)饱和溶液不饱和溶液(对大多数固态溶质的溶液而言)浓溶液稀溶液 1、在温度为t℃时,某物质的饱和溶液一定是 ( )
A、稀溶液 B、含有100g溶剂的溶液
C、浓溶液 D、不能再溶解该物质的溶液 实践与应用 D2.某物质的饱和溶液中,加入一些该溶质的固体,则下列说法正确的是( )
A.溶质质量减少; B.溶液质量增大;
C.固体质量不变; D.溶质质量增加. C3、指出下列各题的错误之处,并加以改正:
1.不能再溶解某种溶质的溶液叫饱和溶液。
2.装有饱和溶液的瓶子的瓶底,一定有这种溶质的固体。
3.使一接近饱和的溶液变成饱和溶液,可将其中的溶
剂倒出一些。
4. 在同一温度下,同体积的某物质的饱和溶液,一定
会比另一物质的不饱和溶液含有的溶质多。
5.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液。
在一定温度.一定量的溶剂中,不能…….不一定,有可能刚好达到饱和.依然是不饱和溶液.不一定,这两种物质的溶解能力有可能不同.浓溶液不一定是饱和溶液
同课章节目录
