化学:人教版必修一第一章《从实验学化学》学案(2)
文档属性
| 名称 | 化学:人教版必修一第一章《从实验学化学》学案(2) |

|
|
| 格式 | rar | ||
| 文件大小 | 92.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-01-10 00:00:00 | ||
图片预览




文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第一章《从实验学化学》复习学案
第一节 化学实验基本方法
教学目标:
1. 复习巩固学习化学实验中知识,强化训练。
2. 重点学习混合物的几种分离和提纯方法及离子的检验方法。
3. 树立安全意识。建立从实验学化学的观点
知识体系:
一、化学实验安全
1. 遵守实验室规则。2. 了解安全措施。
(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。
(2)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
(3)钠、磷等失火宜用沙土扑盖。酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。
3. 掌握正确的操作方法。例如,掌握仪器和药品的使用、加热方法、气体收集方法等。
二.混合物的分离和提纯
化学方法提纯和分离物质的“四原则”和“三必须”
(1)“四原则”是:一不增(提纯过程中不增加新的杂质);二不减(不减少欲被提纯的物质);三易分离(被提纯物与杂质容易分离);四易复原(被提纯物质要复原)。
(2)“三必须”是:一除杂试剂必须过量;二过量试剂必须除尽(因为过量试剂带入新的杂质);三除杂途径选最佳。
实验操作注意事项(1)、过滤操作应注意做到“一贴、二低、三接触”
一贴: 将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁。
二低: 滤纸边缘应略低于漏斗边缘,滤液应略低于滤纸的边缘。
三靠: 向漏斗中倾倒液体时,烧杯的夹嘴应靠在玻璃棒上;
玻璃棒的底端应靠在三层滤纸一边;漏斗颈的末端应靠在烧杯上。
(2)蒸发操作要领及注意事项:
液体的量不得超过蒸发皿容量的2/3。
加热过程中,用玻璃棒不断搅拌液体,以免液体局部过热而使液体飞溅。
液体近干时,停止加热。
注意:何时开始搅拌 何时转移蒸发皿
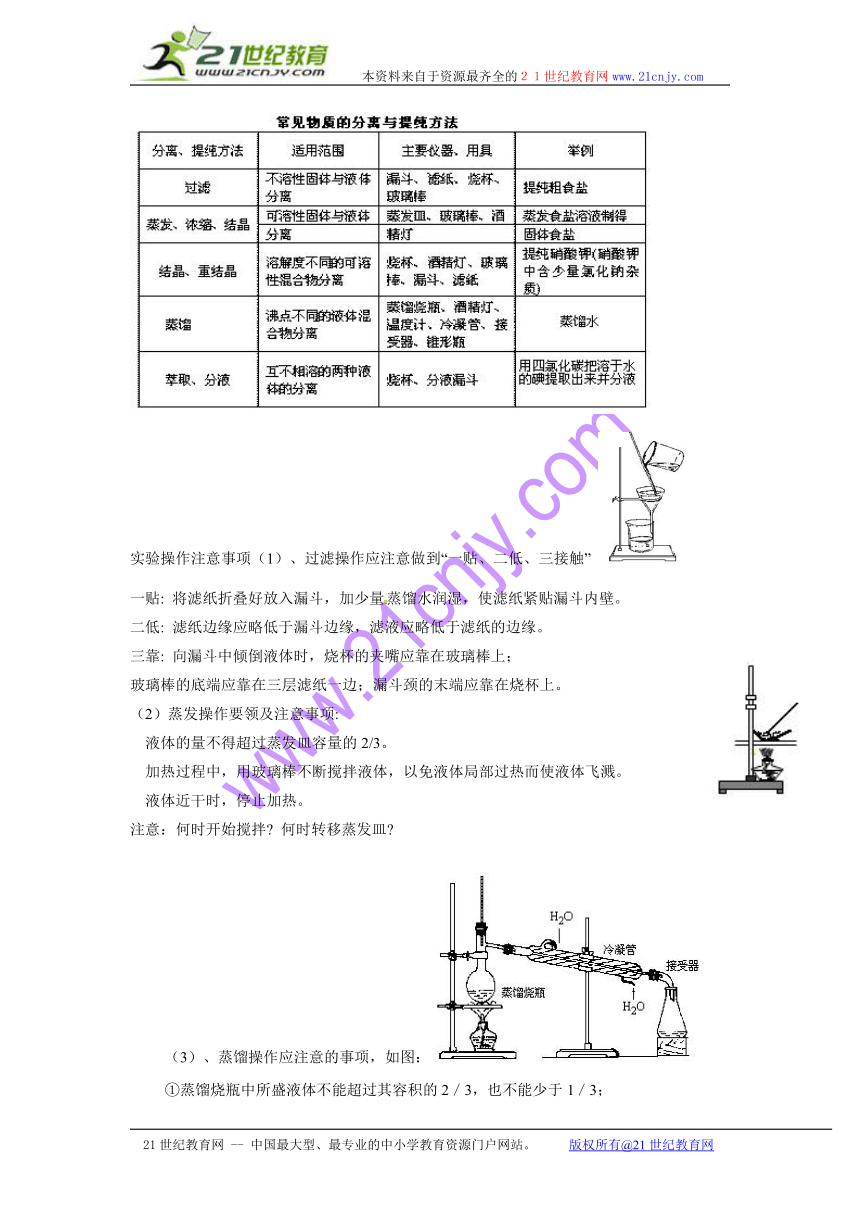
(3)、蒸馏操作应注意的事项,如图:
①蒸馏烧瓶中所盛液体不能超过其容积的2/3,也不能少于1/3;
②温度计水银球部分应置于蒸馏烧瓶支管口下方约0.5cm处;
③冷凝管中冷却水从下口进,上口出;
④为防止爆沸可在蒸馏烧瓶中加入适量碎瓷片;
⑤蒸馏烧瓶的支管和伸入接液管的冷凝管必须穿过橡皮塞,以防止馏出液混入杂质;
⑥加热温度不能超过混合物中沸点最高物质的沸点。
注意:a.蒸馏与蒸发的区别:加热是为了获得溶液的残留物(浓缩后的浓溶液或蒸干后的固体物质)时,要用蒸发;加热是为了收集蒸气的冷凝液体时,要用蒸馏。b.]蒸发操作应注意的事项:注意蒸发皿的溶液不超过蒸发皿容积的2/3;加热过程中要不断搅拌,以免溶液溅出;如果蒸干,当析出大量晶体时就应熄灭酒精灯,利用余热蒸发至干。
(4)萃取和分液:
萃取的操作方法如下:
①用普通漏斗把待萃取的溶液注入分液漏斗,再注入足量萃取液;
②随即振荡,使溶质充分转移到萃取剂中。振荡的方法是用右手压住上口玻璃塞,左手握住活塞部分,反复倒转漏斗并用力振荡;
③然后将分液漏斗置于铁架台的铁环上静置,待分层后进行分液;
④蒸发萃取剂即可得到纯净的溶质。为把溶质分离干净,一般需多次萃取。
分液的操作方法:21世纪教育网
①用普通漏斗把要分离的液体注入分液漏斗内,盖好玻璃塞;
②将分液漏斗置于铁架台的铁圈上,静置,分层;
③将玻璃塞打开,使塞上的凹槽对准漏牛口上的小孔再盖好,使漏斗内外空气相通,以保证漏斗里的液体能够流出;
④打开活塞,使下层液体慢慢流出,放入烧杯,待下层液体流完立即关闭活塞,注意不可使上层液体流出;
⑤从漏斗上端口倒出上层液体。
3. 离子检验
⑴SO42- :向待测溶液中加入稀HCl后,再加入BaCl2溶液,生成白色沉淀。
Ba2++ SO42-=== BaSO4↓
⑵Cl- :向待测溶液中加入稀HNO3 后,再加入AgNO3溶液,生成白色沉淀。21世纪教育网
Ag++ Cl—==AgCl↓
⑶CO32- :向待测溶液中加入BaCl2溶液,生成白色沉淀,再加入稀盐酸或稀HNO3后,生成的气体使澄清石灰水变浑浊。
Ba2++ CO32-=== BaCO3↓ BaCO3 + 2HNO3 == Ba(NO3)2 + CO2↑+H2O
练习:
1.下列有关使用托盘天平的叙述,不正确的是( )
A.称量前先调节托盘天平的零点
B.称量时左盘放被称量物,右盘放砝码
C.潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D.用托盘天平可以称量至0.1g
2.有CuCl2和Mg Cl2混合溶液中,加入过量的锌粉,充分反应后过滤,留在滤纸上的物质是( )
A.Zn B.Cu C.Zn和Cu D.Cu和Mg
3.试管是化学实验中最常用的玻璃仪器,对试管加热时,下列操作正确的是
A.试管外壁有水珠不一定要擦干,加热时会自然挥发
B.应握紧试管夹,大拇指按在短柄上
C.试管中液体的量不能超过试管容积的1/3
D.可以使试管的受热部位在火焰上方先上下移动,后集中加热
4.下列实验操作中错误的是 ( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
5.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤,正确的操作顺序是
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
6.下列仪器常用于物质分离的是
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵
A.①③④ B.①②⑥ C.①③⑤ D.①③⑥
7.下列实验操作中,不正确的是
A.称量固体药品时,将药品直接放在天平托盘上
B.实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯
C.过滤时,漏斗下端紧贴接液烧杯内壁
D.在由氢氧化铜分解制氧化铜时,要边加热边用玻璃棒搅拌
8.下列实验操作中叙述正确的是
A.萃取操作必须在分液漏斗中进行
B.振荡试管中液体时,手拿住试管,用手腕甩动
C.用剩的药品应收集起来放回原试剂瓶中
D.称量物质时先取小砝码,再依次取较大的砝码
9.下列实验操作中错误的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液蒸干
D.称量时,称量物放在称量纸上置于托盘天平的左盘,砝码放在托盘天平的右盘中
10.下列所采取的灭火方法中,不恰当的是( )
A. 炒菜时油锅着火,立即盖上锅盖 B. 酒精灯不慎打翻起火,用湿抹布扑盖
C. 电器因短路起火时,用水浇灭 D. 用二氧化碳灭火器扑灭图书档案等着火
11.能用溶解、过滤、结晶的方法来分离的一组物质是( )
A. CaO和KCl B.CuO和NaCl C.BaSO4和SO3 D.NaCl和AgNO3
12.能够用来鉴别BaCl2 、 NaCl 、 Na2CO3三种物质的试剂是
A.AgNO3溶液 B.稀硫酸 C.稀盐酸 D.稀硝酸
13.硫酸具有强氧化性,对人体的皮肤和其它的物质有很强烈的腐蚀性,所以盛放硫酸的容器上应贴上的标签是
A B C D
参考答案:
1C2C3C4AD5A6C7A8B9CD10C11B12B13C
第二节 化学计量在实验中的应用
教学目的:
1. 复习巩固学习物质的量的相关知识,强化训练。
2. 复习巩固配制一定物质的量浓度的溶液的实验操作。
知识体系:
一. 物质的量的单位—摩尔
1.物质的量:与质量、长度一样的物理量是国际单位制中的7个基本物理量。单位为摩尔,符号为mol。
含有6.02×1023个粒子的任何粒子集体计量为1摩尔。摩尔简称摩,符号mol。
6.02×1023/mol叫阿伏加德罗常数,符号:NA。
N == n·NA (N:微粒数)
注意:(1)物质的量表示物质所含微粒的多少,这四个字是一个整体,不得简化或增添任何字,物质的量实际上表示含有一定数目粒子的集体。
(2)物质的量是以微观粒子为计量的对象,而这里的“粒子”是指构成物质的“基本单元”可以是分子、原子、离子、中子、质子等单一粒子,也可以是这些粒子的特定组合。
(3)物质的量用符号“n”表示。
2. 摩尔质量:单位物质的量的物质的质量,符号“M”
单位:克/摩 符号:g/mol
数值:等于物质的原子量、分子量、原子团的式量。
m == n·M (m :物质的质量)
3. 气体的摩尔体积
单位物质的量的气体所占的体积,符号“Vm”。 (标准状况下:Vm=22.4L/mol)
(1)单位物质的量的任何气体在相同条件下占有的体积相等。
推论1 在标况下,任何气体1mol所占有的体积相等,约为22.4L。
推论2 在相同条件下,任何等物质的量的气体所占有的体积相等,但不一定是22.4L。
(2)气体摩尔体积(Vm)与物质的量(n)的关系:
V == n ·Vm (V:气体的体积)
⑶阿伏加德罗定律及应用
①定义:在同温同压下,同体积的任何气体都含有相同数目的分子,这就是阿伏加德罗定律。
②阿伏加德罗定律的应用
同温同压下,任何气体的体积比等于气体的物质的量之比,即V1/V2 == n1/n2
同温、定容时,任何气体的压强比等于气体的物质的量之比,即P1/P2 == n1/n2
同温同压下,任何气体的密度比等于它们的相对分子质量之比,即ρ1/ρ2== M1/M2
同温同压下,任何气体的质量比等于它们的相对分子质量之倒数比,即m1/m2=M1/M2
同温、同压下,等质量的任何气体的体积比等于等于它们的相对分子质量之倒数比:V1/V2=M2/M1
4.物质的量浓度:
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶液B的物质的量浓度。(2)表示符号:cB (3)单位为:mol/L(或mol·L-1)(4)数学表达式:cB= nB/V
注意:a 概念中的体积是指溶液的体积,而不是溶剂的体积。
b 溶质的量一定要用“物质的量”来表示。
c 溶质可以是单质和化合物,也可以是离子或其他特定组合。
d 带结晶水的物质作“溶质”时,溶质是不含结晶水的化合物,其物质的量计算,用带结晶水的物质质量除以带结晶水的物质的摩尔质量即可。
e 对于一定物质的量浓度的溶液,取出任意体积的溶液时,其浓度不变。
(2)物质的量浓度与溶质的质量分数比较:
物质的量浓度 溶质的质量分数
溶质的单位 mol g
溶液的单位 L g
公式 物质的量浓度[cB]= 溶质的物质的量[nB] 溶液的体积(V) 溶质的质量分数=100%× 溶质的质量 溶液的质量
单位 mol/L 无
特点
物质的量浓度与溶质的质量分数的换算关系:(上式中密度的单位为g/ml,摩尔质量的单位为g/mol)
21世纪教育网
5. 物质的量(n)、阿伏加德罗常数(NA)、物质的微粒数(N)、气体的摩尔体积(Vm)物质的量浓度(CB)摩尔质量(M)之间的关系:
计算公式:n=N/NA=m∕M=V∕Vm= CB V
二. 一定物质的量浓度溶液的配制:
a .容量瓶使用方法
b.一定物质的量浓度溶液的配制步骤:
a、计算:算出固体溶质的质量或液体溶质的体积。
b、称量、量取:用托盘天平称取固体溶质质量,用量简量取所需液体溶质的体积。
c、溶解:将固体或液体溶质倒入烧杯中,加入适量的蒸馏水(约为所配溶液体积的1/6),用玻璃棒搅拌使之溶解,冷却到室温后,将溶液引流注入容量瓶里。
d、洗涤(转移):用适量蒸馏水将烧杯及玻璃棒洗涤2-3次,将洗涤液注入容量瓶。振荡,使溶液混合均匀。
e、定容:继续往容量瓶中小心地加水,直到液面接近刻度2-3m处,改用胶头滴管加水,使溶液凹面恰好与刻度相切。把容量瓶盖紧,再振荡摇匀。
f、装瓶
g、贴签
注意:1.误差分析
配制步骤 错误操作 nB V cB
计算 计算结果m=5.85g,称5.9g
称量 砝码生锈(没有脱落) 21世纪教育网21世纪教育网
少量NaCl沾在滤纸上
溶解 为促进NaCl溶解而加热,将热溶液转移至容量瓶中
转移 溶液未冷
洗涤 未洗涤或洗涤液未注入容量瓶
定容 仰视
俯视
超过刻度线,吸出一部分水
摇匀 摇匀后液面下降,补充水
装瓶 试剂瓶刚用蒸馏水洗过
2.用浓溶液配制稀溶液:(稀释定律)
c(浓溶液)·V(浓溶液)= c(稀溶液)·V(稀溶液)
练习:
1.下列说法正确的是 ( )
A.摩尔表示物质的质量的单位 B.10gHF含有0.5molHF分子
C.2gH2的体积约为22.4L D.物质的摩尔质量等于其式量
2.下列物质中,在标准状况下体积最大的是 ( )
A.28gN2 B.71gCl2 C.48gO2 D.1000gH2O
3.同温同压下,1molHe和1molCl2具有相同的 ( )
A.原子数 B.质子数 C.质量 D.体积
4.下列说法正确的是 ( )
A.2mol的盐酸 B.0.1mol氢 C.0.3molHCl D.4mol的氧元素
5.所含分子数相同的一组物质是 ( )
A.1gH2和1gN2 B.1molH2O和1gH2O
C.3.2gO2和4.8gO3 D.44gCO2和16gO2
6.设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.2.4g金属镁变成镁离子时失去的电子数目为0.1NA
B.32g氧气所含原子数目为NA
C.17g氨气所含电子数目为10NA
D.1.8g水所含的质子数目为10NA
7.用已准确称量的氯化钠固体配制0.1mol/L的氯化钠溶液500mL,需要用到的仪器是①烧瓶 ②烧杯 ③1000mL的容量瓶 ④500mL的容量瓶 ⑤胶头滴管 ⑥玻璃棒( )
A.②④⑤⑥ B.②③⑤⑥ C.①②④⑤ D.②④⑤
8.在容量瓶上无需有标记的是 ( )
A.标线 B.温度 C.浓度 D.容量
9.要配制物质的量浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是
A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
10.0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-浓度比为( )
A.15∶2 B.1∶1 C.1∶3 D.3∶1
11.同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是D
A.物质的量之比为1:1 B. 密度之比为11:16
C. 体积之比为1:1 D.体积之比为11:16
12.在标准状况下,如果1.6L氧气含n个氧分子,则阿伏加德罗常数的数值为 ( )
A.28n B.14n C.n/28 D.n/14
参考答案:
1B2C3D4C5C6C7A8C9AD10D11D12B
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第一章《从实验学化学》复习学案
第一节 化学实验基本方法
教学目标:
1. 复习巩固学习化学实验中知识,强化训练。
2. 重点学习混合物的几种分离和提纯方法及离子的检验方法。
3. 树立安全意识。建立从实验学化学的观点
知识体系:
一、化学实验安全
1. 遵守实验室规则。2. 了解安全措施。
(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。
(2)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
(3)钠、磷等失火宜用沙土扑盖。酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。
3. 掌握正确的操作方法。例如,掌握仪器和药品的使用、加热方法、气体收集方法等。
二.混合物的分离和提纯
化学方法提纯和分离物质的“四原则”和“三必须”
(1)“四原则”是:一不增(提纯过程中不增加新的杂质);二不减(不减少欲被提纯的物质);三易分离(被提纯物与杂质容易分离);四易复原(被提纯物质要复原)。
(2)“三必须”是:一除杂试剂必须过量;二过量试剂必须除尽(因为过量试剂带入新的杂质);三除杂途径选最佳。
实验操作注意事项(1)、过滤操作应注意做到“一贴、二低、三接触”
一贴: 将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁。
二低: 滤纸边缘应略低于漏斗边缘,滤液应略低于滤纸的边缘。
三靠: 向漏斗中倾倒液体时,烧杯的夹嘴应靠在玻璃棒上;
玻璃棒的底端应靠在三层滤纸一边;漏斗颈的末端应靠在烧杯上。
(2)蒸发操作要领及注意事项:
液体的量不得超过蒸发皿容量的2/3。
加热过程中,用玻璃棒不断搅拌液体,以免液体局部过热而使液体飞溅。
液体近干时,停止加热。
注意:何时开始搅拌 何时转移蒸发皿
(3)、蒸馏操作应注意的事项,如图:
①蒸馏烧瓶中所盛液体不能超过其容积的2/3,也不能少于1/3;
②温度计水银球部分应置于蒸馏烧瓶支管口下方约0.5cm处;
③冷凝管中冷却水从下口进,上口出;
④为防止爆沸可在蒸馏烧瓶中加入适量碎瓷片;
⑤蒸馏烧瓶的支管和伸入接液管的冷凝管必须穿过橡皮塞,以防止馏出液混入杂质;
⑥加热温度不能超过混合物中沸点最高物质的沸点。
注意:a.蒸馏与蒸发的区别:加热是为了获得溶液的残留物(浓缩后的浓溶液或蒸干后的固体物质)时,要用蒸发;加热是为了收集蒸气的冷凝液体时,要用蒸馏。b.]蒸发操作应注意的事项:注意蒸发皿的溶液不超过蒸发皿容积的2/3;加热过程中要不断搅拌,以免溶液溅出;如果蒸干,当析出大量晶体时就应熄灭酒精灯,利用余热蒸发至干。
(4)萃取和分液:
萃取的操作方法如下:
①用普通漏斗把待萃取的溶液注入分液漏斗,再注入足量萃取液;
②随即振荡,使溶质充分转移到萃取剂中。振荡的方法是用右手压住上口玻璃塞,左手握住活塞部分,反复倒转漏斗并用力振荡;
③然后将分液漏斗置于铁架台的铁环上静置,待分层后进行分液;
④蒸发萃取剂即可得到纯净的溶质。为把溶质分离干净,一般需多次萃取。
分液的操作方法:21世纪教育网
①用普通漏斗把要分离的液体注入分液漏斗内,盖好玻璃塞;
②将分液漏斗置于铁架台的铁圈上,静置,分层;
③将玻璃塞打开,使塞上的凹槽对准漏牛口上的小孔再盖好,使漏斗内外空气相通,以保证漏斗里的液体能够流出;
④打开活塞,使下层液体慢慢流出,放入烧杯,待下层液体流完立即关闭活塞,注意不可使上层液体流出;
⑤从漏斗上端口倒出上层液体。
3. 离子检验
⑴SO42- :向待测溶液中加入稀HCl后,再加入BaCl2溶液,生成白色沉淀。
Ba2++ SO42-=== BaSO4↓
⑵Cl- :向待测溶液中加入稀HNO3 后,再加入AgNO3溶液,生成白色沉淀。21世纪教育网
Ag++ Cl—==AgCl↓
⑶CO32- :向待测溶液中加入BaCl2溶液,生成白色沉淀,再加入稀盐酸或稀HNO3后,生成的气体使澄清石灰水变浑浊。
Ba2++ CO32-=== BaCO3↓ BaCO3 + 2HNO3 == Ba(NO3)2 + CO2↑+H2O
练习:
1.下列有关使用托盘天平的叙述,不正确的是( )
A.称量前先调节托盘天平的零点
B.称量时左盘放被称量物,右盘放砝码
C.潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D.用托盘天平可以称量至0.1g
2.有CuCl2和Mg Cl2混合溶液中,加入过量的锌粉,充分反应后过滤,留在滤纸上的物质是( )
A.Zn B.Cu C.Zn和Cu D.Cu和Mg
3.试管是化学实验中最常用的玻璃仪器,对试管加热时,下列操作正确的是
A.试管外壁有水珠不一定要擦干,加热时会自然挥发
B.应握紧试管夹,大拇指按在短柄上
C.试管中液体的量不能超过试管容积的1/3
D.可以使试管的受热部位在火焰上方先上下移动,后集中加热
4.下列实验操作中错误的是 ( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
5.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤,正确的操作顺序是
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
6.下列仪器常用于物质分离的是
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵
A.①③④ B.①②⑥ C.①③⑤ D.①③⑥
7.下列实验操作中,不正确的是
A.称量固体药品时,将药品直接放在天平托盘上
B.实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯
C.过滤时,漏斗下端紧贴接液烧杯内壁
D.在由氢氧化铜分解制氧化铜时,要边加热边用玻璃棒搅拌
8.下列实验操作中叙述正确的是
A.萃取操作必须在分液漏斗中进行
B.振荡试管中液体时,手拿住试管,用手腕甩动
C.用剩的药品应收集起来放回原试剂瓶中
D.称量物质时先取小砝码,再依次取较大的砝码
9.下列实验操作中错误的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液蒸干
D.称量时,称量物放在称量纸上置于托盘天平的左盘,砝码放在托盘天平的右盘中
10.下列所采取的灭火方法中,不恰当的是( )
A. 炒菜时油锅着火,立即盖上锅盖 B. 酒精灯不慎打翻起火,用湿抹布扑盖
C. 电器因短路起火时,用水浇灭 D. 用二氧化碳灭火器扑灭图书档案等着火
11.能用溶解、过滤、结晶的方法来分离的一组物质是( )
A. CaO和KCl B.CuO和NaCl C.BaSO4和SO3 D.NaCl和AgNO3
12.能够用来鉴别BaCl2 、 NaCl 、 Na2CO3三种物质的试剂是
A.AgNO3溶液 B.稀硫酸 C.稀盐酸 D.稀硝酸
13.硫酸具有强氧化性,对人体的皮肤和其它的物质有很强烈的腐蚀性,所以盛放硫酸的容器上应贴上的标签是
A B C D
参考答案:
1C2C3C4AD5A6C7A8B9CD10C11B12B13C
第二节 化学计量在实验中的应用
教学目的:
1. 复习巩固学习物质的量的相关知识,强化训练。
2. 复习巩固配制一定物质的量浓度的溶液的实验操作。
知识体系:
一. 物质的量的单位—摩尔
1.物质的量:与质量、长度一样的物理量是国际单位制中的7个基本物理量。单位为摩尔,符号为mol。
含有6.02×1023个粒子的任何粒子集体计量为1摩尔。摩尔简称摩,符号mol。
6.02×1023/mol叫阿伏加德罗常数,符号:NA。
N == n·NA (N:微粒数)
注意:(1)物质的量表示物质所含微粒的多少,这四个字是一个整体,不得简化或增添任何字,物质的量实际上表示含有一定数目粒子的集体。
(2)物质的量是以微观粒子为计量的对象,而这里的“粒子”是指构成物质的“基本单元”可以是分子、原子、离子、中子、质子等单一粒子,也可以是这些粒子的特定组合。
(3)物质的量用符号“n”表示。
2. 摩尔质量:单位物质的量的物质的质量,符号“M”
单位:克/摩 符号:g/mol
数值:等于物质的原子量、分子量、原子团的式量。
m == n·M (m :物质的质量)
3. 气体的摩尔体积
单位物质的量的气体所占的体积,符号“Vm”。 (标准状况下:Vm=22.4L/mol)
(1)单位物质的量的任何气体在相同条件下占有的体积相等。
推论1 在标况下,任何气体1mol所占有的体积相等,约为22.4L。
推论2 在相同条件下,任何等物质的量的气体所占有的体积相等,但不一定是22.4L。
(2)气体摩尔体积(Vm)与物质的量(n)的关系:
V == n ·Vm (V:气体的体积)
⑶阿伏加德罗定律及应用
①定义:在同温同压下,同体积的任何气体都含有相同数目的分子,这就是阿伏加德罗定律。
②阿伏加德罗定律的应用
同温同压下,任何气体的体积比等于气体的物质的量之比,即V1/V2 == n1/n2
同温、定容时,任何气体的压强比等于气体的物质的量之比,即P1/P2 == n1/n2
同温同压下,任何气体的密度比等于它们的相对分子质量之比,即ρ1/ρ2== M1/M2
同温同压下,任何气体的质量比等于它们的相对分子质量之倒数比,即m1/m2=M1/M2
同温、同压下,等质量的任何气体的体积比等于等于它们的相对分子质量之倒数比:V1/V2=M2/M1
4.物质的量浓度:
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶液B的物质的量浓度。(2)表示符号:cB (3)单位为:mol/L(或mol·L-1)(4)数学表达式:cB= nB/V
注意:a 概念中的体积是指溶液的体积,而不是溶剂的体积。
b 溶质的量一定要用“物质的量”来表示。
c 溶质可以是单质和化合物,也可以是离子或其他特定组合。
d 带结晶水的物质作“溶质”时,溶质是不含结晶水的化合物,其物质的量计算,用带结晶水的物质质量除以带结晶水的物质的摩尔质量即可。
e 对于一定物质的量浓度的溶液,取出任意体积的溶液时,其浓度不变。
(2)物质的量浓度与溶质的质量分数比较:
物质的量浓度 溶质的质量分数
溶质的单位 mol g
溶液的单位 L g
公式 物质的量浓度[cB]= 溶质的物质的量[nB] 溶液的体积(V) 溶质的质量分数=100%× 溶质的质量 溶液的质量
单位 mol/L 无
特点
物质的量浓度与溶质的质量分数的换算关系:(上式中密度的单位为g/ml,摩尔质量的单位为g/mol)
21世纪教育网
5. 物质的量(n)、阿伏加德罗常数(NA)、物质的微粒数(N)、气体的摩尔体积(Vm)物质的量浓度(CB)摩尔质量(M)之间的关系:
计算公式:n=N/NA=m∕M=V∕Vm= CB V
二. 一定物质的量浓度溶液的配制:
a .容量瓶使用方法
b.一定物质的量浓度溶液的配制步骤:
a、计算:算出固体溶质的质量或液体溶质的体积。
b、称量、量取:用托盘天平称取固体溶质质量,用量简量取所需液体溶质的体积。
c、溶解:将固体或液体溶质倒入烧杯中,加入适量的蒸馏水(约为所配溶液体积的1/6),用玻璃棒搅拌使之溶解,冷却到室温后,将溶液引流注入容量瓶里。
d、洗涤(转移):用适量蒸馏水将烧杯及玻璃棒洗涤2-3次,将洗涤液注入容量瓶。振荡,使溶液混合均匀。
e、定容:继续往容量瓶中小心地加水,直到液面接近刻度2-3m处,改用胶头滴管加水,使溶液凹面恰好与刻度相切。把容量瓶盖紧,再振荡摇匀。
f、装瓶
g、贴签
注意:1.误差分析
配制步骤 错误操作 nB V cB
计算 计算结果m=5.85g,称5.9g
称量 砝码生锈(没有脱落) 21世纪教育网21世纪教育网
少量NaCl沾在滤纸上
溶解 为促进NaCl溶解而加热,将热溶液转移至容量瓶中
转移 溶液未冷
洗涤 未洗涤或洗涤液未注入容量瓶
定容 仰视
俯视
超过刻度线,吸出一部分水
摇匀 摇匀后液面下降,补充水
装瓶 试剂瓶刚用蒸馏水洗过
2.用浓溶液配制稀溶液:(稀释定律)
c(浓溶液)·V(浓溶液)= c(稀溶液)·V(稀溶液)
练习:
1.下列说法正确的是 ( )
A.摩尔表示物质的质量的单位 B.10gHF含有0.5molHF分子
C.2gH2的体积约为22.4L D.物质的摩尔质量等于其式量
2.下列物质中,在标准状况下体积最大的是 ( )
A.28gN2 B.71gCl2 C.48gO2 D.1000gH2O
3.同温同压下,1molHe和1molCl2具有相同的 ( )
A.原子数 B.质子数 C.质量 D.体积
4.下列说法正确的是 ( )
A.2mol的盐酸 B.0.1mol氢 C.0.3molHCl D.4mol的氧元素
5.所含分子数相同的一组物质是 ( )
A.1gH2和1gN2 B.1molH2O和1gH2O
C.3.2gO2和4.8gO3 D.44gCO2和16gO2
6.设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.2.4g金属镁变成镁离子时失去的电子数目为0.1NA
B.32g氧气所含原子数目为NA
C.17g氨气所含电子数目为10NA
D.1.8g水所含的质子数目为10NA
7.用已准确称量的氯化钠固体配制0.1mol/L的氯化钠溶液500mL,需要用到的仪器是①烧瓶 ②烧杯 ③1000mL的容量瓶 ④500mL的容量瓶 ⑤胶头滴管 ⑥玻璃棒( )
A.②④⑤⑥ B.②③⑤⑥ C.①②④⑤ D.②④⑤
8.在容量瓶上无需有标记的是 ( )
A.标线 B.温度 C.浓度 D.容量
9.要配制物质的量浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是
A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
10.0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-浓度比为( )
A.15∶2 B.1∶1 C.1∶3 D.3∶1
11.同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是D
A.物质的量之比为1:1 B. 密度之比为11:16
C. 体积之比为1:1 D.体积之比为11:16
12.在标准状况下,如果1.6L氧气含n个氧分子,则阿伏加德罗常数的数值为 ( )
A.28n B.14n C.n/28 D.n/14
参考答案:
1B2C3D4C5C6C7A8C9AD10D11D12B
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
