第一章认识化学科学 单元测试1
图片预览


文档简介
《认识化学科学》单元测试题1
(时间60分钟,满分100分)
第Ⅰ卷(选择题 共45分)
相对分子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Cu 64
一、选择题(每题只有一个选项符合题意,每题3分)
1、下列科研成果不是由我国发明或创造的是( )
A、世界上第一个由人工合成的、具有生理活性的蛋白质——结晶牛胰岛素
B、黑火药和造纸
C、发现元素周期律
D、世界上首次人工合成的酵母丙氨酸转移核糖核酸
2、物质的性质决定物质反应的现象,关于钠与水反应的现象和钠的下列性质无关的是( )
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
3.下列各种物理性质中,对氯气来说不正确的是( )
A.黄绿色的气体 B.密度比空气小
C.能溶于水 D.有刺激性气味
4.在配制物质的量浓度溶液的实验中,最后用胶头滴管定容后,液面正确的是( )
A. B. C. D.
5.下列叙述正确的是( )
A.1molO2的质量为32g·mol-1
B.1mol物质的质量等于该物质的相对分子质量或相对原子质量
C.SO42-的摩尔质量为96 g·mol-1
D.CO2的摩尔质量为44g
6.“5.12汶川大地震”后,消毒尤为重要,其中常用的消毒剂为“84”消毒液,市场上销售的“84”消毒液,其商品标识上有如下叙述: ①本品为无色溶液,呈碱性 ②使用时加水稀释 ③可对餐具、衣物进行消毒,可漂白浅色衣服
则其有效成份可能是( )
A、Cl2 B、SO2 C、NaClO D、KMnO4
7.下列物质的体积约为22.4L的是( )
A.标准状况下1mol H2O B.20℃、101 kPa时36.5g HCl
C.常温常压下17g NH3 D.标准状况下0.4 mol H2和0.6mol O2的混合气
8.下列关于钠的说法不正确的是( )
A.金属钠与O2反应,条件不同,产物不同
B.钠—钾合金通常状况下呈液态,可作原子反应堆的导热剂
C.钠的化学活泼性很强,少量的钠可保存在煤油中
D.将金属钠投入水中,生成氢氧化钠,同时放出O2
9.将一小块钠投入盛50mL澄清饱和石灰水的烧杯里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动 B.有气体生成
C.溶液底部有银白色物质生成 D.溶液变浑浊
10.能使干燥有色布条褪色的物质是( )
A.氯气 B.氯化氢 C.氯水 D.氢氧化钠
11.在标况下,下列各组气体混合其平均相对分子量可达到40的是( )
A.N2和O2 B.CO2和O2
C.SO2和CO2 D.HI和Cl2
12.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温常压下,11.2 L N2含有的分子数为0.5 NA
B.在常温常压下,1mol氖气含有的原子数为2NA
C.71gCl2所含原子数为2NA
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
13.体积相同的某营养液两份,其配方如下:
KCl K2SO4 ZnSO4 ZnCl2
(1) 0.3 mol 0.2 mol 0.1 mol
(2) 0.1 mol 0.3 mol 0.1 mol
两份营养液中各离子的浓度( )
A.完全相同 B.完全不同
C.仅c(K+)相同 D.仅c(Cl-)相同
14.在标准状况下,相同质量的下列气体,占有体积由大到小的顺序是( )
① Cl2 ② H2 ③ N2 ④ CO2 ⑤ O2
A.③ ② ④ ⑤ ① B.③ ② ④ ③ ①
C.① ④ ⑤ ② ③ D.② ③ ⑤ ④ ①
15.在一定温度、压强下,1体积X2(气)和3体积Y2(气)化合生成2体积的气体化合物,则该气体化合物的化学式为( )
A.XY3 B.XY C.X3Y D.X2Y3
第Ⅱ卷(非选择题 共55分)
二、填空题
16.(6分)100mlA2气体跟50mlB2气体恰好完全反应,生成的气体体积为100ml(同温同压条件下),试推断气体生成物的化学式__________,推断的依据是__________________________。
17.(10分)现有X、Y、Z三种元素。
(1)X的单质可以在Z的单质中燃烧生成XZ,火焰为苍白色。
(2)XZ极易溶于水,其水溶液可使蓝色石蕊试纸变红。
(3)X、Y、Z的单质在常温下为气体。
(4)两分子X的单质可以和Y单质化合生成两分子X2Y(常温下为液体)。
(5)Z的单质溶于X2Y中得到溶液具有漂白性,推断
①XYZ各为何元素(写元素符号) X__________ Y__________ Z__________
②XZ和X2Y各是什么物质(写化学式)? XZ__________ X2Y__________
三、实验题
18(10分).有人设计了如图所示实验装置,目的是做钠与水反应实验,并验证①钠的物理性质;②钠与水反应的产物是什么。
⑴当进行适当操作时还需要的仪器有 。
⑵如何进行操作? 。
⑶实验现象是 。
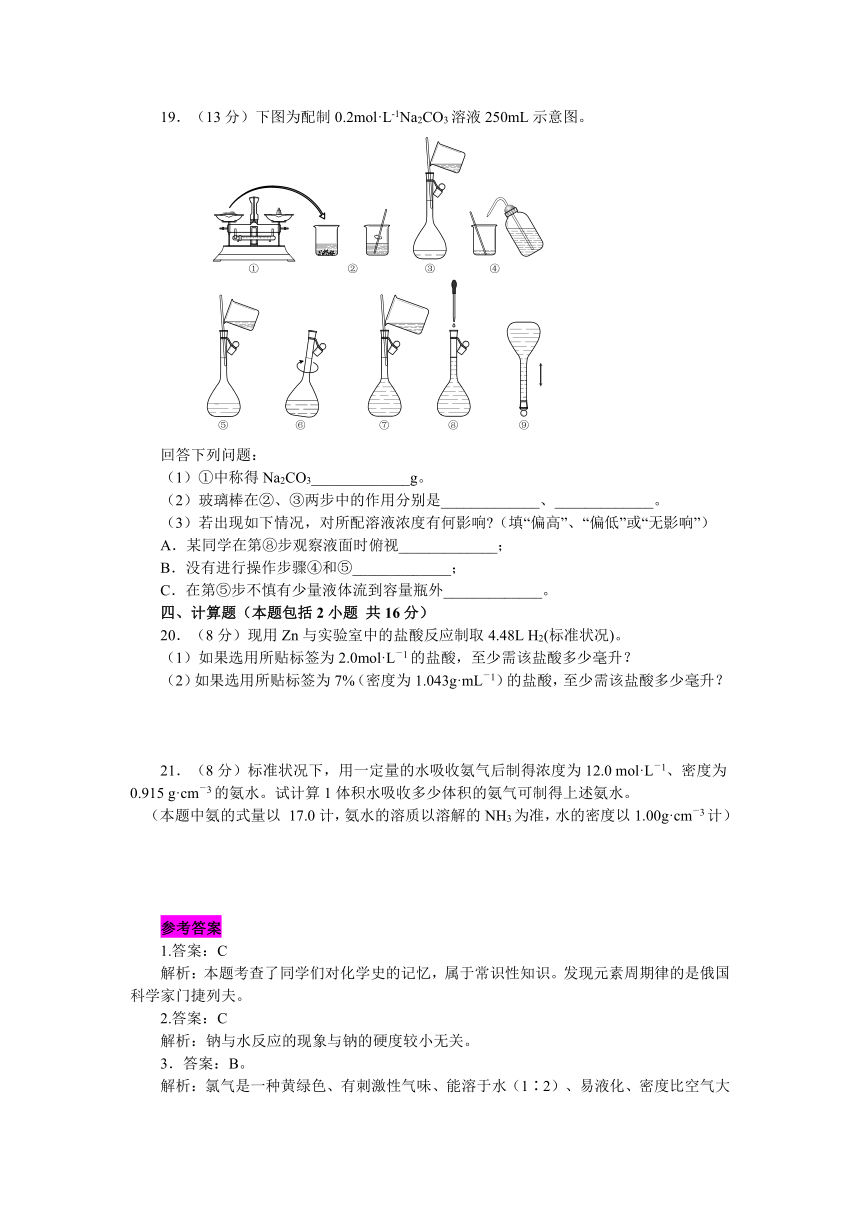
19.(13分)下图为配制0.2mol·L-1Na2CO3溶液250mL示意图。
回答下列问题:
(1)①中称得Na2CO3_____________g。
(2)玻璃棒在②、③两步中的作用分别是_____________、_____________。
(3)若出现如下情况,对所配溶液浓度有何影响 (填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视_____________;
B.没有进行操作步骤④和⑤_____________;
C.在第⑤步不慎有少量液体流到容量瓶外_____________。
四、计算题(本题包括2小题 共16分)
20.(8分)现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?
21.(8分)标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol·L-1、密度为0.915 g·cm-3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以 17.0计,氨水的溶质以溶解的NH3为准,水的密度以1.00g·cm-3计)
参考答案
1.答案:C
解析:本题考查了同学们对化学史的记忆,属于常识性知识。发现元素周期律的是俄国科学家门捷列夫。
2.答案:C
解析:钠与水反应的现象与钠的硬度较小无关。
3.答案:B。
解析:氯气是一种黄绿色、有刺激性气味、能溶于水(1∶2)、易液化、密度比空气大的有毒气体。B选项不正确。
4.答案:B。
解析:在配制物质的量浓度溶液的实验中,定容后,溶液凹液面最低点应该与刻度线平齐。B正确。
5.答案:C。
解析:质量的单位是“g”、摩尔质量的单位是“g·mol-1”、式量的单位是“1”,A、B、D选项单位使用不正确。正确的说法为:1molO2的质量为32g;1mol物质的质量如果以“g”为单位,则在数值上等于该物质的式量;CO2的摩尔质量为44 g·mol-1。C无论数值,还是单位均正确。
6.答案:C
解析:本题可以用排除法进行解答,无色溶液,可以排除KMnO4,呈碱性排除A、B。
7.答案:D。
解析:A:标准状况下H2O不是气态,体积大约为18 mL,远远小于22.4 L;B、C:0℃、101 kPa时36.5g HCl的体积为22.4 L,20℃时其体积应大于22.4 L;同理常温常压下17gNH3的体积也大于22.4 L;标准状况下,1mol任何气体的体积都约为22.4 L,不论它是纯净物还是混合气体,因此D正确。
8.答案:D。
解析:金属钠与O2反应,常温下生成氧化钠,加热或点燃条件下生成过氧化钠,A正确;钠和钾都是热的良导体,钠、钾的熔点都很低,其合金通常状况下呈液态,导热性进一步增强,可作原子反应堆的导热剂,B正确;钠的化学性质很活泼,可于空气中的水蒸气和氧气反应,少量的钠可保存在煤油中,以隔绝空气,C正确;将金属钠投入水中,生成氢氧化钠,同时放出氢气,D错误。
9.答案:C。
解析:金属钠与水反应放出大量的热,将其熔成生成小球,与水接触的部位产生的气体不均匀推动小球在液面上游动;随着反应的进行,水量不断减少,且氢氧化钙溶解度随温度升高而降低,因此有部分氢氧化钙析出,使溶液变浑浊,但它不是银白色物质,因此,C错误。
10.答案:C。
解析:氯气、氯化氢、氢氧化钠本身都没有漂白性,只有氯水中的次氯酸具有漂白性,可使干燥有色布条褪色,C正确。
11.答案:B。
解析:因为:Mr(CO2)>40 Mr(N2)<40 Mr(O2)<40 Mr(SO2)>40 Mr(HI)>40 Mr(Cl2)>40;只有一个比40大一个比40小才满足要求。
12.答案:C。
解析:本题着重考查气体摩尔体积的概念和适用条件,阿伏加德罗定律以及希有气体的组成。题目在(A)选项中设置了气体的状况条件这个陷阱,在(D)选项中设置了气体单质所含原子数这个陷阱。常温常压下,11.2LN2并不是0.5mol,含有的分子数也就不为0.5NA;稀有气体Ne是由单原子构成的,1molNe含有的原子数为NA,与状况无关;71gCl2恰好是1molCl2,含原子数为2NA;在同温同压时,相同体积的任何气体单质所含的分子数相同,由于气体单质分子中所含原子数不同,如CH4由5个原子构成,H2由2个原子构成,而Ne由一个原子构成。相同状况下,相同体积的上述气体所含原子数就不相同。
13.答案:A。
解析:两份营养液,配方不同。但仔细一算,各离子的物质的量都相同:n(K+)= 0.7 mol;n(Cl-)= 0.3 mol;n(Zn2+)= 0.1 mol;n(SO42-)= 0.3 mol;溶于水后所得营养液中各离子的浓度自然完全相同。选A。
14.答案:D。
解析:根据阿伏加德罗定律,在标准状况下,气体的体积比等于其物质的量之比,而质量相同的前提下,物质的量与其摩尔质量成反比。由此看来,上述气体占有体积由大到小的顺序实际上是摩尔质量由小到大的顺序。显然,D正确。
15.答案:A。
解析:根据阿伏加德罗定律,在一定温度、压强下,气体的体积比等于其分子数之比,也就是等于化学方程式中的计量数之比。现设此反应的方程式为:X2 + 3Y2 = 2 XaYb,再根据质量守定律得:a = 1,b = 3。A正确。
16.答案:A2B,推断的依据是阿伏加德罗定律和质量守恒定律。
解析:题目给出的已知条件有两个:一是根据反应物分子式可知它们都是双原子分子;二是在相同条件下各反应物和生成物气体的体积比A2∶B2∶AxBy = 100∶50∶100=2∶1∶2。根据阿伏加德罗定律,这个体积比就是该反应的化学方程式中各反应物和生成物的系数比,即2A2+B2=2AxBy。再结合质量守恒定律(反应前后各种原子的个数不变),就能推出:2x=2×2,x=2;2y=2,y=1。
17.答案:①X:H Y:O Z:Cl ②HCl H2O
解析:氢气在氯气中燃烧生成氯化氢,火焰为苍白色。氯化氢易溶于水,其水溶液可使蓝色石蕊试纸变红。氯气溶于水形成氯水,其中的次氯酸具有漂白性。
18.答案:(1)小试管和酒精灯
(2)将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住试管口,移近酒精灯,松开拇指点燃试管中的气体。
(3)钠浮在水面上熔化成闪亮的小球,迅速游动,并逐渐消失,水溶液由无色变成红色。点燃小试管中的气体时,有尖锐的爆鸣声。
解析: ⑴由于实验目的是做钠与水反应实验,并验证钠的物理性质及证明钠与水反应的产物是什么,所以要收集产生的气体,并验证气体的可燃性,故还需用小试管和酒精灯。
⑵要由钠和水反应来验证钠的物理性质,使自由的钠块与水接触,就要想办法让钠块落入水中。将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住试管口,移近酒精灯,松开拇指点燃试管中的气体。
⑶观察到的现象是:钠浮在水面上熔化成闪亮的小球,迅速游动,并逐渐消失,水溶液由无色变成红色。点燃小试管中的气体时,有尖锐的爆鸣声。
19.答案:(1)5.3 (2)搅拌;引流
(3)A 偏高 B 偏低 C 偏低
解析:(1)n(Na2CO3)= c(Na2CO3)×V(Na2CO3)= 0.2mol·L-1×0.25L = 0.05 mol
m(Na2CO3)= n(Na2CO3)×M(Na2CO3)= 0.05 mol×106 g/mol = 5.3 g
(2)玻璃棒是中学化学实验中常用的仪器,在第②步中,用玻璃棒搅拌,可加速Na2CO3固体的溶解;在第③步中,用玻璃棒引流,可防止Na2CO3溶液流到容量瓶外。
(3)所有的的定量实验都存在一个“误差”的问题,在本实验的误差分析中,一定要紧扣物质的量浓度的定义式,即c = n / V。如果在第⑧步观察液面时俯视,V偏小,结果偏高;如果没有进行操作步骤④和⑤,n偏小,结果偏低;如果在第⑤步不慎有少量液体流到容量瓶外,n偏小,结果偏低。
20.答案:(1)200mL (2)200mL
解析:(1)
Zn + 2HCl = ZnCl2 + H2↑
2 mol 22.4L
n(HCl) 4.48L
n(HCl)= 4.48L÷22.4L×2 mol =0.4 mol
V(HCl)= n(HCl)÷c(HCl)= 0.4 mol÷2.0mol·L-1 = 0.2L = 200mL
(2)
Zn + 2HCl = ZnCl2 + H2↑
73g 22.4L
m(HCl) 4.48L
m(HCl)= 4.48L÷22.4L×73 g =14.6 g
V(HCl)= m(HCl)÷W(HCl)÷ρ(HCl)= 14.6 g÷7% ÷1.043g·mL-1 = 200mL
提示:(1)、(2)小题结果相同,请体会哪种浓度表示方法更方便?
21.答案:378体积
解析:1.00 L该氨水中含氨的质量为: 12.0mol×17.0g·mol-1
其体积在标准状况下为:12.0mol×22.4L·mol-1
1.00L该氨水中含水的质量为:1.00L×915g·L-1-12.0mol×17.0g·mol-1
其体积为(1.00L×915g·L-1-12.0mol×17.0g·mol-1)/1000g·L-1
VNH3/VH2O=(12.0 mol×22.4 L·mol-1)/[(1.00L×915 g·L-1-12.0 mol×17.0g·mol-1)/1000 g·L-1]=378
1体积水吸收378体积NH3气(标准状况)。
若直接列出总式也可:
VNH3/VH2O=(12.0 mol×22.4 L·mol-1)/[(1.00L×915 g·L-1-12.0 mol×17.0g·mol-1)/1000 g·L-1]=378
1体积水吸收378体积NH3气(标准状况)。
(时间60分钟,满分100分)
第Ⅰ卷(选择题 共45分)
相对分子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Cu 64
一、选择题(每题只有一个选项符合题意,每题3分)
1、下列科研成果不是由我国发明或创造的是( )
A、世界上第一个由人工合成的、具有生理活性的蛋白质——结晶牛胰岛素
B、黑火药和造纸
C、发现元素周期律
D、世界上首次人工合成的酵母丙氨酸转移核糖核酸
2、物质的性质决定物质反应的现象,关于钠与水反应的现象和钠的下列性质无关的是( )
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
3.下列各种物理性质中,对氯气来说不正确的是( )
A.黄绿色的气体 B.密度比空气小
C.能溶于水 D.有刺激性气味
4.在配制物质的量浓度溶液的实验中,最后用胶头滴管定容后,液面正确的是( )
A. B. C. D.
5.下列叙述正确的是( )
A.1molO2的质量为32g·mol-1
B.1mol物质的质量等于该物质的相对分子质量或相对原子质量
C.SO42-的摩尔质量为96 g·mol-1
D.CO2的摩尔质量为44g
6.“5.12汶川大地震”后,消毒尤为重要,其中常用的消毒剂为“84”消毒液,市场上销售的“84”消毒液,其商品标识上有如下叙述: ①本品为无色溶液,呈碱性 ②使用时加水稀释 ③可对餐具、衣物进行消毒,可漂白浅色衣服
则其有效成份可能是( )
A、Cl2 B、SO2 C、NaClO D、KMnO4
7.下列物质的体积约为22.4L的是( )
A.标准状况下1mol H2O B.20℃、101 kPa时36.5g HCl
C.常温常压下17g NH3 D.标准状况下0.4 mol H2和0.6mol O2的混合气
8.下列关于钠的说法不正确的是( )
A.金属钠与O2反应,条件不同,产物不同
B.钠—钾合金通常状况下呈液态,可作原子反应堆的导热剂
C.钠的化学活泼性很强,少量的钠可保存在煤油中
D.将金属钠投入水中,生成氢氧化钠,同时放出O2
9.将一小块钠投入盛50mL澄清饱和石灰水的烧杯里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动 B.有气体生成
C.溶液底部有银白色物质生成 D.溶液变浑浊
10.能使干燥有色布条褪色的物质是( )
A.氯气 B.氯化氢 C.氯水 D.氢氧化钠
11.在标况下,下列各组气体混合其平均相对分子量可达到40的是( )
A.N2和O2 B.CO2和O2
C.SO2和CO2 D.HI和Cl2
12.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温常压下,11.2 L N2含有的分子数为0.5 NA
B.在常温常压下,1mol氖气含有的原子数为2NA
C.71gCl2所含原子数为2NA
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
13.体积相同的某营养液两份,其配方如下:
KCl K2SO4 ZnSO4 ZnCl2
(1) 0.3 mol 0.2 mol 0.1 mol
(2) 0.1 mol 0.3 mol 0.1 mol
两份营养液中各离子的浓度( )
A.完全相同 B.完全不同
C.仅c(K+)相同 D.仅c(Cl-)相同
14.在标准状况下,相同质量的下列气体,占有体积由大到小的顺序是( )
① Cl2 ② H2 ③ N2 ④ CO2 ⑤ O2
A.③ ② ④ ⑤ ① B.③ ② ④ ③ ①
C.① ④ ⑤ ② ③ D.② ③ ⑤ ④ ①
15.在一定温度、压强下,1体积X2(气)和3体积Y2(气)化合生成2体积的气体化合物,则该气体化合物的化学式为( )
A.XY3 B.XY C.X3Y D.X2Y3
第Ⅱ卷(非选择题 共55分)
二、填空题
16.(6分)100mlA2气体跟50mlB2气体恰好完全反应,生成的气体体积为100ml(同温同压条件下),试推断气体生成物的化学式__________,推断的依据是__________________________。
17.(10分)现有X、Y、Z三种元素。
(1)X的单质可以在Z的单质中燃烧生成XZ,火焰为苍白色。
(2)XZ极易溶于水,其水溶液可使蓝色石蕊试纸变红。
(3)X、Y、Z的单质在常温下为气体。
(4)两分子X的单质可以和Y单质化合生成两分子X2Y(常温下为液体)。
(5)Z的单质溶于X2Y中得到溶液具有漂白性,推断
①XYZ各为何元素(写元素符号) X__________ Y__________ Z__________
②XZ和X2Y各是什么物质(写化学式)? XZ__________ X2Y__________
三、实验题
18(10分).有人设计了如图所示实验装置,目的是做钠与水反应实验,并验证①钠的物理性质;②钠与水反应的产物是什么。
⑴当进行适当操作时还需要的仪器有 。
⑵如何进行操作? 。
⑶实验现象是 。
19.(13分)下图为配制0.2mol·L-1Na2CO3溶液250mL示意图。
回答下列问题:
(1)①中称得Na2CO3_____________g。
(2)玻璃棒在②、③两步中的作用分别是_____________、_____________。
(3)若出现如下情况,对所配溶液浓度有何影响 (填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视_____________;
B.没有进行操作步骤④和⑤_____________;
C.在第⑤步不慎有少量液体流到容量瓶外_____________。
四、计算题(本题包括2小题 共16分)
20.(8分)现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?
21.(8分)标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol·L-1、密度为0.915 g·cm-3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以 17.0计,氨水的溶质以溶解的NH3为准,水的密度以1.00g·cm-3计)
参考答案
1.答案:C
解析:本题考查了同学们对化学史的记忆,属于常识性知识。发现元素周期律的是俄国科学家门捷列夫。
2.答案:C
解析:钠与水反应的现象与钠的硬度较小无关。
3.答案:B。
解析:氯气是一种黄绿色、有刺激性气味、能溶于水(1∶2)、易液化、密度比空气大的有毒气体。B选项不正确。
4.答案:B。
解析:在配制物质的量浓度溶液的实验中,定容后,溶液凹液面最低点应该与刻度线平齐。B正确。
5.答案:C。
解析:质量的单位是“g”、摩尔质量的单位是“g·mol-1”、式量的单位是“1”,A、B、D选项单位使用不正确。正确的说法为:1molO2的质量为32g;1mol物质的质量如果以“g”为单位,则在数值上等于该物质的式量;CO2的摩尔质量为44 g·mol-1。C无论数值,还是单位均正确。
6.答案:C
解析:本题可以用排除法进行解答,无色溶液,可以排除KMnO4,呈碱性排除A、B。
7.答案:D。
解析:A:标准状况下H2O不是气态,体积大约为18 mL,远远小于22.4 L;B、C:0℃、101 kPa时36.5g HCl的体积为22.4 L,20℃时其体积应大于22.4 L;同理常温常压下17gNH3的体积也大于22.4 L;标准状况下,1mol任何气体的体积都约为22.4 L,不论它是纯净物还是混合气体,因此D正确。
8.答案:D。
解析:金属钠与O2反应,常温下生成氧化钠,加热或点燃条件下生成过氧化钠,A正确;钠和钾都是热的良导体,钠、钾的熔点都很低,其合金通常状况下呈液态,导热性进一步增强,可作原子反应堆的导热剂,B正确;钠的化学性质很活泼,可于空气中的水蒸气和氧气反应,少量的钠可保存在煤油中,以隔绝空气,C正确;将金属钠投入水中,生成氢氧化钠,同时放出氢气,D错误。
9.答案:C。
解析:金属钠与水反应放出大量的热,将其熔成生成小球,与水接触的部位产生的气体不均匀推动小球在液面上游动;随着反应的进行,水量不断减少,且氢氧化钙溶解度随温度升高而降低,因此有部分氢氧化钙析出,使溶液变浑浊,但它不是银白色物质,因此,C错误。
10.答案:C。
解析:氯气、氯化氢、氢氧化钠本身都没有漂白性,只有氯水中的次氯酸具有漂白性,可使干燥有色布条褪色,C正确。
11.答案:B。
解析:因为:Mr(CO2)>40 Mr(N2)<40 Mr(O2)<40 Mr(SO2)>40 Mr(HI)>40 Mr(Cl2)>40;只有一个比40大一个比40小才满足要求。
12.答案:C。
解析:本题着重考查气体摩尔体积的概念和适用条件,阿伏加德罗定律以及希有气体的组成。题目在(A)选项中设置了气体的状况条件这个陷阱,在(D)选项中设置了气体单质所含原子数这个陷阱。常温常压下,11.2LN2并不是0.5mol,含有的分子数也就不为0.5NA;稀有气体Ne是由单原子构成的,1molNe含有的原子数为NA,与状况无关;71gCl2恰好是1molCl2,含原子数为2NA;在同温同压时,相同体积的任何气体单质所含的分子数相同,由于气体单质分子中所含原子数不同,如CH4由5个原子构成,H2由2个原子构成,而Ne由一个原子构成。相同状况下,相同体积的上述气体所含原子数就不相同。
13.答案:A。
解析:两份营养液,配方不同。但仔细一算,各离子的物质的量都相同:n(K+)= 0.7 mol;n(Cl-)= 0.3 mol;n(Zn2+)= 0.1 mol;n(SO42-)= 0.3 mol;溶于水后所得营养液中各离子的浓度自然完全相同。选A。
14.答案:D。
解析:根据阿伏加德罗定律,在标准状况下,气体的体积比等于其物质的量之比,而质量相同的前提下,物质的量与其摩尔质量成反比。由此看来,上述气体占有体积由大到小的顺序实际上是摩尔质量由小到大的顺序。显然,D正确。
15.答案:A。
解析:根据阿伏加德罗定律,在一定温度、压强下,气体的体积比等于其分子数之比,也就是等于化学方程式中的计量数之比。现设此反应的方程式为:X2 + 3Y2 = 2 XaYb,再根据质量守定律得:a = 1,b = 3。A正确。
16.答案:A2B,推断的依据是阿伏加德罗定律和质量守恒定律。
解析:题目给出的已知条件有两个:一是根据反应物分子式可知它们都是双原子分子;二是在相同条件下各反应物和生成物气体的体积比A2∶B2∶AxBy = 100∶50∶100=2∶1∶2。根据阿伏加德罗定律,这个体积比就是该反应的化学方程式中各反应物和生成物的系数比,即2A2+B2=2AxBy。再结合质量守恒定律(反应前后各种原子的个数不变),就能推出:2x=2×2,x=2;2y=2,y=1。
17.答案:①X:H Y:O Z:Cl ②HCl H2O
解析:氢气在氯气中燃烧生成氯化氢,火焰为苍白色。氯化氢易溶于水,其水溶液可使蓝色石蕊试纸变红。氯气溶于水形成氯水,其中的次氯酸具有漂白性。
18.答案:(1)小试管和酒精灯
(2)将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住试管口,移近酒精灯,松开拇指点燃试管中的气体。
(3)钠浮在水面上熔化成闪亮的小球,迅速游动,并逐渐消失,水溶液由无色变成红色。点燃小试管中的气体时,有尖锐的爆鸣声。
解析: ⑴由于实验目的是做钠与水反应实验,并验证钠的物理性质及证明钠与水反应的产物是什么,所以要收集产生的气体,并验证气体的可燃性,故还需用小试管和酒精灯。
⑵要由钠和水反应来验证钠的物理性质,使自由的钠块与水接触,就要想办法让钠块落入水中。将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住试管口,移近酒精灯,松开拇指点燃试管中的气体。
⑶观察到的现象是:钠浮在水面上熔化成闪亮的小球,迅速游动,并逐渐消失,水溶液由无色变成红色。点燃小试管中的气体时,有尖锐的爆鸣声。
19.答案:(1)5.3 (2)搅拌;引流
(3)A 偏高 B 偏低 C 偏低
解析:(1)n(Na2CO3)= c(Na2CO3)×V(Na2CO3)= 0.2mol·L-1×0.25L = 0.05 mol
m(Na2CO3)= n(Na2CO3)×M(Na2CO3)= 0.05 mol×106 g/mol = 5.3 g
(2)玻璃棒是中学化学实验中常用的仪器,在第②步中,用玻璃棒搅拌,可加速Na2CO3固体的溶解;在第③步中,用玻璃棒引流,可防止Na2CO3溶液流到容量瓶外。
(3)所有的的定量实验都存在一个“误差”的问题,在本实验的误差分析中,一定要紧扣物质的量浓度的定义式,即c = n / V。如果在第⑧步观察液面时俯视,V偏小,结果偏高;如果没有进行操作步骤④和⑤,n偏小,结果偏低;如果在第⑤步不慎有少量液体流到容量瓶外,n偏小,结果偏低。
20.答案:(1)200mL (2)200mL
解析:(1)
Zn + 2HCl = ZnCl2 + H2↑
2 mol 22.4L
n(HCl) 4.48L
n(HCl)= 4.48L÷22.4L×2 mol =0.4 mol
V(HCl)= n(HCl)÷c(HCl)= 0.4 mol÷2.0mol·L-1 = 0.2L = 200mL
(2)
Zn + 2HCl = ZnCl2 + H2↑
73g 22.4L
m(HCl) 4.48L
m(HCl)= 4.48L÷22.4L×73 g =14.6 g
V(HCl)= m(HCl)÷W(HCl)÷ρ(HCl)= 14.6 g÷7% ÷1.043g·mL-1 = 200mL
提示:(1)、(2)小题结果相同,请体会哪种浓度表示方法更方便?
21.答案:378体积
解析:1.00 L该氨水中含氨的质量为: 12.0mol×17.0g·mol-1
其体积在标准状况下为:12.0mol×22.4L·mol-1
1.00L该氨水中含水的质量为:1.00L×915g·L-1-12.0mol×17.0g·mol-1
其体积为(1.00L×915g·L-1-12.0mol×17.0g·mol-1)/1000g·L-1
VNH3/VH2O=(12.0 mol×22.4 L·mol-1)/[(1.00L×915 g·L-1-12.0 mol×17.0g·mol-1)/1000 g·L-1]=378
1体积水吸收378体积NH3气(标准状况)。
若直接列出总式也可:
VNH3/VH2O=(12.0 mol×22.4 L·mol-1)/[(1.00L×915 g·L-1-12.0 mol×17.0g·mol-1)/1000 g·L-1]=378
1体积水吸收378体积NH3气(标准状况)。
