化学课件:《元素周期律》(2)(新人教版必修2)
文档属性
| 名称 | 化学课件:《元素周期律》(2)(新人教版必修2) |  | |
| 格式 | rar | ||
| 文件大小 | 316.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-01-14 17:31:00 | ||
图片预览







文档简介
课件32张PPT。第五章 物质结构 元素周期律第二节 元素周期律教学目标1。使学生了解原子核外电子排布、原子半径、主要化合价与元素金属性、非金属性的周期性变化。
2。了解两性氧化物和两性氢氧化物的概念。
3。认识元素性质的周期性变化是元素原子核外电子排布周期性变化的结果,从而理解元素周期律的实质。
4。培养学生分析问题、总结归纳、发现规律的能力。问题思考:人类已经发现了一百多种元素,而各种元素的种类又是由该元素原子内部的核电荷数即质子数决定的,那么,核电荷数不同的各种元素之间的关系是相互关系又是怎样的呢?
碱金属元素有哪些性质?各自有何不同?
卤素有哪些性质?又各自有何不同?新课导入
发现元素周期律的
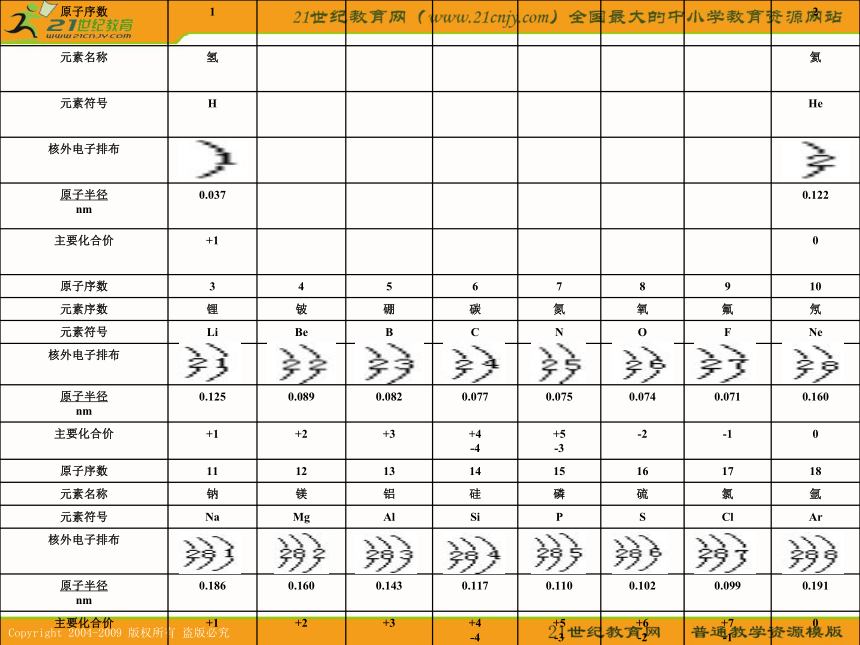
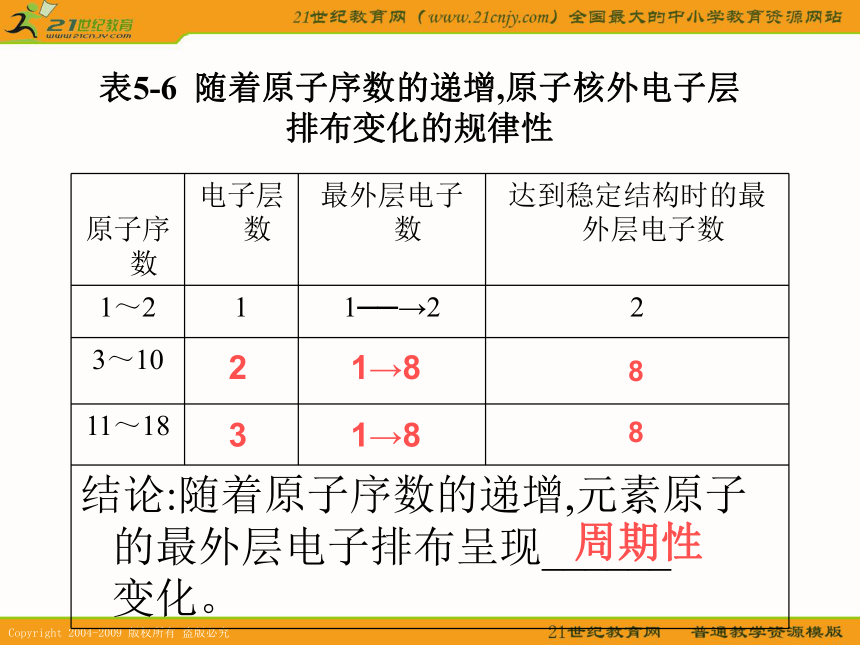
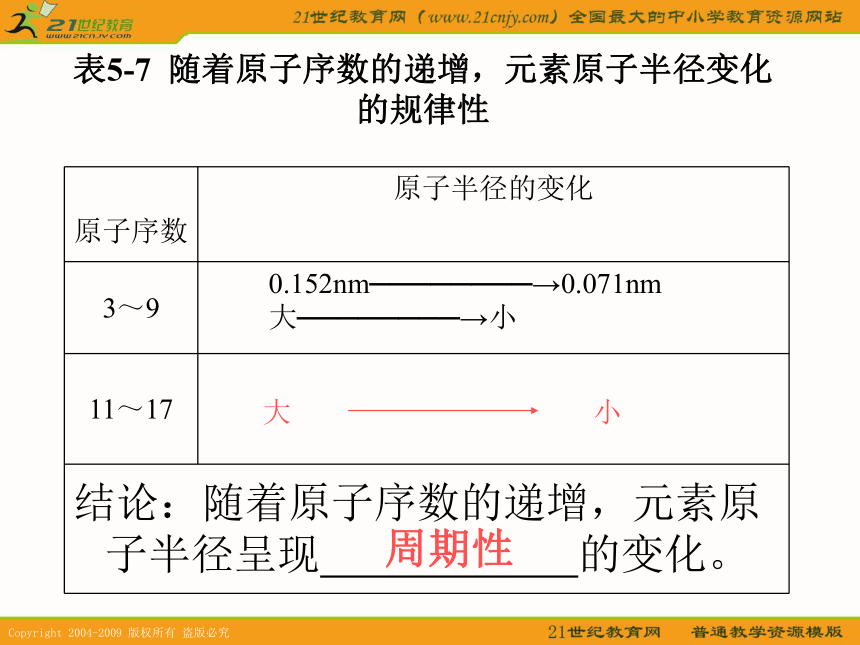
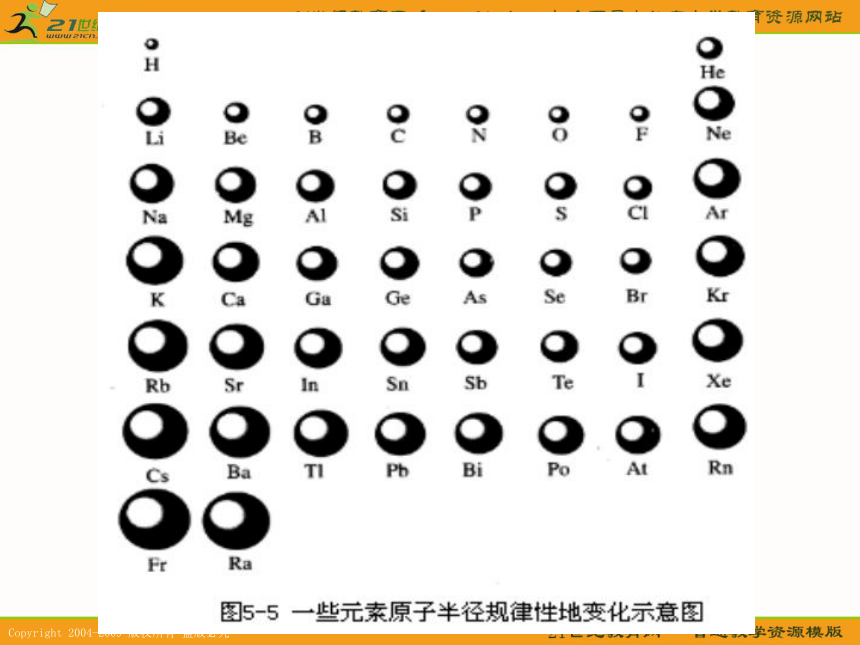
科学家表5-6? 随着原子序数的递增,原子核外电子层排布变化的规律性周期性881→81→823表5-7? 随着原子序数的递增,元素原子半径变化的规律性周期性问题:怎样根据粒子结构示意图来判断原子半径和简单离子半径的大小???1。当电子层数及核电荷数均不同时,电子层数越多的,半径越大。
2。当电子层数相同,核电荷数不同时,核电荷数越大,半径越小。
3。当核电荷数相同,电子层数也相同时。核外电子数越多的,半径越大。规律请大家根据以上的结论,判断下列粒子的半径大小(1)F Cl
(2)Cl S P
(3)Na+ Mg 2+ Al 3+
(4)Cl- S2-<><<><下列粒子半径之比大于1的是
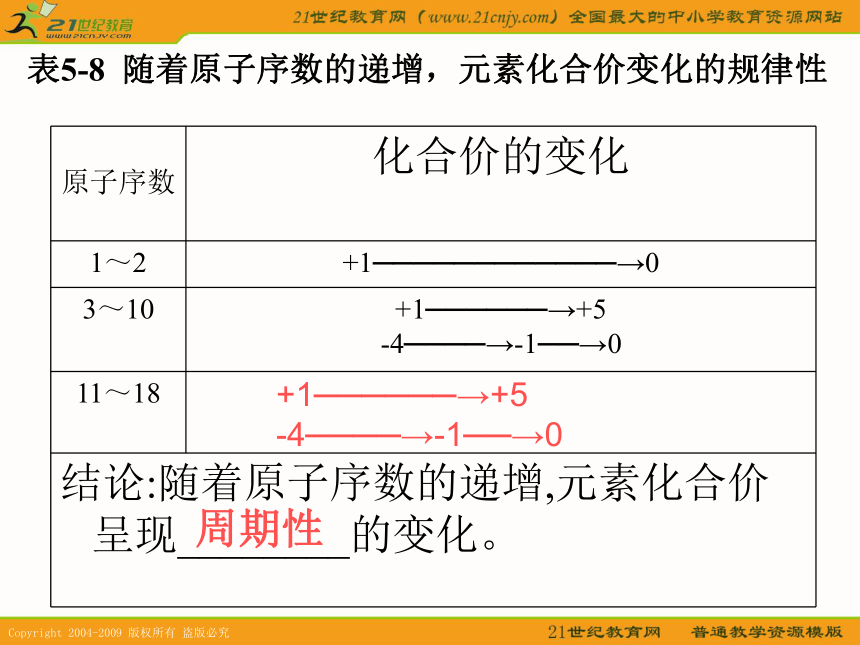
A.K+/K B.Ca/Mg C.P/S D.Cl/Cl-答案:BC表5-8? 随着原子序数的递增,元素化合价变化的规律性+1──────→+5
-4────→-1──→0周期性元素化学性质与原子结构的关系Mg+2HCl=MgCl2+H2↑稀盐酸2Al+6HCl=2AlCl3+3H2↑AlCl3+3NaOH=Al(OH)3↓+3NaCl
2Al(OH)3+3H2SO4=Al2(SO4)3+6H2OAl(OH)3+NaOH=NaAlO2+2H2O表5-9? 钠、镁、铝的性质比较金属性:Na>Mg>Al碱性强弱:NaOH>Mg(OH)2>Al(OH)3表5-10? 硅、磷、硫、氯的性质比较非金属性:Si<P<S<Cl 氢化物稳定性:SiH4<PH3<H2S<HCl酸性强弱:H4SiO4 <H3PO4< H2SO4 <HClO4稀有气体元素金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强综上所述,我们可以从11~18号元素性质的变化中得出如下的结论: 元素化学性质与原子结构的关系随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
元素化合价呈现周期性变化元素的化学性质呈现周期性变化 元素的性质随着元素原子序数的递增而呈现周期性的变化—元素周期律 元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。 元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。练习: 下列递变情况 的是:
A. Na、Mg、Al最外层电子数依次增多,其单
质的还原性依次减弱
B. P、S、Cl最高正价依次升高,对应气态氢化
物稳定性增强
C. C、N、O原子半径依次增大
D. Na、K、Rb氧化物的水化物碱性依次增强不正确 C 同一横行X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断 的是
A. 阴离子半径 X > Y > Z
B. 气态氢化物稳定性 HX > H2Y > ZH3
C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z错误 A用元素符号回答原子序数11-18号的元素的有关问题(课本P103—1) (1)除稀有气体外,原子半径最大的是 (2)最高价氧化物的水化物碱性最强的是 (3)最高价氧化物的水化物呈两性的是 (4)最高价氧化物的水化物酸性最强的是 (5)能形成气态氢化物且最稳定的是答案:(1)Na (2)Na
(3)Al (4)Cl (5)Cl问题与讨论原子序数与原子核外电子排布变化的关系?
原子序数与元素原子半径变化的关系?
原子序数与元素化合价变化的关系?思考讨论1.能否说:“质子数即核电荷数,也就是原子序数。” 小 结随着原子序数的递增,元素的最外层电子排布呈现周期性的变化。
随着原子序数的递增,元素原子半径呈现周期性的变化。
随着原子序数的递增,元素化合价呈现周期性的变化。启 思原子是由什么构成的?
原子半径的大小与哪些因素有关?小 结原子由质子、中子、和电子构成。
原子半径与以下三者有关:
电子层数、原子核对核外电子的吸引力、核外电子相互间的排斥力
2。了解两性氧化物和两性氢氧化物的概念。
3。认识元素性质的周期性变化是元素原子核外电子排布周期性变化的结果,从而理解元素周期律的实质。
4。培养学生分析问题、总结归纳、发现规律的能力。问题思考:人类已经发现了一百多种元素,而各种元素的种类又是由该元素原子内部的核电荷数即质子数决定的,那么,核电荷数不同的各种元素之间的关系是相互关系又是怎样的呢?
碱金属元素有哪些性质?各自有何不同?
卤素有哪些性质?又各自有何不同?新课导入
发现元素周期律的
科学家表5-6? 随着原子序数的递增,原子核外电子层排布变化的规律性周期性881→81→823表5-7? 随着原子序数的递增,元素原子半径变化的规律性周期性问题:怎样根据粒子结构示意图来判断原子半径和简单离子半径的大小???1。当电子层数及核电荷数均不同时,电子层数越多的,半径越大。
2。当电子层数相同,核电荷数不同时,核电荷数越大,半径越小。
3。当核电荷数相同,电子层数也相同时。核外电子数越多的,半径越大。规律请大家根据以上的结论,判断下列粒子的半径大小(1)F Cl
(2)Cl S P
(3)Na+ Mg 2+ Al 3+
(4)Cl- S2-<><<><下列粒子半径之比大于1的是
A.K+/K B.Ca/Mg C.P/S D.Cl/Cl-答案:BC表5-8? 随着原子序数的递增,元素化合价变化的规律性+1──────→+5
-4────→-1──→0周期性元素化学性质与原子结构的关系Mg+2HCl=MgCl2+H2↑稀盐酸2Al+6HCl=2AlCl3+3H2↑AlCl3+3NaOH=Al(OH)3↓+3NaCl
2Al(OH)3+3H2SO4=Al2(SO4)3+6H2OAl(OH)3+NaOH=NaAlO2+2H2O表5-9? 钠、镁、铝的性质比较金属性:Na>Mg>Al碱性强弱:NaOH>Mg(OH)2>Al(OH)3表5-10? 硅、磷、硫、氯的性质比较非金属性:Si<P<S<Cl 氢化物稳定性:SiH4<PH3<H2S<HCl酸性强弱:H4SiO4 <H3PO4< H2SO4 <HClO4稀有气体元素金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强综上所述,我们可以从11~18号元素性质的变化中得出如下的结论: 元素化学性质与原子结构的关系随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
元素化合价呈现周期性变化元素的化学性质呈现周期性变化 元素的性质随着元素原子序数的递增而呈现周期性的变化—元素周期律 元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。 元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。练习: 下列递变情况 的是:
A. Na、Mg、Al最外层电子数依次增多,其单
质的还原性依次减弱
B. P、S、Cl最高正价依次升高,对应气态氢化
物稳定性增强
C. C、N、O原子半径依次增大
D. Na、K、Rb氧化物的水化物碱性依次增强不正确 C 同一横行X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断 的是
A. 阴离子半径 X > Y > Z
B. 气态氢化物稳定性 HX > H2Y > ZH3
C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z错误 A用元素符号回答原子序数11-18号的元素的有关问题(课本P103—1) (1)除稀有气体外,原子半径最大的是 (2)最高价氧化物的水化物碱性最强的是 (3)最高价氧化物的水化物呈两性的是 (4)最高价氧化物的水化物酸性最强的是 (5)能形成气态氢化物且最稳定的是答案:(1)Na (2)Na
(3)Al (4)Cl (5)Cl问题与讨论原子序数与原子核外电子排布变化的关系?
原子序数与元素原子半径变化的关系?
原子序数与元素化合价变化的关系?思考讨论1.能否说:“质子数即核电荷数,也就是原子序数。” 小 结随着原子序数的递增,元素的最外层电子排布呈现周期性的变化。
随着原子序数的递增,元素原子半径呈现周期性的变化。
随着原子序数的递增,元素化合价呈现周期性的变化。启 思原子是由什么构成的?
原子半径的大小与哪些因素有关?小 结原子由质子、中子、和电子构成。
原子半径与以下三者有关:
电子层数、原子核对核外电子的吸引力、核外电子相互间的排斥力
