化学课件:《元素周期律》(3)(新人教版必修2)
文档属性
| 名称 | 化学课件:《元素周期律》(3)(新人教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 391.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-01-14 00:00:00 | ||
图片预览







文档简介
课件28张PPT。元素周期律一.原 子 结 构1、原子结构原子
原子核核外电子电子层=周期数中子-决定元素的同位素决定质量数
(近似原子量)决定元素的性质质子-决定元素种类最外层电子数=主族序数
2、原子结构的表示方法(1)原子结构示意图(2)原子组成表示式原子( )中,质子有__个,中子有__个,核外电子有___个。 ZA-ZZ质子数+中子数核电荷数=核外电子数A
Z X 3、相互关系
(1)??质量数=
(2)??原子中:质子数=
(3)??阳离子中:
质子数=
(4)?阴离子中:
质子数=核电荷数=离子的核外电子数+离子电荷数 A
Z X 核电荷数=离子的核外电子数-离子电荷数 电子层
划分概念:
符号:
电子层数:
能量:
离核距离:1)每个电子层最多排2n2个电子
2)最外层? 8个电子,次外层? 18个电子,倒第三层? 32
3)先排能量低的电子层,后排能量高的电子层要求:会画1~20号元素原子及离子结构示意图能量高低不同和离核远近不同的空间区域K L M N O P Q1 2 3 4 5 6 7低—————————高近—————————远核外电子排布规律4.核外电子排布规律据报道,某些建筑材料会产生放射性同位素
从而对人体产生伤害。该同位素原子的 中子数和质子数之差是( )
A.136 B.50 C.86 D.222222
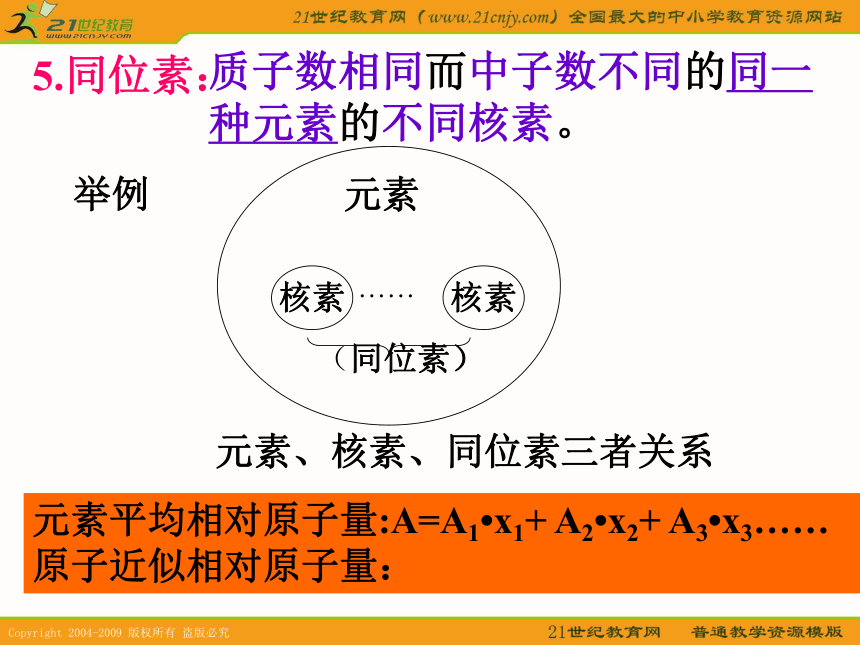
86RnB5.同位素:举例元素平均相对原子量:A=A1?x1+ A2?x2+ A3?x3……
原子近似相对原子量:质子数相同而中子数不同的同一
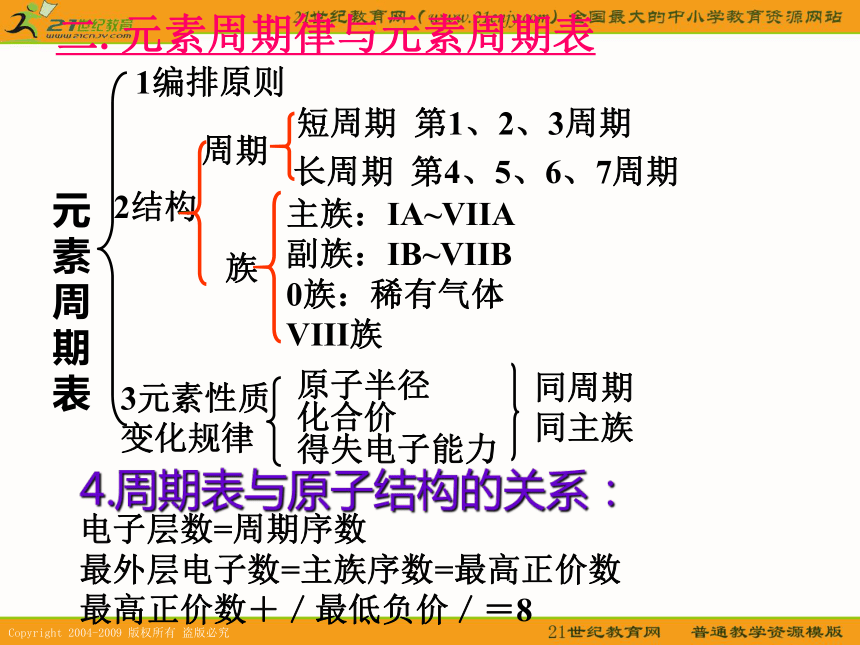
种元素的不同核素。B1编排原则2结构3元素性质变化规律原子半径
化合价
得失电子能力同周期
同主族电子层数=周期序数
最外层电子数=主族序数=最高正价数
最高正价数+/最低负价/=8周期族短周期 第1、2、3周期长周期 第4、5、6、7周期主族:IA~VIIA
副族:IB~VIIB
0族:稀有气体
VIII族4.周期表与原子结构的关系:二.元素周期律与元素周期表(05全国卷Ⅱ)下列说法正确的是 A.常温常压下,只有一种元素的单质 呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
D概念:
规律:
主要化合价:
原因:元素周期律金属性、非金属性、还原性、氧化性、氢化物稳定性、最高价氧化物的水化物酸碱性元素的性质(原子半径、主要化合价)随着原子序数的递增而呈周期性的变化原子半径同周期从左到右渐小,同主族从上到下渐大。
+1 +2 +3 +4 +5 +6 +7 0 -4 -3 -2 -1核外电子排布随着原子序数的递增而呈周期性的变化 (1~8) 某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A. HX B. H2X C. XH3 D. XH4B 2、元素的性质与元素在周期表中位置的关系 同一主族元素,结构相似,性质相似Na
11钠Li
3锂K
19钾Rb
37铷Cs
55铯最外层电子数____
从上到下 核电核数_____
电子层数______
原子半径______
原子核对最外层电子吸引力_____
失电子能力_____
还原性______金属性_____
得电子能力_____
氧化性______非金属性______F
9氟Cl
17氯Br
35溴I
53碘At
85砹相同增多增多增大减弱 增强增强增强减弱 减弱 减弱
同一周期元素(稀有气体除外)同一周期,电子层数_______
从左到右,金属性逐渐_______非金属性逐渐______
金属性越强,最高价氧化物对应水化物碱性_______
非金属性:______
最高价氧化物对应水化物酸性_____
单质与氢气反应条件越______
生成的氢化物稳定性______相同减弱增强越强越强越容易越强越强 同周期的三种元素X、Y、Z,已知它们的最高价含氧酸的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列叙述正确的是( )
A.非金属性X>Y>Z
B. X、Y、Z形成的阴离子还原性逐渐增强
C.原子半径X>Y>Z
D. X、Y、Z的气态氢化物稳定性由弱到强AB小结:元素金属性和非金属性的递变金属性逐渐增强族周期IA IIA IIIA IVA VA VIA VIIA O非金属性逐渐增强非金属性逐渐增强金属性逐渐增强 1 2 3 4 5 6 7BSiAlGeAsSbTePoAt小结:元素金属性和非金属性的判断依据金属性和非金属性强弱判断依据 1、金属性强弱的判断依据: (1) 。(2) 。(3) 。金属单质与水或者酸反应快慢 最高价氧化物的水化物的碱性强弱 金属与盐溶液发生的金属间的置换反应 2、非金属性强弱判断依据:
(1) 。
(2) 。
(3) 。
(4) 。 非金属 单质与氢气反应的难易 气态氢化物的稳定性强弱 最高化氧化物的水化物的酸性强弱 非金属单质间的置换反应 原子结构周期表位置元素性质最外层电子数=主族最高正价数
电子层结构、原子半径决定得失电子的难易、氧化性、还原性同位同化性;左右递变性;上下相似性质子数=原子序数
电子层数=周期序数
最外层电子数=主族序数1.主要化合价
2.最高价氧化物及其水化物的组成
3.氢化物组成1.金属性与非金属性
2.“最高价氧化物的水化物”的酸碱性
3.氢化物的稳定性相似性递变性2、“位——构——性”之间的关系(三)周期表的应用
A.推断元素位置、结构和性质 右图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数。B原子核内质子数和中子数相等。下面叙述中不正确的是
A、三种元素的原子半径的
大小顺序是B<A<C
B、A元素最高价氧化物的对应水
化物具有强氧化性和不稳定性
C、B元素的氧化物、氢化物的水溶液都呈酸性
D、C元素的单质是非金属单质中唯一能跟水激
烈反应的单质B比较或推断一些性质比较同族元素的 金属性 Ba>Ca>Mg
非金属性 F>Cl>Br
最高价氧化物的水化物的酸碱性 KOH>NaOH>LiOH
氢化物的稳定性 CH4>SiH4
比较同周期元素及其化合物的性质
碱性: NaOH>Mg(OH)2>Al(OH)3
稳定性: HF>H2O>NH3
比较不同周期元素的性质(先找出与其同周期元素参照)
推断一些未知元素及其化合物的性质
三、化学键:化学键离子键 形成离子化合物共价键 极性键 非极性键 金属键 思考:原子间为什么能相互结合?物质中相邻的两个或多个原子(或离子)之间强烈的相互作用,称为化学键。1、离子键(1)定义:带相反电荷的离子间形成的相互作用叫做离子键.成键的微粒: 成键的本质(作用力):静电作用(吸引和排斥)阴离子、阳离子(2)离子化合物: 一般来说活泼金属 和活泼非金属 之间可形成离子化合物(简单离子化合物)。通过离子键而形成的化合物IA 和 IIA族 VIA和VIIA族(3)离子化合物形成过程的表示—电子式 在元素符号周围用小黑点(或x)表示
原子的最外层电子的式子。①原子的电子式:②阳离子的电子式:③阴离子的电子式 ④离子化合物的电子式NaCl、CaO、CaCl2、Na2O、Mg3N2、Na2O2、NH4Cl、Ca(OH)2问题1:哪些元素之间能形成共价键?同种或不同种非金属元素之间一般能形成共价键。(1)定义:原子间通过共用电子对而
形成的化学键。2、共价键(2)、极性键和非极性键:据共用电子对是否发生偏移,把共价键分为极性共价键和非极性共价键。简称极性键和非极性键。两个不同原子间的共价键都是极性键
两个相同的原子间的共价键都是非极性键(4)共价化合物的电子式表示
共价化合物的形成过程的电子式表示
H2、 N2 、HCl、H2O、H2S、CH4、CCl4、CO2、NH3、Cl2、H2O2、 HClO(3)共价化合物:只含有共价键的化合物非金属元素之间一般能形成共价化合物(除铵盐)。离子化合物一定含离子键共价化合物一定不含离子键 离子化合物可能含共价键 离子化合物可能含极性共价键 离子化合物可能含非极性共价键 3、化合物类型与化学键H:+B 四、分子间作用力分子间作用力存在于分子之间,比化学键弱的多。分子间作用力对物质的熔点、沸 点、溶解度等影响很大。分子间的作用力不是化学键。即F2
原子核核外电子电子层=周期数中子-决定元素的同位素决定质量数
(近似原子量)决定元素的性质质子-决定元素种类最外层电子数=主族序数
2、原子结构的表示方法(1)原子结构示意图(2)原子组成表示式原子( )中,质子有__个,中子有__个,核外电子有___个。 ZA-ZZ质子数+中子数核电荷数=核外电子数A
Z X 3、相互关系
(1)??质量数=
(2)??原子中:质子数=
(3)??阳离子中:
质子数=
(4)?阴离子中:
质子数=核电荷数=离子的核外电子数+离子电荷数 A
Z X 核电荷数=离子的核外电子数-离子电荷数 电子层
划分概念:
符号:
电子层数:
能量:
离核距离:1)每个电子层最多排2n2个电子
2)最外层? 8个电子,次外层? 18个电子,倒第三层? 32
3)先排能量低的电子层,后排能量高的电子层要求:会画1~20号元素原子及离子结构示意图能量高低不同和离核远近不同的空间区域K L M N O P Q1 2 3 4 5 6 7低—————————高近—————————远核外电子排布规律4.核外电子排布规律据报道,某些建筑材料会产生放射性同位素
从而对人体产生伤害。该同位素原子的 中子数和质子数之差是( )
A.136 B.50 C.86 D.222222
86RnB5.同位素:举例元素平均相对原子量:A=A1?x1+ A2?x2+ A3?x3……
原子近似相对原子量:质子数相同而中子数不同的同一
种元素的不同核素。B1编排原则2结构3元素性质变化规律原子半径
化合价
得失电子能力同周期
同主族电子层数=周期序数
最外层电子数=主族序数=最高正价数
最高正价数+/最低负价/=8周期族短周期 第1、2、3周期长周期 第4、5、6、7周期主族:IA~VIIA
副族:IB~VIIB
0族:稀有气体
VIII族4.周期表与原子结构的关系:二.元素周期律与元素周期表(05全国卷Ⅱ)下列说法正确的是 A.常温常压下,只有一种元素的单质 呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
D概念:
规律:
主要化合价:
原因:元素周期律金属性、非金属性、还原性、氧化性、氢化物稳定性、最高价氧化物的水化物酸碱性元素的性质(原子半径、主要化合价)随着原子序数的递增而呈周期性的变化原子半径同周期从左到右渐小,同主族从上到下渐大。
+1 +2 +3 +4 +5 +6 +7 0 -4 -3 -2 -1核外电子排布随着原子序数的递增而呈周期性的变化 (1~8) 某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A. HX B. H2X C. XH3 D. XH4B 2、元素的性质与元素在周期表中位置的关系 同一主族元素,结构相似,性质相似Na
11钠Li
3锂K
19钾Rb
37铷Cs
55铯最外层电子数____
从上到下 核电核数_____
电子层数______
原子半径______
原子核对最外层电子吸引力_____
失电子能力_____
还原性______金属性_____
得电子能力_____
氧化性______非金属性______F
9氟Cl
17氯Br
35溴I
53碘At
85砹相同增多增多增大减弱 增强增强增强减弱 减弱 减弱
同一周期元素(稀有气体除外)同一周期,电子层数_______
从左到右,金属性逐渐_______非金属性逐渐______
金属性越强,最高价氧化物对应水化物碱性_______
非金属性:______
最高价氧化物对应水化物酸性_____
单质与氢气反应条件越______
生成的氢化物稳定性______相同减弱增强越强越强越容易越强越强 同周期的三种元素X、Y、Z,已知它们的最高价含氧酸的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列叙述正确的是( )
A.非金属性X>Y>Z
B. X、Y、Z形成的阴离子还原性逐渐增强
C.原子半径X>Y>Z
D. X、Y、Z的气态氢化物稳定性由弱到强AB小结:元素金属性和非金属性的递变金属性逐渐增强族周期IA IIA IIIA IVA VA VIA VIIA O非金属性逐渐增强非金属性逐渐增强金属性逐渐增强 1 2 3 4 5 6 7BSiAlGeAsSbTePoAt小结:元素金属性和非金属性的判断依据金属性和非金属性强弱判断依据 1、金属性强弱的判断依据: (1) 。(2) 。(3) 。金属单质与水或者酸反应快慢 最高价氧化物的水化物的碱性强弱 金属与盐溶液发生的金属间的置换反应 2、非金属性强弱判断依据:
(1) 。
(2) 。
(3) 。
(4) 。 非金属 单质与氢气反应的难易 气态氢化物的稳定性强弱 最高化氧化物的水化物的酸性强弱 非金属单质间的置换反应 原子结构周期表位置元素性质最外层电子数=主族最高正价数
电子层结构、原子半径决定得失电子的难易、氧化性、还原性同位同化性;左右递变性;上下相似性质子数=原子序数
电子层数=周期序数
最外层电子数=主族序数1.主要化合价
2.最高价氧化物及其水化物的组成
3.氢化物组成1.金属性与非金属性
2.“最高价氧化物的水化物”的酸碱性
3.氢化物的稳定性相似性递变性2、“位——构——性”之间的关系(三)周期表的应用
A.推断元素位置、结构和性质 右图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数。B原子核内质子数和中子数相等。下面叙述中不正确的是
A、三种元素的原子半径的
大小顺序是B<A<C
B、A元素最高价氧化物的对应水
化物具有强氧化性和不稳定性
C、B元素的氧化物、氢化物的水溶液都呈酸性
D、C元素的单质是非金属单质中唯一能跟水激
烈反应的单质B比较或推断一些性质比较同族元素的 金属性 Ba>Ca>Mg
非金属性 F>Cl>Br
最高价氧化物的水化物的酸碱性 KOH>NaOH>LiOH
氢化物的稳定性 CH4>SiH4
比较同周期元素及其化合物的性质
碱性: NaOH>Mg(OH)2>Al(OH)3
稳定性: HF>H2O>NH3
比较不同周期元素的性质(先找出与其同周期元素参照)
推断一些未知元素及其化合物的性质
三、化学键:化学键离子键 形成离子化合物共价键 极性键 非极性键 金属键 思考:原子间为什么能相互结合?物质中相邻的两个或多个原子(或离子)之间强烈的相互作用,称为化学键。1、离子键(1)定义:带相反电荷的离子间形成的相互作用叫做离子键.成键的微粒: 成键的本质(作用力):静电作用(吸引和排斥)阴离子、阳离子(2)离子化合物: 一般来说活泼金属 和活泼非金属 之间可形成离子化合物(简单离子化合物)。通过离子键而形成的化合物IA 和 IIA族 VIA和VIIA族(3)离子化合物形成过程的表示—电子式 在元素符号周围用小黑点(或x)表示
原子的最外层电子的式子。①原子的电子式:②阳离子的电子式:③阴离子的电子式 ④离子化合物的电子式NaCl、CaO、CaCl2、Na2O、Mg3N2、Na2O2、NH4Cl、Ca(OH)2问题1:哪些元素之间能形成共价键?同种或不同种非金属元素之间一般能形成共价键。(1)定义:原子间通过共用电子对而
形成的化学键。2、共价键(2)、极性键和非极性键:据共用电子对是否发生偏移,把共价键分为极性共价键和非极性共价键。简称极性键和非极性键。两个不同原子间的共价键都是极性键
两个相同的原子间的共价键都是非极性键(4)共价化合物的电子式表示
共价化合物的形成过程的电子式表示
H2、 N2 、HCl、H2O、H2S、CH4、CCl4、CO2、NH3、Cl2、H2O2、 HClO(3)共价化合物:只含有共价键的化合物非金属元素之间一般能形成共价化合物(除铵盐)。离子化合物一定含离子键共价化合物一定不含离子键 离子化合物可能含共价键 离子化合物可能含极性共价键 离子化合物可能含非极性共价键 3、化合物类型与化学键H:+B 四、分子间作用力分子间作用力存在于分子之间,比化学键弱的多。分子间作用力对物质的熔点、沸 点、溶解度等影响很大。分子间的作用力不是化学键。即F2
