化学课件:《元素周期律》(6)(新人教版必修2)
文档属性
| 名称 | 化学课件:《元素周期律》(6)(新人教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 851.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-01-14 00:00:00 | ||
图片预览


文档简介
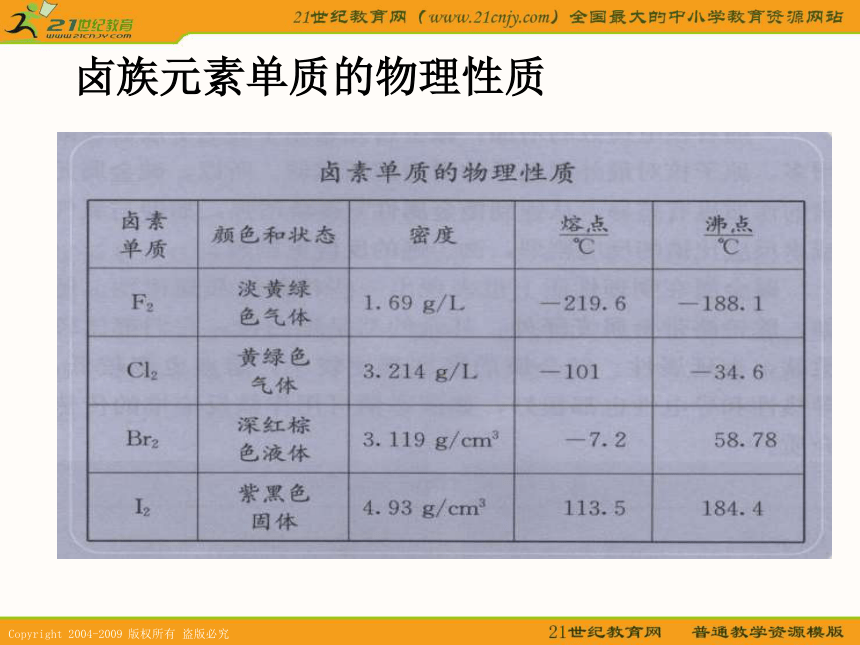
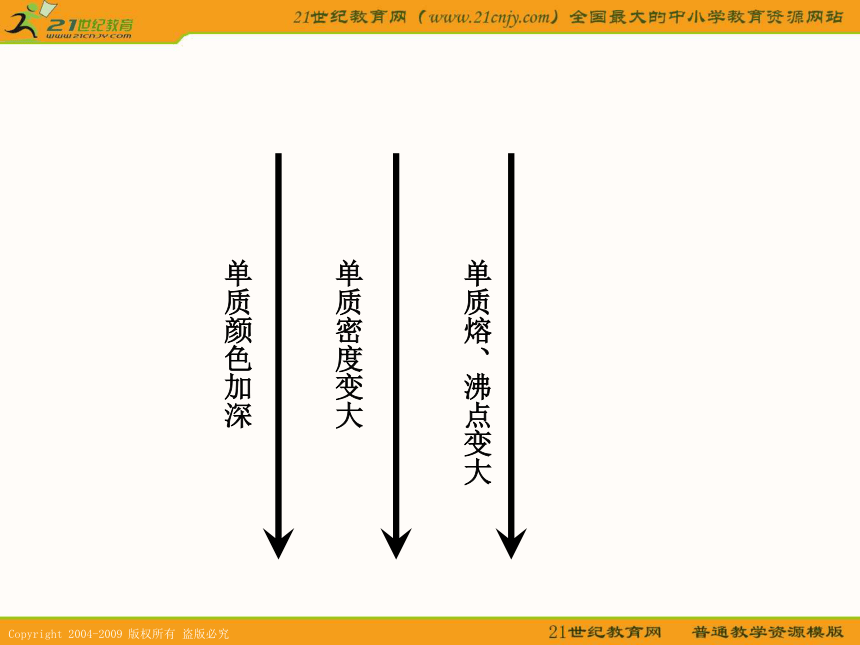
课件11张PPT。水卤族元素单质的物理性质单质颜色加深单质密度变大单质熔、沸点变大结论:
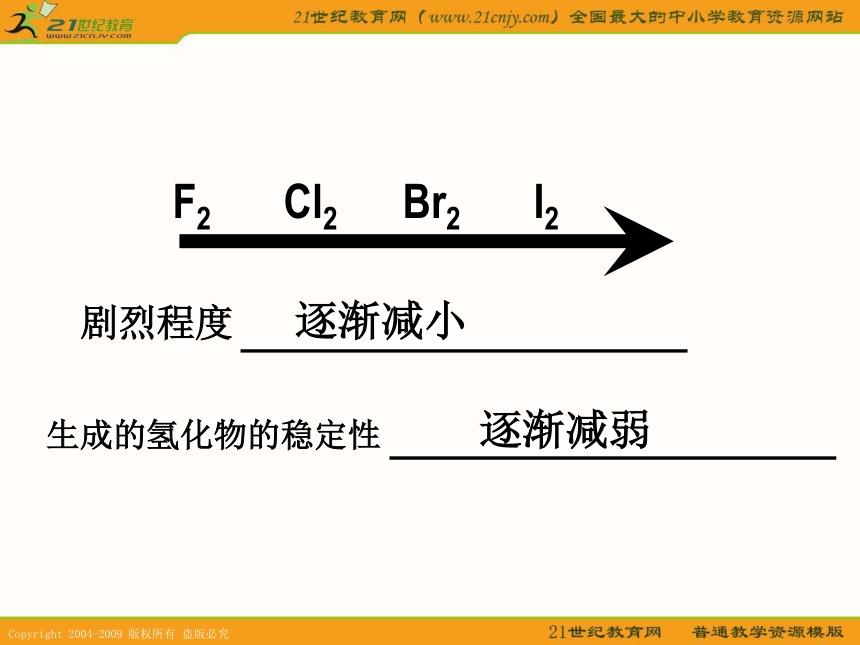
1、卤素单质与H2反应的剧烈程度:F2>Cl2>Br2>I2
2 、生成氢化物的稳定性:逐渐减弱.
即氢化物稳定性次序为 HF>HCl>HBr>HI
F2 Cl2 Br2 I2 剧烈程度逐渐减小生成的氢化物的稳定性逐渐减弱元素非金属(得电子能力)的判断依据 元素单质与氢气反应的难易 (易 ~ 强 ) 气态氢化物的稳定性 (稳定~强) 元素
非金属性据此,我们可以很容易的判断出卤族元素随着
核电荷数的增加,非金属性逐渐减弱.(2)卤族元素单质之间的置换反应实验1:实验3:实验2:NaBr溶液和
新制氯水振荡后加入四氯化碳KI溶液和
新制氯水振荡后加入四氯化碳KI溶液和
溴水振荡后加入四氯化碳那么, Cl2与I2,Br2与I2比较,谁的氧化性更强?
你如何设计实验去检验?1、往盛有KI 溶液的试管中加入少量的四氯化碳。
2、再往试管中加入少量新制的饱和氯水,用力振荡后静置。
1、往盛有KI 溶液的试管中加入少量的四氯化碳。
2、再往试管中加入少量新制的溴水,用力振荡后静置。
静置后液体分为两层,上层液体颜色变浅,下层液体呈紫色。
静置后液体分为两层,上层液体颜色变浅,下层液体呈紫色。
化学方程式:2KI+Cl2=2KCl+I2,2KI+Br2=2KBr+I2氧化性:
Cl2>I2
氧化性:
Br2>I2
结论:氧化性强弱 Cl2>Br2>I2,
那么F2呢?你能从原子结构的角度去分析吗?
结论:随着核电荷数的增加,卤族单质氧化性强弱顺序为: F2>Cl2>Br2>I2得电子能力逐渐减弱非金属性逐渐减弱同主族的非金属元素,随着核电荷数的增加, 非金属性逐渐减弱,其单质的氧化性逐渐减弱。本节课小结通过这节课的学习你有些什么收获?判断元素金属性强弱的方法判断元素非金属性强弱的方法同主族元素随着核电荷数的增大,金属性逐渐增强,非金属性逐渐减弱。小 结
1、卤素单质与H2反应的剧烈程度:F2>Cl2>Br2>I2
2 、生成氢化物的稳定性:逐渐减弱.
即氢化物稳定性次序为 HF>HCl>HBr>HI
F2 Cl2 Br2 I2 剧烈程度逐渐减小生成的氢化物的稳定性逐渐减弱元素非金属(得电子能力)的判断依据 元素单质与氢气反应的难易 (易 ~ 强 ) 气态氢化物的稳定性 (稳定~强) 元素
非金属性据此,我们可以很容易的判断出卤族元素随着
核电荷数的增加,非金属性逐渐减弱.(2)卤族元素单质之间的置换反应实验1:实验3:实验2:NaBr溶液和
新制氯水振荡后加入四氯化碳KI溶液和
新制氯水振荡后加入四氯化碳KI溶液和
溴水振荡后加入四氯化碳那么, Cl2与I2,Br2与I2比较,谁的氧化性更强?
你如何设计实验去检验?1、往盛有KI 溶液的试管中加入少量的四氯化碳。
2、再往试管中加入少量新制的饱和氯水,用力振荡后静置。
1、往盛有KI 溶液的试管中加入少量的四氯化碳。
2、再往试管中加入少量新制的溴水,用力振荡后静置。
静置后液体分为两层,上层液体颜色变浅,下层液体呈紫色。
静置后液体分为两层,上层液体颜色变浅,下层液体呈紫色。
化学方程式:2KI+Cl2=2KCl+I2,2KI+Br2=2KBr+I2氧化性:
Cl2>I2
氧化性:
Br2>I2
结论:氧化性强弱 Cl2>Br2>I2,
那么F2呢?你能从原子结构的角度去分析吗?
结论:随着核电荷数的增加,卤族单质氧化性强弱顺序为: F2>Cl2>Br2>I2得电子能力逐渐减弱非金属性逐渐减弱同主族的非金属元素,随着核电荷数的增加, 非金属性逐渐减弱,其单质的氧化性逐渐减弱。本节课小结通过这节课的学习你有些什么收获?判断元素金属性强弱的方法判断元素非金属性强弱的方法同主族元素随着核电荷数的增大,金属性逐渐增强,非金属性逐渐减弱。小 结
