必修1期末复习课件
图片预览








文档简介
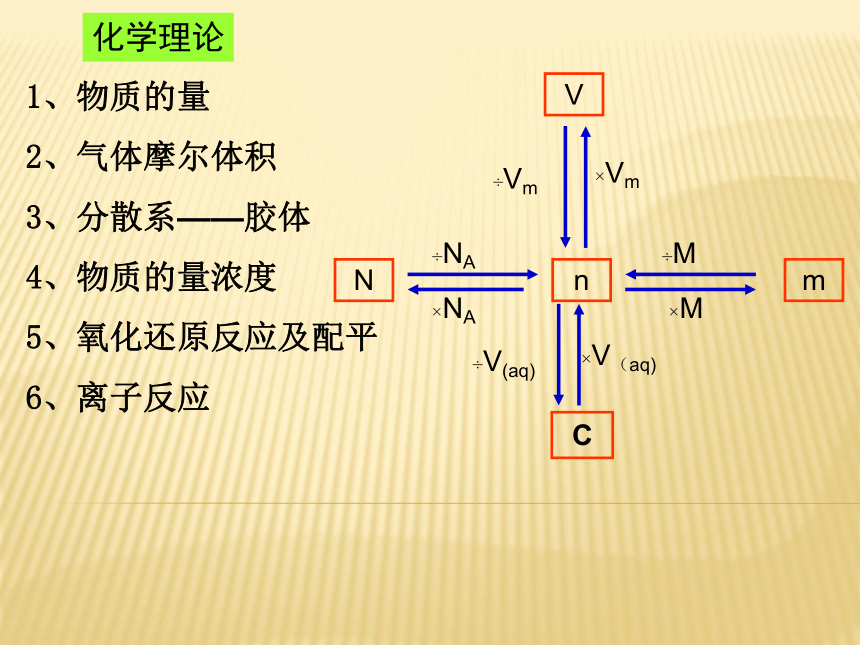
课件27张PPT。必修1复习必修1复习1、物质的量
2、气体摩尔体积
3、分散系——胶体
4、物质的量浓度
5、氧化还原反应及配平
6、离子反应化学理论得到电子,化合价降低,
被还原,发生还原反应失去电子,化合价升高,
被氧化,发生氧化反应氧化能力:氧化剂 > 氧化产物
还原能力:还原剂 > 还原产物
化学方程式的 配平步骤:标、定、算、平、查
技巧:完全变价看前面,部分变价看后面氧化还原反应1、离子反应:有离子参加的化学反应
离子反应发生的条件:生成难溶物质、挥发性的物质、难电离的物质,或者发生氧化还原反应
离子反应发生的本质:溶液中的离子浓度明显减少
2、离子反应方程式书写的步骤:
①写:写出正确的化学方程式
②拆:把溶于水且易电离的物质写成离子形式;难溶、难电离物写化学式,如单质、沉淀、气体、难电离物质、氧化物等。
③删:删去两边未反应的离子,
④查:质量守恒和电荷守恒。 离子反应1、原子结构模型的演变:道尔顿的近代原子学说、汤姆生的“葡萄干面包式”原子结构模型、卢瑟福的带核原子结构模型、玻尔的原子轨道模型、电子云模型
2、核外电子的运动特征和排布规律
3、原子的构成及各微粒间的关系
4、同位素及核素的涵义
把具有一定质子数和一定中子数的一种原子称为核素。
质子数相同而中子数不同的核素互称为同位素。
练1:某金属元素R原子的质量数为52,已知R离子含有28个中子,21个电子,由这种离子组成的化合物的化学式正确的是 ( )
A.RCl2 B.RO2 C.K2R2O7 D.R(NO3)3
练2:某X原子,质量为ag,求元素X的相对原子质量?物质结构1、氯、溴、碘及其化合物
氯气的制备 氯气的性质 溴、碘的提取
2、硅及其化合物
硅的性质 SiO2的性质及应用 硅酸盐及其产品
3、硫及其化合物
硫的性质 SO2的性质和作用 硫酸的制备和性质
含硫物质的相互转化
4、氮及其化合物
NOX的转化 氨和铵盐的性质 硝酸的性质
含氮物质的相互转化非金属元素及其化合物1、氯气的物理性质:在通常情况下,氯气是一种黄绿色、有刺激性气味的有毒气体;1体积水约能溶解2体积Cl2;但难溶于饱和食盐水。
2、氯气的化学性质:
与金属反应:
与非金属反应:
与水反应:
与碱反应:
卤族元素的置换:Cl2+H2O HCl+HClOCl2+2NaOH==NaCl+NaClO+H2O
2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O Cl2+2NaBr==2NaCl+Br2 Cl2+2Kl==2NaCl+I2 氯气性质1、Si的化学性质
常温下,Si只与碱、氟化氢、氟气反应;
高温时,Si能与浓硫酸、硝酸、氧气、氯气等强氧化性物质反应
2、SiO2的化学性质
常温下,SiO2能与碱、HF反应。其它物质一般不反应
高温时,SiO2能与碱性氧化物、某些盐发生反应
3、单质硅的提纯原理Si与SiO2的性质⑴S与H2等非金属单质反应
⑵S与金属单质反应
⑶S与碱反应2Na + S = Na2S⑷SO2是无色、有刺激性气味、有毒、易液化、比空气重、易溶于水(1:40)
⑸SO2具有酸性氧化的通性
⑹SO2既有氧化性,又有还原性
⑺SO2漂白性:生成不稳定的亚硫酸盐,加热后能复原A、与水反应生成酸: SO2 + H2O H2SO3
B、与碱反应生成盐和水:SO2 +2NaOH=Na2SO3+H2O2SO2 + O2 2SO32H2S+SO2=3S+2H2OS与SO2的性质(1)高沸点酸
(2)吸水性——做干燥剂化
(3)脱水性——使有机物脱水炭
(4)强氧化性①一般不产生氢气,而是产生硫的单质或化合物;
② Fe、Al常温下遇浓H2SO4会钝化H2S + H2SO4(浓) == S↓ + SO2↑ + 2H2O 硫酸性质1、氮气跟氧气的反应
2、氮气跟某些金属的反应
3、氮气跟氢气的反应(合成氨)2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO
合并:4NO + 3O2 + 2H2O = 4HNO3
合并:4NO2 + O2 + 2H2O = 4HNO3氮气及部分氧化物的性质无色、易挥发,有刺激性气味的液体;能与水任意比互溶
⑴硝酸酸性: HNO3 = H++NO3-
⑵强氧化性:
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O
①金属遇硝酸一般不产生H2;不活泼金属将浓硝酸还原成NO2,将稀硝酸还原成NO;活泼金属将硝酸还原成更低价态的N的化合物或单质;
②Al、Fe遇浓硝酸常温下生成致密氧化膜而发生钝化。硝酸性质1、钠和钠的化合物
钠的提取 钠的性质 Na2CO3和NaHCO3的性质对比
2、镁和镁的化合物
镁的提取 镁的性质
3、铝和铝的化合物
铝土矿中提取铝 Al2O3和Al(OH)3的性质 铝的性质
4、铜、铁和其化合物
常见的含铜、铁的矿物名称
铁的冶炼 铁的性质 铁盐的转化 金属及化合物的性质从海水中提取NaCl和MgCl2,海水晒盐得到NaCl
Mg2+→Mg(OH)2↓→MgCl2→Mg铝土矿主要成份是Al2O3,同时有少量的Fe2O3和SiO2 ,先提纯Al2O3,后电解得到铝:Al2O3+2NaOH=2NaAlO2+H2O
SiO2+2NaOH=Na2SiO3+H2O NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3 钠镁铝的提取及铁的冶炼银白色,光泽,固体,质轻、柔软
与非金属单质反应
与水反应
与酸反应
与盐反应4Na+O2==2Na2O (白色固体)2Na+2H2O==2NaOH+ H2↑
2Na+2HCl==2NaCl+ H2↑ 2Na+CuSO4+2H2O==Cu(OH)2↓+H2↑+Na2SO4 钠的性质银白色,光泽,固体,质轻
1、与非金属单质反应
2、与酸反应
3、与沸水反应
4、与CO2反应Mg+2H+=Mg2++H2↑镁的性质铝的化学性质:
1、与非金属单质反应
2、与酸反应
3、与碱反应
4、与金属氧化物反应2Al+ 6H+ = 2Al3+ + 3H2↑
2Al+2OH-+2H2O=2AlO2-+ 3H2↑铝的性质Na2CO3与NaHCO3的性质1、两性:Al2O3+2OH-=2AlO2-+H2O Al2O3+6H+=2Al3++3H2O
Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O
2、Al2O3高硬度、高熔点,可制作耐火材料。
3、Al(OH)3的制备
⑴氯化铝溶液中滴加氨水能制备Al(OH)3
⑵偏铝酸钠溶液中通入CO2气体能制备Al(OH)3
⑶偏铝酸钠和氯化铝物质的量之比3:1混合AlO2- +H++H2O Al(OH)3 Al3++3OH-Al2O3与Al(OH)3的性质FeFe3+①弱氧化剂:S、H+及金属活动性表中铁后面的金属离子
②强氧化剂:Cl2、Br2、浓H2SO4、HNO3、H2O2
③O2和水在一定条件下将Fe变成Fe3O4
④强氧化剂:Cl2、Br2、HNO3、MnO4-、H2O2、浓H2SO4等
⑤还原剂:I- 、S2- 、H2S、SO2、Fe、Cu等Fe2+铁及其化合物的性质Al3+Al02-Al(OH)3④OH-或NH3·H2O③H+⑥OH-⑤H+或CO2①H+②OH-铝的化合物间的相互转化化学实验1、物质的分离与提纯
2、物质的检验
3、物质的量浓度溶液的配制
4、氯气的制备
5、钠与水的反应
6、Fe2+、Fe3+的检验
7、铜与浓H2SO4、HNO3的反应
8、C与浓H2SO4、HNO3的反应
9、喷泉实验分离与提纯1、常见物质检验的方法:
如:Cl-、SO42-、CO32-、NH4+的检验
2、焰色反应及其注意事项
操作:把铂丝用盐酸洗涤后灼烧,反复多次,直到火焰变为无色。然后用铂丝蘸一些试剂,放到酒精灯火焰的外焰部分灼烧,观察火焰的颜色。
注意事项:透过蓝色的钴玻璃观察钾的火焰颜色,可以滤去黄色的光,避免钾盐里的含钠杂质造成干扰。
焰色反应是物理变化。 物质检验仪器:托盘天平、药匙、烧杯(溶解冷却试剂)、玻璃棒(搅拌和引流)、容量瓶、胶头滴管、量筒
过程:计算→称量→溶解→冷却→移液→洗涤→定容→摇匀→装瓶
误差分析: cB =一定物质的量浓度溶液的配制如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在炭棒和铁钉表面都有气体生成,其中炭棒表面生成的气体是什么?
A、Cl2 B、O2 C、H2 D、HCl
右图是实验室制取氯气的装置,问:
1)实验前应如何检查该装置的气密性?
2)进入广口瓶的导管为什么要长进短出?
3)为什么要将导管通入NaOH溶液中?氯气制备溶液变成血红色不显红色,滴加氯水后显血红色溶解,溶液颜色变浅无明显现象立即产生红褐色沉淀白色沉淀迅速变灰绿色最后呈红褐色棕黄色浅绿色Fe2+与Fe3+的检验
2、气体摩尔体积
3、分散系——胶体
4、物质的量浓度
5、氧化还原反应及配平
6、离子反应化学理论得到电子,化合价降低,
被还原,发生还原反应失去电子,化合价升高,
被氧化,发生氧化反应氧化能力:氧化剂 > 氧化产物
还原能力:还原剂 > 还原产物
化学方程式的 配平步骤:标、定、算、平、查
技巧:完全变价看前面,部分变价看后面氧化还原反应1、离子反应:有离子参加的化学反应
离子反应发生的条件:生成难溶物质、挥发性的物质、难电离的物质,或者发生氧化还原反应
离子反应发生的本质:溶液中的离子浓度明显减少
2、离子反应方程式书写的步骤:
①写:写出正确的化学方程式
②拆:把溶于水且易电离的物质写成离子形式;难溶、难电离物写化学式,如单质、沉淀、气体、难电离物质、氧化物等。
③删:删去两边未反应的离子,
④查:质量守恒和电荷守恒。 离子反应1、原子结构模型的演变:道尔顿的近代原子学说、汤姆生的“葡萄干面包式”原子结构模型、卢瑟福的带核原子结构模型、玻尔的原子轨道模型、电子云模型
2、核外电子的运动特征和排布规律
3、原子的构成及各微粒间的关系
4、同位素及核素的涵义
把具有一定质子数和一定中子数的一种原子称为核素。
质子数相同而中子数不同的核素互称为同位素。
练1:某金属元素R原子的质量数为52,已知R离子含有28个中子,21个电子,由这种离子组成的化合物的化学式正确的是 ( )
A.RCl2 B.RO2 C.K2R2O7 D.R(NO3)3
练2:某X原子,质量为ag,求元素X的相对原子质量?物质结构1、氯、溴、碘及其化合物
氯气的制备 氯气的性质 溴、碘的提取
2、硅及其化合物
硅的性质 SiO2的性质及应用 硅酸盐及其产品
3、硫及其化合物
硫的性质 SO2的性质和作用 硫酸的制备和性质
含硫物质的相互转化
4、氮及其化合物
NOX的转化 氨和铵盐的性质 硝酸的性质
含氮物质的相互转化非金属元素及其化合物1、氯气的物理性质:在通常情况下,氯气是一种黄绿色、有刺激性气味的有毒气体;1体积水约能溶解2体积Cl2;但难溶于饱和食盐水。
2、氯气的化学性质:
与金属反应:
与非金属反应:
与水反应:
与碱反应:
卤族元素的置换:Cl2+H2O HCl+HClOCl2+2NaOH==NaCl+NaClO+H2O
2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O Cl2+2NaBr==2NaCl+Br2 Cl2+2Kl==2NaCl+I2 氯气性质1、Si的化学性质
常温下,Si只与碱、氟化氢、氟气反应;
高温时,Si能与浓硫酸、硝酸、氧气、氯气等强氧化性物质反应
2、SiO2的化学性质
常温下,SiO2能与碱、HF反应。其它物质一般不反应
高温时,SiO2能与碱性氧化物、某些盐发生反应
3、单质硅的提纯原理Si与SiO2的性质⑴S与H2等非金属单质反应
⑵S与金属单质反应
⑶S与碱反应2Na + S = Na2S⑷SO2是无色、有刺激性气味、有毒、易液化、比空气重、易溶于水(1:40)
⑸SO2具有酸性氧化的通性
⑹SO2既有氧化性,又有还原性
⑺SO2漂白性:生成不稳定的亚硫酸盐,加热后能复原A、与水反应生成酸: SO2 + H2O H2SO3
B、与碱反应生成盐和水:SO2 +2NaOH=Na2SO3+H2O2SO2 + O2 2SO32H2S+SO2=3S+2H2OS与SO2的性质(1)高沸点酸
(2)吸水性——做干燥剂化
(3)脱水性——使有机物脱水炭
(4)强氧化性①一般不产生氢气,而是产生硫的单质或化合物;
② Fe、Al常温下遇浓H2SO4会钝化H2S + H2SO4(浓) == S↓ + SO2↑ + 2H2O 硫酸性质1、氮气跟氧气的反应
2、氮气跟某些金属的反应
3、氮气跟氢气的反应(合成氨)2NO + O2 = 2NO2 3NO2 + H2O = 2HNO3 + NO
合并:4NO + 3O2 + 2H2O = 4HNO3
合并:4NO2 + O2 + 2H2O = 4HNO3氮气及部分氧化物的性质无色、易挥发,有刺激性气味的液体;能与水任意比互溶
⑴硝酸酸性: HNO3 = H++NO3-
⑵强氧化性:
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O
①金属遇硝酸一般不产生H2;不活泼金属将浓硝酸还原成NO2,将稀硝酸还原成NO;活泼金属将硝酸还原成更低价态的N的化合物或单质;
②Al、Fe遇浓硝酸常温下生成致密氧化膜而发生钝化。硝酸性质1、钠和钠的化合物
钠的提取 钠的性质 Na2CO3和NaHCO3的性质对比
2、镁和镁的化合物
镁的提取 镁的性质
3、铝和铝的化合物
铝土矿中提取铝 Al2O3和Al(OH)3的性质 铝的性质
4、铜、铁和其化合物
常见的含铜、铁的矿物名称
铁的冶炼 铁的性质 铁盐的转化 金属及化合物的性质从海水中提取NaCl和MgCl2,海水晒盐得到NaCl
Mg2+→Mg(OH)2↓→MgCl2→Mg铝土矿主要成份是Al2O3,同时有少量的Fe2O3和SiO2 ,先提纯Al2O3,后电解得到铝:Al2O3+2NaOH=2NaAlO2+H2O
SiO2+2NaOH=Na2SiO3+H2O NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3 钠镁铝的提取及铁的冶炼银白色,光泽,固体,质轻、柔软
与非金属单质反应
与水反应
与酸反应
与盐反应4Na+O2==2Na2O (白色固体)2Na+2H2O==2NaOH+ H2↑
2Na+2HCl==2NaCl+ H2↑ 2Na+CuSO4+2H2O==Cu(OH)2↓+H2↑+Na2SO4 钠的性质银白色,光泽,固体,质轻
1、与非金属单质反应
2、与酸反应
3、与沸水反应
4、与CO2反应Mg+2H+=Mg2++H2↑镁的性质铝的化学性质:
1、与非金属单质反应
2、与酸反应
3、与碱反应
4、与金属氧化物反应2Al+ 6H+ = 2Al3+ + 3H2↑
2Al+2OH-+2H2O=2AlO2-+ 3H2↑铝的性质Na2CO3与NaHCO3的性质1、两性:Al2O3+2OH-=2AlO2-+H2O Al2O3+6H+=2Al3++3H2O
Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O
2、Al2O3高硬度、高熔点,可制作耐火材料。
3、Al(OH)3的制备
⑴氯化铝溶液中滴加氨水能制备Al(OH)3
⑵偏铝酸钠溶液中通入CO2气体能制备Al(OH)3
⑶偏铝酸钠和氯化铝物质的量之比3:1混合AlO2- +H++H2O Al(OH)3 Al3++3OH-Al2O3与Al(OH)3的性质FeFe3+①弱氧化剂:S、H+及金属活动性表中铁后面的金属离子
②强氧化剂:Cl2、Br2、浓H2SO4、HNO3、H2O2
③O2和水在一定条件下将Fe变成Fe3O4
④强氧化剂:Cl2、Br2、HNO3、MnO4-、H2O2、浓H2SO4等
⑤还原剂:I- 、S2- 、H2S、SO2、Fe、Cu等Fe2+铁及其化合物的性质Al3+Al02-Al(OH)3④OH-或NH3·H2O③H+⑥OH-⑤H+或CO2①H+②OH-铝的化合物间的相互转化化学实验1、物质的分离与提纯
2、物质的检验
3、物质的量浓度溶液的配制
4、氯气的制备
5、钠与水的反应
6、Fe2+、Fe3+的检验
7、铜与浓H2SO4、HNO3的反应
8、C与浓H2SO4、HNO3的反应
9、喷泉实验分离与提纯1、常见物质检验的方法:
如:Cl-、SO42-、CO32-、NH4+的检验
2、焰色反应及其注意事项
操作:把铂丝用盐酸洗涤后灼烧,反复多次,直到火焰变为无色。然后用铂丝蘸一些试剂,放到酒精灯火焰的外焰部分灼烧,观察火焰的颜色。
注意事项:透过蓝色的钴玻璃观察钾的火焰颜色,可以滤去黄色的光,避免钾盐里的含钠杂质造成干扰。
焰色反应是物理变化。 物质检验仪器:托盘天平、药匙、烧杯(溶解冷却试剂)、玻璃棒(搅拌和引流)、容量瓶、胶头滴管、量筒
过程:计算→称量→溶解→冷却→移液→洗涤→定容→摇匀→装瓶
误差分析: cB =一定物质的量浓度溶液的配制如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在炭棒和铁钉表面都有气体生成,其中炭棒表面生成的气体是什么?
A、Cl2 B、O2 C、H2 D、HCl
右图是实验室制取氯气的装置,问:
1)实验前应如何检查该装置的气密性?
2)进入广口瓶的导管为什么要长进短出?
3)为什么要将导管通入NaOH溶液中?氯气制备溶液变成血红色不显红色,滴加氯水后显血红色溶解,溶液颜色变浅无明显现象立即产生红褐色沉淀白色沉淀迅速变灰绿色最后呈红褐色棕黄色浅绿色Fe2+与Fe3+的检验
