鲁教版初中化学九年级上册第六单元《燃烧与燃料》单元测试题(解析版)
文档属性
| 名称 | 鲁教版初中化学九年级上册第六单元《燃烧与燃料》单元测试题(解析版) |

|
|
| 格式 | zip | ||
| 文件大小 | 221.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-01-07 00:00:00 | ||
图片预览


文档简介
第六单元《燃烧与燃料》单元测试题
一、单选题(每小题只有一个正确答案)
1.鉴别三瓶无标签的无色的氧气、二氧化碳、空气最简便的方法是用( )
A.带火星木条 B.紫色石蕊试液 C.澄清石灰水 D.带火焰木条
2.下列活动不符合“低碳生活”的是( )
A.短时间不使用电脑,将其转为休眠模式
B.减少使用私家车次数,多乘公交或骑自行车
C.讲卫生,尽量多作用一次性餐具
D.用传统发条式闹钟代替电子钟
3.某高层住宅发生重大火灾。下列逃生措施①沿楼梯迅速上移②用湿毛巾堵住口鼻③匍匐前进,寻找安全出口④封闭房门⑤迅速转移到阳台等待救援⑥跳楼,其中正确的选项是( )
A.②③④⑤ B.①②③④ C.③④⑤⑥ D.①②④⑤
4.下列说法中,正确的是( )
A.红磷燃烧产生白雾
B.铁丝伸入盛有氧气的集气瓶中剧烈燃烧,生成黑色固体
C.二氧化碳能使澄清的石灰水变浑浊
D.木炭和氧化铜在高温下生成黑色固体
5.冬季室内燃煤取暖时,要注意保持通风,以免造成人员中毒。这里的有毒气体主要是指( )
A.O2 B.N2 C.CO D.CO2
6.以下判断正确的是( )
A.只有在点燃或加热时可燃物才能燃烧
B.只要温度达到可燃物着火点可燃物就能燃烧
C.只有含碳元素的物质才能燃烧
D.只要使可燃物的温度降到着火点以下就能灭火
7.下列有关CO2性质和用途的说法不正确的是( )
A.通常情况下,CO2既不燃烧也不支持燃烧 B.CO2具有还原性,可用来冶炼金属
C.绿色植物的光合作用能吸收CO2 D.干冰可以用来实施人工降雨
8.我国科学家在CO低温氧化的研究上取得了突破性进展。利用四氧化三钴纳米棒,可将汽车尾气中的CO在低温下与氧气反应转化为CO2,示意图如下。下列关于该转化的几点说法,不正确的是( )
(
四氧化三钴纳米棒
CO
O
2
CO
2
)
A.反应前后氧原子数不发生变化
B.反应中CO与O2的质量比为7:4
C.四氧化三钴纳米棒可能是反应的催化剂
D.反应前后分子的数目没有发生改变,分子的种类一定发生改变
9.下列关于灭火的叙述中错误的是( )
A.炒菜时油锅着火立即盖上锅盖——使可燃物与空气隔绝
B.木材着火用水泼灭——降低了可燃物的着火点
C.扑灭森林火灾开辟隔离带——清除和隔离可燃物
D.不慎将酒精洒到桌面燃烧,用湿布覆盖——隔氧又降温
10.水可以使燃烧的固体物质熄灭的原理是( )
A.隔绝空气 B.降低可燃物的着火点C.降低温度 D.降低温度和隔绝空气
11.下列对一些事实的解释中,不合理的是( )
选项 事实 解释
A 液态氧和氧气都能支持燃烧 同种物质的分子化学性质相同
B 缉毒犬能根据气味发现毒品 分子在不断运动
C 实验室没有二氧化锰时,可加热氯酸钾与高锰酸钾的混合物也能较快制取氧气,且增加氧气的质量 高锰酸钾在该反应中做了催化剂
D 生产乙醇汽油 不但能节约石油资源也能减少环境污染
A.A B.B C.C D.D
12.根据日常经验和你所学的化学知识,判断下列变化不属于化学变化的是( )
A.葡萄酿酒 B.根据石油中各成分沸点不同进行分离
C.紫外线消毒 D.煤隔绝空气加热
13.下列燃料不属于化石燃料的是( )
A.煤 B.石油 C.天然气 D.氢气
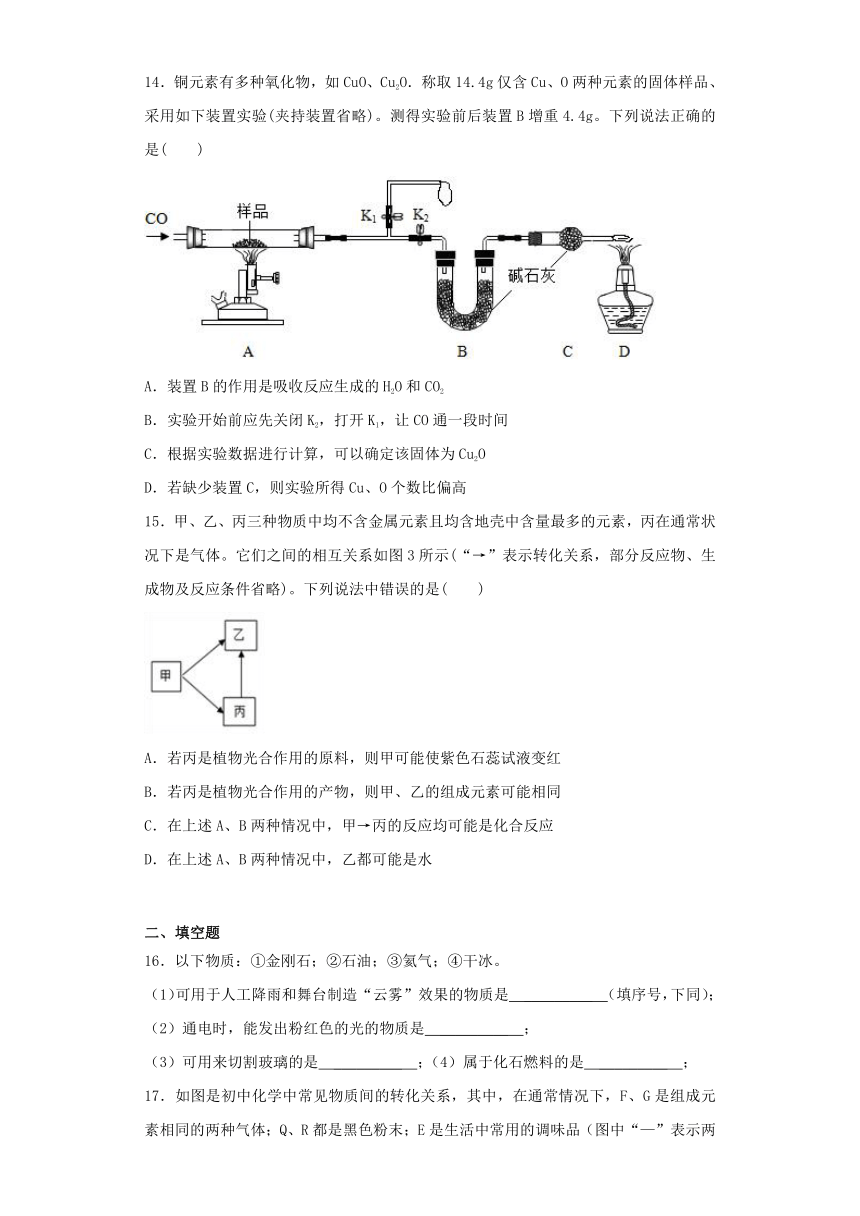
14.铜元素有多种氧化物,如CuO、Cu2O.称取14.4g仅含Cu、O两种元素的固体样品、采用如下装置实验(夹持装置省略)。测得实验前后装置B增重4.4g。下列说法正确的是( )
A.装置B的作用是吸收反应生成的H2O和CO2
B.实验开始前应先关闭K2,打开K1,让CO通一段时间
C.根据实验数据进行计算,可以确定该固体为Cu2O
D.若缺少装置C,则实验所得Cu、O个数比偏高
15.甲、乙、丙三种物质中均不含金属元素且均含地壳中含量最多的元素,丙在通常状况下是气体。它们之间的相互关系如图3所示(“→”表示转化关系,部分反应物、生成物及反应条件省略)。下列说法中错误的是( )
A.若丙是植物光合作用的原料,则甲可能使紫色石蕊试液变红
B.若丙是植物光合作用的产物,则甲、乙的组成元素可能相同
C.在上述A、B两种情况中,甲→丙的反应均可能是化合反应
D.在上述A、B两种情况中,乙都可能是水
二、填空题
16.以下物质:①金刚石;②石油;③氦气;④干冰。
(1)可用于人工降雨和舞台制造“云雾”效果的物质是 _________ (填序号,下同);
(2)通电时,能发出粉红色的光的物质是 _________ ;
(3)可用来切割玻璃的是 _________ ;(4)属于化石燃料的是 _________ ;
17.如图是初中化学中常见物质间的转化关系,其中,在通常情况下,F、G是组成元素相同的两种气体;Q、R都是黑色粉末;E是生活中常用的调味品(图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应条件和生成物略去)。请回答:
(1)A、G的化学式为: , 。
(2)反应②的化学方程式为 ;
反应③的化学方程式为 。
18.碳元素是组成物质的基本元素,“碳循环”也是自然界重要的循环,根据所学完成下题:
(1)碳元素形成的单质除金刚石、石墨外,还有一种物质的分子类似足球状,这种物质的化学式为________。
(2)CO2常用于灭火,但镁着火不能用CO2灭火,原因是它们能发生反应,请写出该置换反应的化学方程式
(3)科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环.
为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量 溶液,若观察到试管内 ,则分解不完全。
② 上述设想的优点有
19.2014年青奥会将在南京举行,为了控制汽车尾气给空气造成的污染,南京市在燃料的使用和管理等方面采取了一些有效措施,使用节能环保车也是未来的发展趋势。
图1 天然气公交车 图2 氢动力概念跑车 图3国产电动轿车
(1)图1中公交车使用的天然气主要成分是 ,其完全燃烧的化学方程式为 。
(2)图2是2011年上海国际汽车展中,我国自行研制的氢动力概念跑车。汽车最理想的清洁燃料是氢气,氢气在空气中燃烧的化学方程式为 ,但氢动力汽车目前还不能普及,原因是 (答一点即可)。
(3)图3是由上汽集团自主研发的“叶子”概念车,该车顶部的“大叶子”是一部光电转化器,可以把 能转化为电能。
20.某同学为研究动物的呼吸作用,用下如图的装置进行实验,实验过程中将观察到:澄清石灰水_________,细玻璃管中的红墨水向________移动。这说明动物呼吸消耗___________,生成____________。
三、实验题
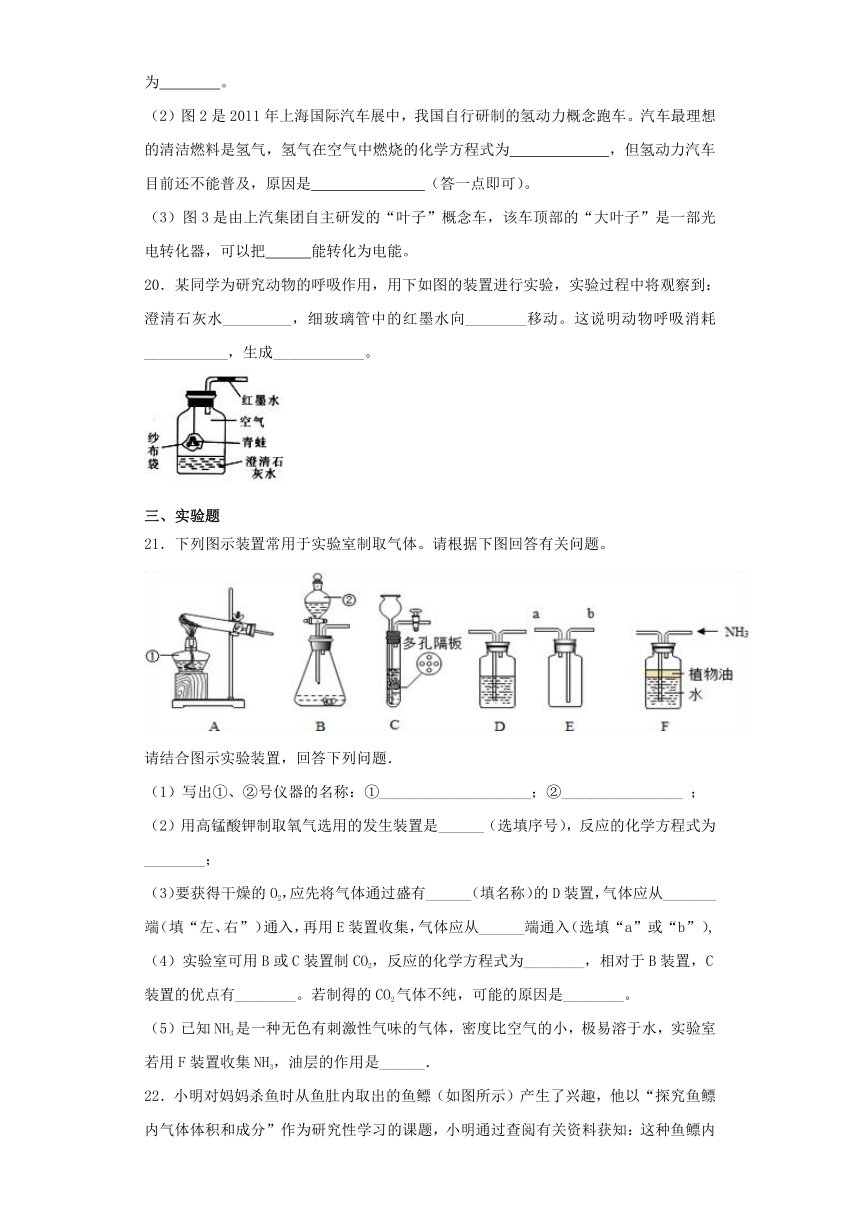
21.下列图示装置常用于实验室制取气体。请根据下图回答有关问题。
请结合图示实验装置,回答下列问题.
(1)写出①、②号仪器的名称:①____________________;②________________ ;
(2)用高锰酸钾制取氧气选用的发生装置是______(选填序号),反应的化学方程式为________;
(3)要获得干燥的O2,应先将气体通过盛有______(填名称)的D装置,气体应从_______端(填“左、右”)通入,再用E装置收集,气体应从______端通入(选填“a”或“b”),
(4)实验室可用B或C装置制CO2,反应的化学方程式为________,相对于B装置,C装置的优点有________。若制得的CO2气体不纯,可能的原因是________。
(5)已知NH3是一种无色有刺激性气味的气体,密度比空气的小,极易溶于水,实验室若用F装置收集NH3,油层的作用是______.
22.小明对妈妈杀鱼时从鱼肚内取出的鱼鳔(如图所示)产生了兴趣,他以“探究鱼鳔内气体体积和成分”作为研究性学习的课题,小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要为二氧化碳和氮气,且二氧化碳能溶于水。探究分两步进行:
(1)测量鱼鳔内气体体积。小明设计了两种方法:A 用医用注射器抽取鱼鳔内气体,测量其体积;B 在水下刺破鳔,用排水集气法收集鱼鳔内气体并测量其体积(如图所示),你认为测量结果不准确的一种方法是__________,理由是__________________________________。
(2)探究鱼鳔内气体的成分。现有两瓶鱼鳔内的气体,请你帮助小明设计实验进行验证。
实验目的 实验方法 实验现象
验证鱼鳔内含O2 ①
验证鱼鳔内含CO2 ②
四、推断题
23.A→I是初中化学常见的物质,它们的相互转化关系如图所示,其中C、D、E为无色气体,H是石灰石的主要成分。回答下列问题:
(1)写出下列物质的化学式:
D_____;
G_____。
(2)反应①的基本反应类型为_____。
(3)写出反应②的化学方程式_____。
24.A~I为初中化学常见物质,相互转化关系如图所示,“→”表示转化关系,“—”表示相互之间能发生反应(部分反应物、生成物以及反应条件省略)。其中,A、C、F、H含相同金属元素且所属物质类别不同,H、I类别相同;A、B为金属单质,B为紫红色;C、D为氧化物,C为红棕色固体;G溶液呈蓝色,E的浓溶液常用作某些气体的干燥剂。请回答问题:
(1)B的化学式________,F的名称__________。
(2)写出化学方程式:
反应①______________________________,
反应④_______________________________。
五、计算题
25.动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点是可以充电循环使用。电瓶的正极材料是二氧化铅(PbO2),负极材料是金属铅(Pb),电瓶内所加液体是溶质质量分数为36%的稀硫酸,放电(为外界供电)时发生反应的化学方程式如下:PbO2(固)+2H2SO4+Pb=2PbSO4(固)+2H2O。当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电。
(1)电瓶在放电时,_________能转化为电能。
(2)假如某个电瓶中铅的质量为1800 g,内装36%的稀硫酸1200 g,当有310.5 g的铅参加反应时,需消耗稀硫酸中溶质_____克?此时电瓶中硫酸溶液溶质的质量分数是_____?(最后结果精确到0. 01%)
26.某化学兴趣小组取12.5克的大理石样品(杂质不与盐酸反应)加入到一定量的稀盐酸中,产生CO2的质量与稀盐酸的质质量关系如图所示。请计算:
(1)生成CO2的质量是_____g。
(2)该盐酸的溶质质量分数为__________(计算结果保量0.1%)。
试卷第6页,总8页
参考答案
1.D
【解析】
【详解】
A、带火星的木条在氧气中能燃烧,但在空气和二氧化碳中都会熄灭,故此项错误; B、氧气、空气都不能使紫色石蕊试液变红,二氧化碳能与水反应生成碳酸,能使紫色石蕊试液变红,故此项错误;C、澄清石灰水只有遇到二氧化碳时才变浑浊,氧气和空气都不能使澄清石灰水变浑浊,不能鉴别氧气和空气,故此项错误;D、燃着的木条在氧气中剧烈燃烧,在空气中安静燃烧,在二氧化碳中熄灭,现象明显,故此项正确。故选D。
【点睛】
鉴别题要做到同一操作下或与同一物质反应时,现象要不同。
2.C
【解析】A. 短时间不使用电脑,将其转为休眠模式,节约用电,符合“低碳生活”,不符合题意;B. 减少使用私家车次数,多乘公交或骑自行车,符合“低碳生活”,不符合题意;C. 多作用一次性餐,不符合“低碳生活”,符合题意;D. 用传统发条式闹钟代替电子钟,减少能源的使用,符合“低碳生活”,不符合题意。故选C。
3.A
【解析】当高层楼房起火,火势凶猛千万不要沿楼梯迅速下楼,更不能跳楼,由于楼层很高,跳楼会造成可能更坏的结果,由于燃烧产生大量烟尘,为了防止烟尘被吸入体内,用湿毛巾堵住口鼻,由于温度高烟尘会聚集在上方,所以要匍匐前进寻找安全出口,封闭房门是为了防止火势引入房内,可以迅速转到阳台,用绳索下坠而逃生.
故答案为:②③④⑤
故选A
4.C
【解析】
【详解】
A、红磷在空气中燃烧,产生大量白烟,故选项错误;
B、未引燃的铁丝伸入氧气瓶中不能燃烧,故选项错误;
C、二氧化碳和石灰水反应生成碳酸钙沉淀,会看到浑浊现象,故选项正确;
D、木炭在高温下还原氧化铜生成铜,固体由黑色逐渐变红,故选项错误。
故选C。
5.C
【解析】
试题分析:碳在氧气不充分的情况下燃烧会产生一氧化碳,在氧气充分的情况下燃烧产生的是二氧化碳。
A、氧气能供给呼吸,无毒,故A错误;
B、氮气是无毒的气体,故B错误;
C、一氧化碳有毒,能阻碍血红蛋白与氧气结合,故C正确;
D、二氧化碳会使人窒息,但无毒,故D错误。故选C
考点:一氧化碳的毒性
点评:物质的性质决定物质的用途,熟记物质的性质是解题的关键;另外,CO是一种有毒气体,而CO2没有毒性,但含量大时也能使人窒息而亡。
6.D
【解析】A.有些物质能自然,如白磷自然!
B.利用所学的燃烧的条件,没氧气不行,温度达不到着火点不行,只有同时具备这两个条件才能燃烧;
C.可燃物都能燃烧!
7.B
【解析】A、通常情况下,CO2既不燃烧也不支持燃烧,正确;B、CO2没有还原性,不能用来冶炼金属,错误;C、绿色植物的光合作用能吸收CO2,正确;D、干冰是固体的二氧化碳,干冰升华(由固态变成气态)时会吸收大量热,使空气中的水蒸气液化成水滴降落,形成降雨,正确。故选B。
8.D
【解析】通过题干,我们知道这么两条信息:(1)反应时将CO和O2转化为了CO2;(2)在过程中四氧化三钴纳米棒作催化剂.这样也可以写为:2CO+O2 2CO2.
A、因为所有化学反应都遵循质量守恒定律,原子种类和数目都不变.故A正确;
B、根据化学反应式 2CO+O2 2CO2可知,CO与O2的质量比为7:4,故B正确;
C、反应前后四氧化三钴纳米棒化学性质不发生变化.因为四氧化三钴纳米棒作催化剂.故C正确;
D、根据质量守恒定律可知道化学反应中原子的种类、原子的数量和原子的数目不会改变,但分子的数目是会改变的.故D错误.
故选D.
9.B
【解析】
试题分析∶A.炒菜时油锅着火立即盖上锅盖——使可燃物与空气隔绝。故A正确。B.木材着火用水泼灭——降低了可燃物周围环境的稳定使温度低于可燃物的着火点。故B错误。C.扑灭森林火灾开辟隔离带——清除和隔离可燃物。故C正确。D.不慎将酒精洒到桌面燃烧,用湿布覆盖——隔氧又降温。故D正确。
考点∶考查与灭火相关的知识。
10.D
【解析】A、水可以使燃烧熄灭,水能起到隔绝空气、使温度降到可燃物的着火点以下的灭火原理;而不只是隔绝空气,故选项错误.
B、水可以使燃烧熄灭,水能起到隔绝空气、使温度降到可燃物的着火点以下的灭火原理;可燃物的着火点一般是不变的,不能降低可燃物的着火点,故选项错误.
C、水可以使燃烧熄灭,水能起到隔绝空气、使温度降到可燃物的着火点以下的灭火原理;而不只是降低温度,故选项错误.
D、水可以使燃烧熄灭,水能起到隔绝空气、使温度降到可燃物的着火点以下的灭火原理,故选项正确.
故选:D.
11.C
【解析】A、液氧和氧气都能助燃,是因为它们是由氧分子构成的,同种的分子性质相同,正确;B、缉毒犬能根据气味发现毒品,是因为毒品中含有的分子是在不断的运动的,向四周扩散,使缉毒犬闻到毒品气味,正确;C、实验室没有二氧化锰时,可加热氯酸钾与高锰酸钾的混合物也能较快制取氧气,且增加氧气的质量,高锰酸钾不是催化剂,催化剂在化学反应前后质量和化学性质都不会改变,错误;D、生产乙醇汽油,不但能节约石油资源也能减少环境污染,正确。故选C。
点睛:分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种的分子性质相同,不同种的分子性质不同,可以简记为:“两小运间,同同不不”。
12.B
【解析】A、葡萄酿酒过程中有新物质酒精生成,属于化学变化;B、根据石油中各成分沸点不同进行分离过程中没有新物质生成,属于物理变化;C、紫外线能够破坏微生物机体细胞的分子结构,有新物质生成,属于化学变化;D、煤隔绝空气加热过程中有新物质焦炭、煤焦油、焦炉煤气生成,属于化学变化。故选B。
点睛:解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化。
13.D
【解析】试题分析:化石燃料是古代生物遗体在特定地质条件下形成的,可作燃料和化工原料的沉积矿产。包括煤、油页岩、石油、天然气等。A、煤属于化石燃料。B、石油属于化石燃料。C、天然气属于化石燃料。D、氢气可以人工制造,不属于化石燃料。故选:D。
考点:化石燃料及其综合利用
14.B
【解析】
A、装置A中的反应是CuO+COCu+CO2,Cu2O+CO2Cu+CO2,反应中没有生成水,装置B的作用是吸收反应生成的CO2,错误;B、一氧化碳是具有可燃性的气体,实验开始前应先关闭K2,打开K1,让CO通一段时间,排尽玻璃管中空气,防止加热时发生爆炸,正确。C、由题意可知装置B增重4.4g,是吸收二氧化碳的质量,由质量守恒定律可知,铜的氧化物中氧元素的质量是:4.4g××100%× =1.6g,铜原子与氧原子的个数比= :=2:1,所以确定该固体为Cu2O或Cu和CuO的混合物或Cu2O、Cu和CuO的混合物,错误;D、若缺少装置C,装置B增重的质量偏大,则实验所得Cu、O个数比偏低,错误。故选B。
15.C
【解析】地壳中含量最多的元素是氧元素。A. 若丙是植物光合作用的原料,则丙是二氧化碳,则甲可能使紫色石蕊试液变红,甲应为碳酸,碳酸分解生成二氧化碳和水,二氧化碳和碱反应生成水;B. 丙是气体,若丙是植物光合作用的产物,丙应氧气,则甲、乙的组成元素可能相同,甲是过氧化氢、乙是水,过氧化氢分解生成水和氧气;C. 在上述A、B两种情况中,甲→丙的反应均可能是由一种物质生成两种物质的分解反应化;D. 在上述A、B两种情况中,碳酸、过氧化氢分解都生成水;故选C
16.(1)④ (2)③ (3)① (4)②
【解析】
试题分析:(1)干冰升华时要吸收大量的热,使周围的温度降低,从而使水蒸气液化,所以可用于人工降雨和舞台制造“云雾”效果
(2)稀有气体:化学性质很不活泼,通电时能发出不同颜色的光,所以,通电时,能发出粉红色的光的物质是氦气
(3)金刚石是自然界中最硬的物质,用于刻划玻璃、钻探机的钻头
(4)三大化石燃料:煤、石油、天然气
考点:常见物质的性质
17.(1) CaCl2 CO (2) Na2CO3+2HCl=2NaCl+H2O+CO2↑ CaCO3 CaO+CO2↑
【解析】
试题分析:E是生活中常用的调味品,说明E是氯化钠,F、G是组成元素相同的两种气体;二者是一氧化碳和二氧化碳,B和C反应得到氯化钠和F气体,说明F是二氧化碳,则G是一氧化碳,而R和Q是黑色固体物质,说明R是碳单质,而Q是氧化铜粉末,D是碳酸钙,所以A和B是氯化钙和碳酸钠,而B和C发生反应得到氯化钠,说明B中含有钠元素,因此B是碳酸钠,而A是氯化钙,C是盐酸。带入后恰好符合题意。
考点:物质的鉴别 物质的性质和变化
18.C60 2Mg+CO2点燃2MgO+C 稀盐酸 有气泡产生
原料易得且可循环利用、充分利用太阳能(合理即可)
【解析】
试题分析:碳元素形成的单质除金刚石、石墨外,还有一种物质的分子类似足球状,这种物质的化学式为C60,又叫足球烯,三种都是由碳元素形成的不同单质,CO2常用于灭火,但镁着火不能用CO2灭火,原因是它们能发生反应,反应的化学方程式2Mg+CO2点燃2MgO+C,为确定步骤2中的碳酸钙是否完全分解,即没有碳酸钙了,可以取少量固体于试管中,滴加过量的稀盐酸溶液,若观察到试管内有气泡产生,则分解不完全,上述设想的优点是原料易得且可循环利用、充分利用太阳能等。
考点:二氧化碳、一氧化碳的性质
19.(1)CH4 ; (2) ;成本高(贮存困难;不纯易爆等,其他合理的答案也给分)(3)太阳
【解析】
试题分析:(1)天然气的主要成分为甲烷,其和氧气燃烧生成水和二氧化碳;(2)氧气和氢气点燃生成水,但氢动力汽车目前还不能普及,原因是成本高、贮存困难、不纯易爆等原因;(3)光电转换器可以把太阳能转换成电能。
考点:化学与环境污染
点评:环境保护类的题目一直是近几年中考的考察热点,常和实事结合,可在选择题、填空题中考察,较为简单。
20.变浑浊左氧气二氧化碳
【解析】
青蛙在呼吸过程中吸入氧气,呼出二氧化碳,二氧化碳被澄清石灰水溶液吸收,变浑浊,由于装置内气体的量减小,压强变小,导致细玻璃管中红墨水倒吸入瓶内,即向左移动。这说明动物呼吸消耗氧气,生成二氧化碳。
点睛:青蛙在呼吸过程中消耗氧气,呼出二氧化碳,由此来解答问题。
21. 酒精灯 分液漏斗 A 2KMnO4K2MnO4+MnO2+O2↑ 浓硫酸 左 b CaCO3 + 2HCl = CaCl2 + CO2 + H2O, 随时对地控制反应速度、节约药品 盐酸浓度过大 防止氨气溶于水
【解析】(1)据图可知①号仪器的名称是酒精灯;②号仪器的名称是分液漏斗;(2)高锰酸钾在加热的条件下可以分解产生二氧化锰、锰酸钾和氧气;化学方程式为:2KMnO4K2MnO4+MnO2+O2↑,实验室用高锰酸钾制取氧气时,反应物的状态是固体,反应条件是加热,可选用的气体发生装置是A;(3)浓硫酸具有吸水性,而氢氧化钠溶液没有吸水性,所以应该用浓硫酸来进行干燥,并从长管进入;氧气的密度比空气大,所以用E装置来收集氧气时,氧气从长管进入;(4)实验室可用B或C装置制CO2,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;C相对于B装置的优点是能使反应随时进行或停止;盐酸浓度过大会挥发出氯化氢气体;(5)若用F装置收集NH3,油层的作用是防止氨气溶于水。
22.(1) B 、鱼鳔内CO2能溶于水;
(2)将燃着的木条放入含有鱼鳔内气体的集气瓶中;木条继续燃烧。向另一含有鱼鳔内气体的集气瓶中加入少量澄清石灰水,振荡;石灰水变浑浊
【解析】(1)二氧化碳溶于水,不能用排水法收集.
(2)氧气具有助燃的特性,燃着的木条放入瓶中木条可以继续燃烧;二氧化碳可以使澄清石灰水变浑浊.
23.H2;Ca(OH)2;分解反应;Ca(OH)2+CO2═CaCO3↓+H2O;
【解析】
【分析】
根据题目给出的流程图和信息:根据“H是石灰石的主要成分”,则推测H为碳酸钙;结合图框:B通电生成DC,则B为水,D为氢气,C为氧气;A分解生成CF,则为双氧水分解生成氧气和水;根据二氧化碳与氢氧化钙反应生成碳酸钙和水等知识,则F为碳,E为二氧化碳,G为氢氧化钙,代入检验,符合题意。
【详解】
(1)根据分析,下列物质的化学式:D为H2;G为Ca(OH)2;
(2)反应①为双氧水分解生成氧气和水,其反应的基本反应类型为分解反应;
(3)反应②为二氧化碳与氢氧化钙反应生成碳酸钙和水,其反应的化学方程式Ca(OH)2+CO2═CaCO3↓+H2O。
24. Cu 硫酸铁 Fe2O3+3CO高温2Fe+3CO2 (合理均可) CuO+H2SO4==CuSO4+H2O
【解析】A、B为金属单质,B为紫红色,因此B为铜,铜反应产生D;C、D为氧化物,C为红棕色固体,因此D是氧化铜,C是氧化铁;A、C、F、H含相同金属元素且所属物质类别不同,因此A应该是铁;E的浓溶液常用作某些气体的干燥剂,因此E是硫酸,则F是硫酸铁;硫酸铁能够转化为H,H能够和硫酸反应,因此H应该是碱氢氧化铁;硫酸和氧化铜反应产生的G,G溶液呈蓝色,因此G是硫酸铜,反应产生I,H、I类别相同,因此I是碱氢氧化铜,经过验证,推导正确,因此:
(1)B是铜,化学式为Cu;F为Fe2(SO4)3,化学名称是硫酸铁;
(2)反应①可以是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:3CO+Fe2O32Fe+3CO2;硫酸和氧化铜反应的化学反应方程式为:CuO+H2SO4═CuSO4+H2O。
点睛:解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可;A、B为金属单质,B为紫红色;C、D为氧化物,C为红棕色固体;G溶液呈蓝色,E的浓溶液常用作某些气体的干燥剂,均为解题的突破口,可初步确定B为铜、C为氧化铁,G为硫酸铜溶液,E为浓硫酸,再结合物质间的转化关系,逐一推断其它物质。
25. 化学 294g 14.38%
【解析】(1)放电时的电能由反应PbO2(固)+2H2SO4+Pb=2PbSO4(固)+2H2O而产生,因此此过程为化学能转变为电能的过程;(2)设需消耗硫酸的质量为x,同时生成水的质量为y;PbO2(固)+2H2SO4+Pb=2PbSO4↓+2H2O
196 207 36
x 310.5g y
,
x=294g,y=54g,
36%的稀硫酸1200克稀硫酸中硫酸的质量=1200g×36%=432g,则反应后还剩余硫酸的质量=432g-294g=138g;剩余硫酸溶液的质量=1200g-294g+54g=960g;
硫酸溶液溶质的质量分数=×100%=14.38%。
26. 4.4 7.3%
【解析】本题考查了化学反应方程式与溶质质量分数相结合的简单计算。解题的关键是读懂关系图中的数据与化学反应的关系。
(1)根据关系图可知,生成的二氧化碳的质量为4.4g;
(2)设:该盐酸的溶质质量分数为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
100g×x 4.4g
x=7.3%
答:(1)生成CO2的质量是 4.4g。
(2)该盐酸的溶质质量分数为7.3%。
一、单选题(每小题只有一个正确答案)
1.鉴别三瓶无标签的无色的氧气、二氧化碳、空气最简便的方法是用( )
A.带火星木条 B.紫色石蕊试液 C.澄清石灰水 D.带火焰木条
2.下列活动不符合“低碳生活”的是( )
A.短时间不使用电脑,将其转为休眠模式
B.减少使用私家车次数,多乘公交或骑自行车
C.讲卫生,尽量多作用一次性餐具
D.用传统发条式闹钟代替电子钟
3.某高层住宅发生重大火灾。下列逃生措施①沿楼梯迅速上移②用湿毛巾堵住口鼻③匍匐前进,寻找安全出口④封闭房门⑤迅速转移到阳台等待救援⑥跳楼,其中正确的选项是( )
A.②③④⑤ B.①②③④ C.③④⑤⑥ D.①②④⑤
4.下列说法中,正确的是( )
A.红磷燃烧产生白雾
B.铁丝伸入盛有氧气的集气瓶中剧烈燃烧,生成黑色固体
C.二氧化碳能使澄清的石灰水变浑浊
D.木炭和氧化铜在高温下生成黑色固体
5.冬季室内燃煤取暖时,要注意保持通风,以免造成人员中毒。这里的有毒气体主要是指( )
A.O2 B.N2 C.CO D.CO2
6.以下判断正确的是( )
A.只有在点燃或加热时可燃物才能燃烧
B.只要温度达到可燃物着火点可燃物就能燃烧
C.只有含碳元素的物质才能燃烧
D.只要使可燃物的温度降到着火点以下就能灭火
7.下列有关CO2性质和用途的说法不正确的是( )
A.通常情况下,CO2既不燃烧也不支持燃烧 B.CO2具有还原性,可用来冶炼金属
C.绿色植物的光合作用能吸收CO2 D.干冰可以用来实施人工降雨
8.我国科学家在CO低温氧化的研究上取得了突破性进展。利用四氧化三钴纳米棒,可将汽车尾气中的CO在低温下与氧气反应转化为CO2,示意图如下。下列关于该转化的几点说法,不正确的是( )
(
四氧化三钴纳米棒
CO
O
2
CO
2
)
A.反应前后氧原子数不发生变化
B.反应中CO与O2的质量比为7:4
C.四氧化三钴纳米棒可能是反应的催化剂
D.反应前后分子的数目没有发生改变,分子的种类一定发生改变
9.下列关于灭火的叙述中错误的是( )
A.炒菜时油锅着火立即盖上锅盖——使可燃物与空气隔绝
B.木材着火用水泼灭——降低了可燃物的着火点
C.扑灭森林火灾开辟隔离带——清除和隔离可燃物
D.不慎将酒精洒到桌面燃烧,用湿布覆盖——隔氧又降温
10.水可以使燃烧的固体物质熄灭的原理是( )
A.隔绝空气 B.降低可燃物的着火点C.降低温度 D.降低温度和隔绝空气
11.下列对一些事实的解释中,不合理的是( )
选项 事实 解释
A 液态氧和氧气都能支持燃烧 同种物质的分子化学性质相同
B 缉毒犬能根据气味发现毒品 分子在不断运动
C 实验室没有二氧化锰时,可加热氯酸钾与高锰酸钾的混合物也能较快制取氧气,且增加氧气的质量 高锰酸钾在该反应中做了催化剂
D 生产乙醇汽油 不但能节约石油资源也能减少环境污染
A.A B.B C.C D.D
12.根据日常经验和你所学的化学知识,判断下列变化不属于化学变化的是( )
A.葡萄酿酒 B.根据石油中各成分沸点不同进行分离
C.紫外线消毒 D.煤隔绝空气加热
13.下列燃料不属于化石燃料的是( )
A.煤 B.石油 C.天然气 D.氢气
14.铜元素有多种氧化物,如CuO、Cu2O.称取14.4g仅含Cu、O两种元素的固体样品、采用如下装置实验(夹持装置省略)。测得实验前后装置B增重4.4g。下列说法正确的是( )
A.装置B的作用是吸收反应生成的H2O和CO2
B.实验开始前应先关闭K2,打开K1,让CO通一段时间
C.根据实验数据进行计算,可以确定该固体为Cu2O
D.若缺少装置C,则实验所得Cu、O个数比偏高
15.甲、乙、丙三种物质中均不含金属元素且均含地壳中含量最多的元素,丙在通常状况下是气体。它们之间的相互关系如图3所示(“→”表示转化关系,部分反应物、生成物及反应条件省略)。下列说法中错误的是( )
A.若丙是植物光合作用的原料,则甲可能使紫色石蕊试液变红
B.若丙是植物光合作用的产物,则甲、乙的组成元素可能相同
C.在上述A、B两种情况中,甲→丙的反应均可能是化合反应
D.在上述A、B两种情况中,乙都可能是水
二、填空题
16.以下物质:①金刚石;②石油;③氦气;④干冰。
(1)可用于人工降雨和舞台制造“云雾”效果的物质是 _________ (填序号,下同);
(2)通电时,能发出粉红色的光的物质是 _________ ;
(3)可用来切割玻璃的是 _________ ;(4)属于化石燃料的是 _________ ;
17.如图是初中化学中常见物质间的转化关系,其中,在通常情况下,F、G是组成元素相同的两种气体;Q、R都是黑色粉末;E是生活中常用的调味品(图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应条件和生成物略去)。请回答:
(1)A、G的化学式为: , 。
(2)反应②的化学方程式为 ;
反应③的化学方程式为 。
18.碳元素是组成物质的基本元素,“碳循环”也是自然界重要的循环,根据所学完成下题:
(1)碳元素形成的单质除金刚石、石墨外,还有一种物质的分子类似足球状,这种物质的化学式为________。
(2)CO2常用于灭火,但镁着火不能用CO2灭火,原因是它们能发生反应,请写出该置换反应的化学方程式
(3)科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环.
为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量 溶液,若观察到试管内 ,则分解不完全。
② 上述设想的优点有
19.2014年青奥会将在南京举行,为了控制汽车尾气给空气造成的污染,南京市在燃料的使用和管理等方面采取了一些有效措施,使用节能环保车也是未来的发展趋势。
图1 天然气公交车 图2 氢动力概念跑车 图3国产电动轿车
(1)图1中公交车使用的天然气主要成分是 ,其完全燃烧的化学方程式为 。
(2)图2是2011年上海国际汽车展中,我国自行研制的氢动力概念跑车。汽车最理想的清洁燃料是氢气,氢气在空气中燃烧的化学方程式为 ,但氢动力汽车目前还不能普及,原因是 (答一点即可)。
(3)图3是由上汽集团自主研发的“叶子”概念车,该车顶部的“大叶子”是一部光电转化器,可以把 能转化为电能。
20.某同学为研究动物的呼吸作用,用下如图的装置进行实验,实验过程中将观察到:澄清石灰水_________,细玻璃管中的红墨水向________移动。这说明动物呼吸消耗___________,生成____________。
三、实验题
21.下列图示装置常用于实验室制取气体。请根据下图回答有关问题。
请结合图示实验装置,回答下列问题.
(1)写出①、②号仪器的名称:①____________________;②________________ ;
(2)用高锰酸钾制取氧气选用的发生装置是______(选填序号),反应的化学方程式为________;
(3)要获得干燥的O2,应先将气体通过盛有______(填名称)的D装置,气体应从_______端(填“左、右”)通入,再用E装置收集,气体应从______端通入(选填“a”或“b”),
(4)实验室可用B或C装置制CO2,反应的化学方程式为________,相对于B装置,C装置的优点有________。若制得的CO2气体不纯,可能的原因是________。
(5)已知NH3是一种无色有刺激性气味的气体,密度比空气的小,极易溶于水,实验室若用F装置收集NH3,油层的作用是______.
22.小明对妈妈杀鱼时从鱼肚内取出的鱼鳔(如图所示)产生了兴趣,他以“探究鱼鳔内气体体积和成分”作为研究性学习的课题,小明通过查阅有关资料获知:这种鱼鳔内氧气约占1/4,其余主要为二氧化碳和氮气,且二氧化碳能溶于水。探究分两步进行:
(1)测量鱼鳔内气体体积。小明设计了两种方法:A 用医用注射器抽取鱼鳔内气体,测量其体积;B 在水下刺破鳔,用排水集气法收集鱼鳔内气体并测量其体积(如图所示),你认为测量结果不准确的一种方法是__________,理由是__________________________________。
(2)探究鱼鳔内气体的成分。现有两瓶鱼鳔内的气体,请你帮助小明设计实验进行验证。
实验目的 实验方法 实验现象
验证鱼鳔内含O2 ①
验证鱼鳔内含CO2 ②
四、推断题
23.A→I是初中化学常见的物质,它们的相互转化关系如图所示,其中C、D、E为无色气体,H是石灰石的主要成分。回答下列问题:
(1)写出下列物质的化学式:
D_____;
G_____。
(2)反应①的基本反应类型为_____。
(3)写出反应②的化学方程式_____。
24.A~I为初中化学常见物质,相互转化关系如图所示,“→”表示转化关系,“—”表示相互之间能发生反应(部分反应物、生成物以及反应条件省略)。其中,A、C、F、H含相同金属元素且所属物质类别不同,H、I类别相同;A、B为金属单质,B为紫红色;C、D为氧化物,C为红棕色固体;G溶液呈蓝色,E的浓溶液常用作某些气体的干燥剂。请回答问题:
(1)B的化学式________,F的名称__________。
(2)写出化学方程式:
反应①______________________________,
反应④_______________________________。
五、计算题
25.动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点是可以充电循环使用。电瓶的正极材料是二氧化铅(PbO2),负极材料是金属铅(Pb),电瓶内所加液体是溶质质量分数为36%的稀硫酸,放电(为外界供电)时发生反应的化学方程式如下:PbO2(固)+2H2SO4+Pb=2PbSO4(固)+2H2O。当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电。
(1)电瓶在放电时,_________能转化为电能。
(2)假如某个电瓶中铅的质量为1800 g,内装36%的稀硫酸1200 g,当有310.5 g的铅参加反应时,需消耗稀硫酸中溶质_____克?此时电瓶中硫酸溶液溶质的质量分数是_____?(最后结果精确到0. 01%)
26.某化学兴趣小组取12.5克的大理石样品(杂质不与盐酸反应)加入到一定量的稀盐酸中,产生CO2的质量与稀盐酸的质质量关系如图所示。请计算:
(1)生成CO2的质量是_____g。
(2)该盐酸的溶质质量分数为__________(计算结果保量0.1%)。
试卷第6页,总8页
参考答案
1.D
【解析】
【详解】
A、带火星的木条在氧气中能燃烧,但在空气和二氧化碳中都会熄灭,故此项错误; B、氧气、空气都不能使紫色石蕊试液变红,二氧化碳能与水反应生成碳酸,能使紫色石蕊试液变红,故此项错误;C、澄清石灰水只有遇到二氧化碳时才变浑浊,氧气和空气都不能使澄清石灰水变浑浊,不能鉴别氧气和空气,故此项错误;D、燃着的木条在氧气中剧烈燃烧,在空气中安静燃烧,在二氧化碳中熄灭,现象明显,故此项正确。故选D。
【点睛】
鉴别题要做到同一操作下或与同一物质反应时,现象要不同。
2.C
【解析】A. 短时间不使用电脑,将其转为休眠模式,节约用电,符合“低碳生活”,不符合题意;B. 减少使用私家车次数,多乘公交或骑自行车,符合“低碳生活”,不符合题意;C. 多作用一次性餐,不符合“低碳生活”,符合题意;D. 用传统发条式闹钟代替电子钟,减少能源的使用,符合“低碳生活”,不符合题意。故选C。
3.A
【解析】当高层楼房起火,火势凶猛千万不要沿楼梯迅速下楼,更不能跳楼,由于楼层很高,跳楼会造成可能更坏的结果,由于燃烧产生大量烟尘,为了防止烟尘被吸入体内,用湿毛巾堵住口鼻,由于温度高烟尘会聚集在上方,所以要匍匐前进寻找安全出口,封闭房门是为了防止火势引入房内,可以迅速转到阳台,用绳索下坠而逃生.
故答案为:②③④⑤
故选A
4.C
【解析】
【详解】
A、红磷在空气中燃烧,产生大量白烟,故选项错误;
B、未引燃的铁丝伸入氧气瓶中不能燃烧,故选项错误;
C、二氧化碳和石灰水反应生成碳酸钙沉淀,会看到浑浊现象,故选项正确;
D、木炭在高温下还原氧化铜生成铜,固体由黑色逐渐变红,故选项错误。
故选C。
5.C
【解析】
试题分析:碳在氧气不充分的情况下燃烧会产生一氧化碳,在氧气充分的情况下燃烧产生的是二氧化碳。
A、氧气能供给呼吸,无毒,故A错误;
B、氮气是无毒的气体,故B错误;
C、一氧化碳有毒,能阻碍血红蛋白与氧气结合,故C正确;
D、二氧化碳会使人窒息,但无毒,故D错误。故选C
考点:一氧化碳的毒性
点评:物质的性质决定物质的用途,熟记物质的性质是解题的关键;另外,CO是一种有毒气体,而CO2没有毒性,但含量大时也能使人窒息而亡。
6.D
【解析】A.有些物质能自然,如白磷自然!
B.利用所学的燃烧的条件,没氧气不行,温度达不到着火点不行,只有同时具备这两个条件才能燃烧;
C.可燃物都能燃烧!
7.B
【解析】A、通常情况下,CO2既不燃烧也不支持燃烧,正确;B、CO2没有还原性,不能用来冶炼金属,错误;C、绿色植物的光合作用能吸收CO2,正确;D、干冰是固体的二氧化碳,干冰升华(由固态变成气态)时会吸收大量热,使空气中的水蒸气液化成水滴降落,形成降雨,正确。故选B。
8.D
【解析】通过题干,我们知道这么两条信息:(1)反应时将CO和O2转化为了CO2;(2)在过程中四氧化三钴纳米棒作催化剂.这样也可以写为:2CO+O2 2CO2.
A、因为所有化学反应都遵循质量守恒定律,原子种类和数目都不变.故A正确;
B、根据化学反应式 2CO+O2 2CO2可知,CO与O2的质量比为7:4,故B正确;
C、反应前后四氧化三钴纳米棒化学性质不发生变化.因为四氧化三钴纳米棒作催化剂.故C正确;
D、根据质量守恒定律可知道化学反应中原子的种类、原子的数量和原子的数目不会改变,但分子的数目是会改变的.故D错误.
故选D.
9.B
【解析】
试题分析∶A.炒菜时油锅着火立即盖上锅盖——使可燃物与空气隔绝。故A正确。B.木材着火用水泼灭——降低了可燃物周围环境的稳定使温度低于可燃物的着火点。故B错误。C.扑灭森林火灾开辟隔离带——清除和隔离可燃物。故C正确。D.不慎将酒精洒到桌面燃烧,用湿布覆盖——隔氧又降温。故D正确。
考点∶考查与灭火相关的知识。
10.D
【解析】A、水可以使燃烧熄灭,水能起到隔绝空气、使温度降到可燃物的着火点以下的灭火原理;而不只是隔绝空气,故选项错误.
B、水可以使燃烧熄灭,水能起到隔绝空气、使温度降到可燃物的着火点以下的灭火原理;可燃物的着火点一般是不变的,不能降低可燃物的着火点,故选项错误.
C、水可以使燃烧熄灭,水能起到隔绝空气、使温度降到可燃物的着火点以下的灭火原理;而不只是降低温度,故选项错误.
D、水可以使燃烧熄灭,水能起到隔绝空气、使温度降到可燃物的着火点以下的灭火原理,故选项正确.
故选:D.
11.C
【解析】A、液氧和氧气都能助燃,是因为它们是由氧分子构成的,同种的分子性质相同,正确;B、缉毒犬能根据气味发现毒品,是因为毒品中含有的分子是在不断的运动的,向四周扩散,使缉毒犬闻到毒品气味,正确;C、实验室没有二氧化锰时,可加热氯酸钾与高锰酸钾的混合物也能较快制取氧气,且增加氧气的质量,高锰酸钾不是催化剂,催化剂在化学反应前后质量和化学性质都不会改变,错误;D、生产乙醇汽油,不但能节约石油资源也能减少环境污染,正确。故选C。
点睛:分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种的分子性质相同,不同种的分子性质不同,可以简记为:“两小运间,同同不不”。
12.B
【解析】A、葡萄酿酒过程中有新物质酒精生成,属于化学变化;B、根据石油中各成分沸点不同进行分离过程中没有新物质生成,属于物理变化;C、紫外线能够破坏微生物机体细胞的分子结构,有新物质生成,属于化学变化;D、煤隔绝空气加热过程中有新物质焦炭、煤焦油、焦炉煤气生成,属于化学变化。故选B。
点睛:解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化。
13.D
【解析】试题分析:化石燃料是古代生物遗体在特定地质条件下形成的,可作燃料和化工原料的沉积矿产。包括煤、油页岩、石油、天然气等。A、煤属于化石燃料。B、石油属于化石燃料。C、天然气属于化石燃料。D、氢气可以人工制造,不属于化石燃料。故选:D。
考点:化石燃料及其综合利用
14.B
【解析】
A、装置A中的反应是CuO+COCu+CO2,Cu2O+CO2Cu+CO2,反应中没有生成水,装置B的作用是吸收反应生成的CO2,错误;B、一氧化碳是具有可燃性的气体,实验开始前应先关闭K2,打开K1,让CO通一段时间,排尽玻璃管中空气,防止加热时发生爆炸,正确。C、由题意可知装置B增重4.4g,是吸收二氧化碳的质量,由质量守恒定律可知,铜的氧化物中氧元素的质量是:4.4g××100%× =1.6g,铜原子与氧原子的个数比= :=2:1,所以确定该固体为Cu2O或Cu和CuO的混合物或Cu2O、Cu和CuO的混合物,错误;D、若缺少装置C,装置B增重的质量偏大,则实验所得Cu、O个数比偏低,错误。故选B。
15.C
【解析】地壳中含量最多的元素是氧元素。A. 若丙是植物光合作用的原料,则丙是二氧化碳,则甲可能使紫色石蕊试液变红,甲应为碳酸,碳酸分解生成二氧化碳和水,二氧化碳和碱反应生成水;B. 丙是气体,若丙是植物光合作用的产物,丙应氧气,则甲、乙的组成元素可能相同,甲是过氧化氢、乙是水,过氧化氢分解生成水和氧气;C. 在上述A、B两种情况中,甲→丙的反应均可能是由一种物质生成两种物质的分解反应化;D. 在上述A、B两种情况中,碳酸、过氧化氢分解都生成水;故选C
16.(1)④ (2)③ (3)① (4)②
【解析】
试题分析:(1)干冰升华时要吸收大量的热,使周围的温度降低,从而使水蒸气液化,所以可用于人工降雨和舞台制造“云雾”效果
(2)稀有气体:化学性质很不活泼,通电时能发出不同颜色的光,所以,通电时,能发出粉红色的光的物质是氦气
(3)金刚石是自然界中最硬的物质,用于刻划玻璃、钻探机的钻头
(4)三大化石燃料:煤、石油、天然气
考点:常见物质的性质
17.(1) CaCl2 CO (2) Na2CO3+2HCl=2NaCl+H2O+CO2↑ CaCO3 CaO+CO2↑
【解析】
试题分析:E是生活中常用的调味品,说明E是氯化钠,F、G是组成元素相同的两种气体;二者是一氧化碳和二氧化碳,B和C反应得到氯化钠和F气体,说明F是二氧化碳,则G是一氧化碳,而R和Q是黑色固体物质,说明R是碳单质,而Q是氧化铜粉末,D是碳酸钙,所以A和B是氯化钙和碳酸钠,而B和C发生反应得到氯化钠,说明B中含有钠元素,因此B是碳酸钠,而A是氯化钙,C是盐酸。带入后恰好符合题意。
考点:物质的鉴别 物质的性质和变化
18.C60 2Mg+CO2点燃2MgO+C 稀盐酸 有气泡产生
原料易得且可循环利用、充分利用太阳能(合理即可)
【解析】
试题分析:碳元素形成的单质除金刚石、石墨外,还有一种物质的分子类似足球状,这种物质的化学式为C60,又叫足球烯,三种都是由碳元素形成的不同单质,CO2常用于灭火,但镁着火不能用CO2灭火,原因是它们能发生反应,反应的化学方程式2Mg+CO2点燃2MgO+C,为确定步骤2中的碳酸钙是否完全分解,即没有碳酸钙了,可以取少量固体于试管中,滴加过量的稀盐酸溶液,若观察到试管内有气泡产生,则分解不完全,上述设想的优点是原料易得且可循环利用、充分利用太阳能等。
考点:二氧化碳、一氧化碳的性质
19.(1)CH4 ; (2) ;成本高(贮存困难;不纯易爆等,其他合理的答案也给分)(3)太阳
【解析】
试题分析:(1)天然气的主要成分为甲烷,其和氧气燃烧生成水和二氧化碳;(2)氧气和氢气点燃生成水,但氢动力汽车目前还不能普及,原因是成本高、贮存困难、不纯易爆等原因;(3)光电转换器可以把太阳能转换成电能。
考点:化学与环境污染
点评:环境保护类的题目一直是近几年中考的考察热点,常和实事结合,可在选择题、填空题中考察,较为简单。
20.变浑浊左氧气二氧化碳
【解析】
青蛙在呼吸过程中吸入氧气,呼出二氧化碳,二氧化碳被澄清石灰水溶液吸收,变浑浊,由于装置内气体的量减小,压强变小,导致细玻璃管中红墨水倒吸入瓶内,即向左移动。这说明动物呼吸消耗氧气,生成二氧化碳。
点睛:青蛙在呼吸过程中消耗氧气,呼出二氧化碳,由此来解答问题。
21. 酒精灯 分液漏斗 A 2KMnO4K2MnO4+MnO2+O2↑ 浓硫酸 左 b CaCO3 + 2HCl = CaCl2 + CO2 + H2O, 随时对地控制反应速度、节约药品 盐酸浓度过大 防止氨气溶于水
【解析】(1)据图可知①号仪器的名称是酒精灯;②号仪器的名称是分液漏斗;(2)高锰酸钾在加热的条件下可以分解产生二氧化锰、锰酸钾和氧气;化学方程式为:2KMnO4K2MnO4+MnO2+O2↑,实验室用高锰酸钾制取氧气时,反应物的状态是固体,反应条件是加热,可选用的气体发生装置是A;(3)浓硫酸具有吸水性,而氢氧化钠溶液没有吸水性,所以应该用浓硫酸来进行干燥,并从长管进入;氧气的密度比空气大,所以用E装置来收集氧气时,氧气从长管进入;(4)实验室可用B或C装置制CO2,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;C相对于B装置的优点是能使反应随时进行或停止;盐酸浓度过大会挥发出氯化氢气体;(5)若用F装置收集NH3,油层的作用是防止氨气溶于水。
22.(1) B 、鱼鳔内CO2能溶于水;
(2)将燃着的木条放入含有鱼鳔内气体的集气瓶中;木条继续燃烧。向另一含有鱼鳔内气体的集气瓶中加入少量澄清石灰水,振荡;石灰水变浑浊
【解析】(1)二氧化碳溶于水,不能用排水法收集.
(2)氧气具有助燃的特性,燃着的木条放入瓶中木条可以继续燃烧;二氧化碳可以使澄清石灰水变浑浊.
23.H2;Ca(OH)2;分解反应;Ca(OH)2+CO2═CaCO3↓+H2O;
【解析】
【分析】
根据题目给出的流程图和信息:根据“H是石灰石的主要成分”,则推测H为碳酸钙;结合图框:B通电生成DC,则B为水,D为氢气,C为氧气;A分解生成CF,则为双氧水分解生成氧气和水;根据二氧化碳与氢氧化钙反应生成碳酸钙和水等知识,则F为碳,E为二氧化碳,G为氢氧化钙,代入检验,符合题意。
【详解】
(1)根据分析,下列物质的化学式:D为H2;G为Ca(OH)2;
(2)反应①为双氧水分解生成氧气和水,其反应的基本反应类型为分解反应;
(3)反应②为二氧化碳与氢氧化钙反应生成碳酸钙和水,其反应的化学方程式Ca(OH)2+CO2═CaCO3↓+H2O。
24. Cu 硫酸铁 Fe2O3+3CO高温2Fe+3CO2 (合理均可) CuO+H2SO4==CuSO4+H2O
【解析】A、B为金属单质,B为紫红色,因此B为铜,铜反应产生D;C、D为氧化物,C为红棕色固体,因此D是氧化铜,C是氧化铁;A、C、F、H含相同金属元素且所属物质类别不同,因此A应该是铁;E的浓溶液常用作某些气体的干燥剂,因此E是硫酸,则F是硫酸铁;硫酸铁能够转化为H,H能够和硫酸反应,因此H应该是碱氢氧化铁;硫酸和氧化铜反应产生的G,G溶液呈蓝色,因此G是硫酸铜,反应产生I,H、I类别相同,因此I是碱氢氧化铜,经过验证,推导正确,因此:
(1)B是铜,化学式为Cu;F为Fe2(SO4)3,化学名称是硫酸铁;
(2)反应①可以是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:3CO+Fe2O32Fe+3CO2;硫酸和氧化铜反应的化学反应方程式为:CuO+H2SO4═CuSO4+H2O。
点睛:解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可;A、B为金属单质,B为紫红色;C、D为氧化物,C为红棕色固体;G溶液呈蓝色,E的浓溶液常用作某些气体的干燥剂,均为解题的突破口,可初步确定B为铜、C为氧化铁,G为硫酸铜溶液,E为浓硫酸,再结合物质间的转化关系,逐一推断其它物质。
25. 化学 294g 14.38%
【解析】(1)放电时的电能由反应PbO2(固)+2H2SO4+Pb=2PbSO4(固)+2H2O而产生,因此此过程为化学能转变为电能的过程;(2)设需消耗硫酸的质量为x,同时生成水的质量为y;PbO2(固)+2H2SO4+Pb=2PbSO4↓+2H2O
196 207 36
x 310.5g y
,
x=294g,y=54g,
36%的稀硫酸1200克稀硫酸中硫酸的质量=1200g×36%=432g,则反应后还剩余硫酸的质量=432g-294g=138g;剩余硫酸溶液的质量=1200g-294g+54g=960g;
硫酸溶液溶质的质量分数=×100%=14.38%。
26. 4.4 7.3%
【解析】本题考查了化学反应方程式与溶质质量分数相结合的简单计算。解题的关键是读懂关系图中的数据与化学反应的关系。
(1)根据关系图可知,生成的二氧化碳的质量为4.4g;
(2)设:该盐酸的溶质质量分数为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
100g×x 4.4g
x=7.3%
答:(1)生成CO2的质量是 4.4g。
(2)该盐酸的溶质质量分数为7.3%。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
