山东科技 选修4 模块测试a
图片预览



文档简介
同步检测十一 模块综合(A卷)
(时间:90分钟满分:100分)
可能用到的相对原子质量:C:12H:1O:16N:14
第Ⅰ卷(选择题,共45分)
一、选择题(本题包括15个小题,每题3分,共45分。每小题只有一个选项符合题意)
1.为防止大气污染、节约燃料、缓解能源危机,如右图所示,燃烧产物如CO2、H2O、N2等可以利用太阳能最终转化为
A.生物能 B.化学能 C.热能 D.电能
答案:C 解析:关键信息是据图示可知,利用太阳能可以使CO2、H2O、N2重新组合为可燃物,而可燃物燃烧后转化为燃烧产物并放出热量,产物又结合太阳能转化为燃料,如此循环可知太阳能最终转化为热能。
2.(2008广东高考)电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
答案:C 解析:选项A中ZnMn干电池作负极的是Zn,石墨作电池的正极,只起导电的作用,被腐蚀的是Zn;选项B中氢氧燃料电池是把化学能直接转化为电能,而不是把热能直接转化为电能;太阳能电池的主要材料是高纯度的单晶硅,它的能量转化率较高。
3.用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按右图所示步骤分开五种离子。则溶液①②③④是
A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
答案:D 解析:根据溶液中含有Fe3+、Al3+、Ba2+、Ag+、K+,而用的分离试剂为H2SO4、NaOH、NH3·H2O、NaCl溶液,结合题目的分离流程图示,第①步只分离出一种沉淀,所以只能向溶液中加入NaCl溶液以沉淀Ag+而分出,同时对其他离子无影响,因此试剂①为NaCl溶液;这样余下的溶液中只有Fe3+、Al3+、Ba2+、K+,而加入试剂②后得到的沉淀和溶液均需要再加入试剂进行分离,说明加入试剂②后将得到两种离子的沉淀,另两种离子则在溶液中,因此试剂②为NH3·H2O,形成的沉淀为Fe(OH)3和Al(OH)3,另两种离子Ba2+和K+则留在溶液中;对于沉淀Fe(OH)3 和Al(OH)3只能用NaOH溶液将二者分离,而对溶液中的Ba2+和K+则可以通过加入硫酸溶液使Ba2+形成BaSO4沉淀而分离,所以试剂③为NaOH溶液,试剂④为H2SO4溶液。
4.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)Ca2++2OH-。加入以下溶液,可使Ca(OH)2减少的是
A.Na2S溶液 B.AlCl3溶液 C.NaOH溶液 D.CaCl2溶液
答案:B 解析:Na2S水解显碱性,增大了溶液中OH-的浓度;NaOH 提供大量OH-;CaCl2会增大Ca2+的浓度,所以A、C、D选项都会使溶解平衡向左移动,而AlCl3中的Al3+消耗OH-,使平衡向右移动,促进Ca(OH)2的溶解。
5.用0.1mol·L-1NaOH溶液滴定0.1mol·L-1盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是
A.4 B.7.2 C.10 D.11.3
答案:C 解析:由于滴定至终点多滴了一滴NaOH溶液,即NaOH溶液过量,所以滴定后溶液呈碱性。溶液中,则溶液中c(H+)=1×10-10mol·L-1,所以溶液的pH为10。
6.某溶液中含有大量的下列离子:Fe3+、、Al3+和M离子,且这四种离子的物质的量之比为2∶4∶1∶1,则M离子可能为下列中的
A.Na+ B.I- C.S2- D.Cl-
答案:D 解析:根据题目条件和电荷守恒可知M应带有1个单位的负电荷,又碘离子不能与铁离子大量共存,所以M只能为选项中的氯离子。
7.(2008广东高考)盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
答案:C 解析:A项中,生成Na2CO3溶液,会发生水解,生成,所以A错。
电荷守恒:c(H+)+c(Na+)=c()+2c()+c(OH-)物料守恒:c(Na+)=c()+ c()+c(H2CO3) 两式相减得 :c(H+)+c(H2CO3)=c()+c(OH-),所以B项错误。
C项中,生成CH3COONa,CH3COO-水解呈碱性,故C正确。
相同pH,相同体积的HCl和CH3COOH,因为CH3COOH为弱酸,所以CH3COOH的物质的量浓度大,CH3COOH所消耗的NaOH的物质的量多,D错。
8.(2008重庆高考)如右图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是
A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生
答案:B 解析:a、b均能形成原电池,a中Fe作负极:Fe Fe2++2e-, 发生氧化反应,Cu作正极:O2+4e-+2H2O4OH-,发生还原反应,铜丝附近呈现红色;B中Al作负极:Al-3e-Al3+,发生氧化反应,而Fe作正极:2H++2e-H2↑,发生还原反应。
9.早在1807年化学家戴维用电解熔融氢氧化钠制得钠,4NaOH(熔)4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
3Fe+4NaOHFe3O4+2H2↑+4Na↑。下列有关说法正确的是
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH-H2↑+O2↑+2e-
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨为阳极,铁为阴极
答案:D 解析:A项中,阳极反应式应为:4OH--4e-2H2O+O2↑;B项中,应为钠的还原性比铁强;C项中,前者转移电子数为4,后者为8。
10.对于重水(D2O)可以采用同pH一样的定义来规定pD,pD=-lg[D+],则pOD=(lg[OD-]。已知某温度下重水电离D2OD++OD-达一平衡时,[D+][OD-]=1×10-15,据此,在该温度下的下列叙述正确的是
A.0.1molDCl溶于D2O配成1L溶液,其pD=1
B.0.001molNaOD和重水配成1L溶液,pD=11
C.纯重水的pD=7
D.用重水配制FeCl3溶液,溶液中pD>pOD
答案:A 解析:由于[D+]·[OD-]=1×10-15,为中性,故C错。A项,pD=-lg[D+]=1;B项,pD=13,故A正确,B错误。由于FeCl3水解呈酸性,[D+]与pD是相反的关系,应是pD<pOD才对,故D错。本题应选A。
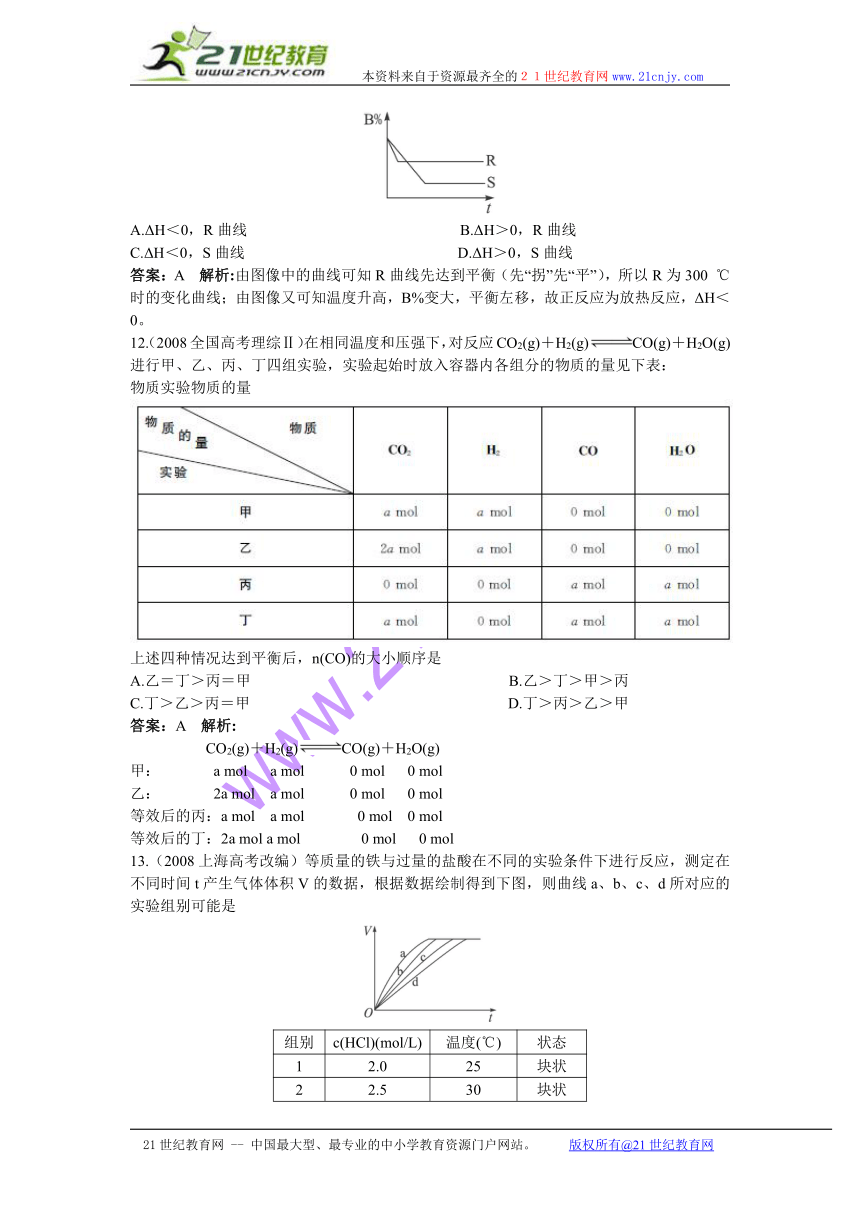
11.右图中的两条曲线分别表示200℃和300℃时,反应A(g)+B(g)C(g)ΔH体系中B的百分含量和时间t的关系,下列对ΔH的数值和表示300℃时的变化曲线的说法正确的是
A.ΔH<0,R曲线 B.ΔH>0,R曲线
C.ΔH<0,S曲线 D.ΔH>0,S曲线
答案:A 解析:由图像中的曲线可知R曲线先达到平衡(先“拐”先“平”),所以R为300 ℃时的变化曲线;由图像又可知温度升高,B%变大,平衡左移,故正反应为放热反应,ΔH<0。
12.(2008全国高考理综Ⅱ)在相同温度和压强下,对反应CO2(g)+H2(g)CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
物质实验物质的量
上述四种情况达到平衡后,n(CO)的大小顺序是
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
答案:A 解析:
CO2(g)+H2(g)CO(g)+H2O(g)?
甲: a mol a mol 0 mol 0 mol?
乙: 2a mol a mol 0 mol 0 mol?
等效后的丙:a mol a mol 0 mol 0 mol?
等效后的丁:2a mol a mol 0 mol 0 mol
13.(2008上海高考改编)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是
组别
c(HCl)(mol/L)
温度(℃)
状态
1
2.0
25
块状
2
2.5
30
块状
3
2.5
50
块状
4
2.5
30
粉末状
①4—3—2—1 ②1—2—3—4 ③3—4—2—1 ④1—2—4—3
A.①或④ B.②或④ C.①或② D.①或③
答案:D 解析:化学反应速率与温度、浓度和固体物质的表面积的大小有关,实验1的盐酸的浓度最小,反应的温度最低,所以化学反应速率最慢;由于实验3的反应温度比实验2的反应温度高,所以反应速率实验3大于实验2;而实验4和实验3虽然浓度相同,但反应的温度不同,物质的状态也不相同,所以不能比较。
14.(2008宁夏高考)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)NH3(g)+HI(g);②2HI(g)H2(g)+I2(g)。达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
A.9 B.16 C.20 D.25
答案:C 解析:由平衡时氢气的浓度可求得反应②分解消耗HI的浓度,c(HI)=0.5 mol·L-1×2=1 mol·L-1,故①式生成c(HI)①=c(HI)平衡+c(HI)分解=4 mol·L-1+1 mol·L-1=5 mol·L-1,c(NH3)平衡=c(HI)①=5 mol·L-1,根据化学平衡常数公式K=c(NH3)平衡×c(HI)平衡=5 mol·L-1×4 mol·L-1,故答案选C。
15.25℃时,在25mL0.1mol·L-1的氢氧化钠溶液中,逐滴加入0.2mol·L-1CH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是
A.若B点的横坐标a=12.5,则有c(Na+)=c(CH3COO-)
B.C点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
C.D点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.对曲线上A、B间任何一点,溶液中都有:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
答案:C 解析:A不对,因二者刚好反应时,由于生成物水解,溶液呈碱性,故c(Na+)不等于c(CH3COO-);B不对,当c(H+)=c(OH-)时,根据电荷守恒c(Na+)=c(CH3COO-);根据物料守恒判断出C正确,;D不对,初始阶段 c(OH-) > c(CH3COO-)。
第Ⅱ卷(非选择题,共55分)
二、填空题(本题包括4个小题,共50分)
16.(10分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃)
10
20
30
加热煮沸后冷却到50℃
pH
8.3
8.4
8.5
8.8
甲同学认为,该溶液的pH升高的原因是的水解程度增大,故碱性增强,该反应的离子方程式为_____________。乙同学类比加热Ca(HCO3)2溶液,会出现___________现象,认为NaHCO3溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度___________(填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则说明___________(填“甲”或“乙”)判断正确。试剂X是___________。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH____________(填“高于”“低于”或“等于”)8.3,则说明另一判断正确。
(3)加热Ca(HCO3)2溶液发生的离子方程式为_______________________________________。
答案:+H2OH2CO3+OH-浑浊大于(1)乙B(2)等于
(3)Ca2++CaCO3↓+CO2↑+H2O
解析:(1)加热煮沸NaHCO3溶液后,无论其分解与否,加入A、C,都可产生沉淀。若证明其未分解,只能加入BaCl2溶液,因为它可与Na2CO3反应生成?CaCO3?,而不与NaHCO3溶液反应。(2)由(1)知另一判断即为甲的观点,若甲的观点正确,则加热后的溶液冷却到10 ℃后pH应不变。(3)Ca(HCO3)2溶液加热会分解为难溶的CaCO3。
17.(15分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。工业上生产硝酸铵的流程图如右图:
请回答下列问题:
(1)已知:N2(g)+3H2(g)2NH3(g),ΔH=-92.4kJ·mol-1?。
①图中气体X的成分是___________,理由是_________________________________。
②在上述条件下向一密闭容器中充入1molN2和?3molH2?,充分反应后,放出的热量是46.2kJ,则N2的转化率是___________。
③为提高合成氨反应的效率,实际生产中宜采取的措施有___________。
A.降低温度 B.最适合催化剂活性的适当高温
C.增大压强 D.降低压强
E.循环利用 F.原料气中氮气和氢气的配比为1∶2.8G.及时分离出氨
(2)已知氨的催化氧化反应发生后,不需要继续加热,铂铑合金网仍然会保持红热。试写出该反应的化学平衡常数表达式K=___________,当温度升高时,K值___________(填“增大”“减小”或“无影响”),其原因是_______________________________________________________。
(3)常温下某无色透明溶液中仅含有和等四种离子,请回答下列问题:
①该溶液所含的离子中除上述两种外还应有___________(填离子符号)两种离子。
②该溶液所含的上述四种离子的物质的量浓度大小有多种可能,以下选项中不可能的是______________。
A.c()>c()>c(H+)>c(OH-)
B.c()>c(H+)>c()>c(OH-)
C.c()>c(OH-)>c()>c(H+)
D.c()>c()>c(OH-)>c(H+)
E.c()>c(OH-)>c()>c(H+)
③如溶液中c()=c(),则溶液中的溶质为_______(填化学式),该溶液的pH____7(填“<”“>”或“=”)
(4)工业上还可利用侯氏制碱法制取小苏打,进而得到纯碱。
已知:Na2CO3·10H2O(s)====Na2CO3(s)+10H2O(g) ΔH1=+532.36kJ·mol-1?
Na2CO3·10H2O(s)====Na2CO3·H2O(s)+9H2O(g) ΔH1=+473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:__________________________。
答案:答案:(1)①N2、H2、NH3该反应为可逆反应,不可能进行完全②50%③BCEFG
(2) 减小 氨的催化氧化反应是放热反应?(3)①H+、OH-?②C?③NH4NO3、NH3·H2O=(4)Na2CO3·H2O(s)====Na2CO3(s)+H2O(g)ΔH=58.73 kJ·mol-1
解析:(1)①合成氨反应是可逆反应,不可能进行完全,所以气体X是混合气体。②热量与转化的氮气成正比,所以氮气的转化率为(46.2÷92.4)×100%=50%。③提高氨的合成效率,既要提高反应速率,又要提高氮气、氢气,尤其是氢气的转化率。A条件是降低了反应速率,不利于提高氨的产量,D条件不仅降低了反应速率,还不利于平衡的正向移动,降低了氢气的转化率。(2)氨的催化氧化反应发生后,铂铑合金网仍然会保持红热,说明该反应是放热反应,所以升温后,平衡逆向移动,平衡常数减小。(3)①水溶液中一定有H+、OH-。②由题意知溶质可能是NH4NO3或NH4NO3、NH3·H2O或NH4 NO3、HNO3,且若为混合物时,物质的相对量不同时,离子浓度大小顺序不同。③溶液显中性,电荷守恒式为c()+c(H+)=c(OH-)+ c(),若c()=c(),则c(H+)=c(OH-),溶液显中性。(4)通过观察两个热化学方程式,根据盖斯定律,将两式相减,即可得到热化学方程式。
18.(15分)某无色澄清溶液,可能含有Cu2+、Ba2+、、、I-、Cl-、H+、K+等离子中的两种或多种,做如下实验:
①取适量溶液加入少量Na2SO3后有气体产生,也有白色沉淀生成,再加盐酸沉淀不消失,过滤;
②在①的滤液中加入AgNO3溶液,又有白色沉淀生成,再加硝酸沉淀不消失。
回答下列问题:
(1)在第①步反应中生成无色易溶于水的气体是__________,生成的白色沉淀是__________;在第②步反应中生成的白色沉淀是____________。
(2)由以上实验,可判断原溶液中一定含有的离子是____________,一定不含有的离子是____________。
(3)设计一个简单实验,对可能含有的阴离子进一步确认:__________________________。
答案:(1)SO2 BaSO4 AgCl(2)H+、、Ba2+ Cu2+、、I-(3)取原液少许,加入AgNO3溶液,若有白色沉淀,再加硝酸沉淀不消失,则含Cl-,否则不含(未取原液不给分,因原溶液中已含H+,加不加硝酸均可)
解析:由无色澄清溶液知:不含有Cu2+(蓝色);由①知:溶液中含有H+、、Ba2+,则不含有(与Ba2+生成沉淀)、I-(易被H+、氧化);若由②推得“一定含有Cl-”则错,因为①操作中已加入盐酸。
19.(10分)将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
金属
电子流动方向
电压(V)
A
A→Cu
+0.78
B
Cu→B
-0.15
C
C→Cu
+1.35
D
D→Cu
+0.30
已知:构成两电极的金属的金属活泼性相差越大,电压表的读数越大。请依据表中数据判断:
(1)_________金属可能是最强的还原剂;_________金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上看到析出蓝色沉淀的是_________(填字母)金属。其对应的原电池的电极反应式为:负极_________,正极_________。
答案:(1)CB(2)B2Cu-4e-2Cu2+ ;2H2O+O2+4e-4OH-
解析:(1)因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子的流动方向,各金属的活泼性顺序为C>A>D>Cu>B。
(2)若用NaOH溶液作电解质,在滤纸上能看到有蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。
三、计算题(本题5分)
20.(5分)已知下列两个热化学方程式:
①2H2(气)+O2(气)====2H2O(液) ΔH=-571.6kJ
②C2H8(气)+5O2(气)====3CO2(气)+4H2O(液) ΔH=-2220kJ
实验测得H2与C3H8的混合气体共5mol完全燃烧时放热3847kJ,则混合气体中H2与C3H8的体积比是多少?
答案:3∶1
解析:设混合气体中H2的物质的量为x,则C3H8为(5-x)
根据反应①可知H2的燃烧热为:
根据反应②可知C3H8的燃烧热为:2 220 kJ·mol-1
则:285.8x+2 220(5-x)=3 847
x=3.75(mol)
n(H2)∶n(C3H8)=V(H2)∶V(C3H8)=3.75∶1.25=3∶1
(时间:90分钟满分:100分)
可能用到的相对原子质量:C:12H:1O:16N:14
第Ⅰ卷(选择题,共45分)
一、选择题(本题包括15个小题,每题3分,共45分。每小题只有一个选项符合题意)
1.为防止大气污染、节约燃料、缓解能源危机,如右图所示,燃烧产物如CO2、H2O、N2等可以利用太阳能最终转化为
A.生物能 B.化学能 C.热能 D.电能
答案:C 解析:关键信息是据图示可知,利用太阳能可以使CO2、H2O、N2重新组合为可燃物,而可燃物燃烧后转化为燃烧产物并放出热量,产物又结合太阳能转化为燃料,如此循环可知太阳能最终转化为热能。
2.(2008广东高考)电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
答案:C 解析:选项A中ZnMn干电池作负极的是Zn,石墨作电池的正极,只起导电的作用,被腐蚀的是Zn;选项B中氢氧燃料电池是把化学能直接转化为电能,而不是把热能直接转化为电能;太阳能电池的主要材料是高纯度的单晶硅,它的能量转化率较高。
3.用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按右图所示步骤分开五种离子。则溶液①②③④是
A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
答案:D 解析:根据溶液中含有Fe3+、Al3+、Ba2+、Ag+、K+,而用的分离试剂为H2SO4、NaOH、NH3·H2O、NaCl溶液,结合题目的分离流程图示,第①步只分离出一种沉淀,所以只能向溶液中加入NaCl溶液以沉淀Ag+而分出,同时对其他离子无影响,因此试剂①为NaCl溶液;这样余下的溶液中只有Fe3+、Al3+、Ba2+、K+,而加入试剂②后得到的沉淀和溶液均需要再加入试剂进行分离,说明加入试剂②后将得到两种离子的沉淀,另两种离子则在溶液中,因此试剂②为NH3·H2O,形成的沉淀为Fe(OH)3和Al(OH)3,另两种离子Ba2+和K+则留在溶液中;对于沉淀Fe(OH)3 和Al(OH)3只能用NaOH溶液将二者分离,而对溶液中的Ba2+和K+则可以通过加入硫酸溶液使Ba2+形成BaSO4沉淀而分离,所以试剂③为NaOH溶液,试剂④为H2SO4溶液。
4.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)Ca2++2OH-。加入以下溶液,可使Ca(OH)2减少的是
A.Na2S溶液 B.AlCl3溶液 C.NaOH溶液 D.CaCl2溶液
答案:B 解析:Na2S水解显碱性,增大了溶液中OH-的浓度;NaOH 提供大量OH-;CaCl2会增大Ca2+的浓度,所以A、C、D选项都会使溶解平衡向左移动,而AlCl3中的Al3+消耗OH-,使平衡向右移动,促进Ca(OH)2的溶解。
5.用0.1mol·L-1NaOH溶液滴定0.1mol·L-1盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是
A.4 B.7.2 C.10 D.11.3
答案:C 解析:由于滴定至终点多滴了一滴NaOH溶液,即NaOH溶液过量,所以滴定后溶液呈碱性。溶液中,则溶液中c(H+)=1×10-10mol·L-1,所以溶液的pH为10。
6.某溶液中含有大量的下列离子:Fe3+、、Al3+和M离子,且这四种离子的物质的量之比为2∶4∶1∶1,则M离子可能为下列中的
A.Na+ B.I- C.S2- D.Cl-
答案:D 解析:根据题目条件和电荷守恒可知M应带有1个单位的负电荷,又碘离子不能与铁离子大量共存,所以M只能为选项中的氯离子。
7.(2008广东高考)盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
答案:C 解析:A项中,生成Na2CO3溶液,会发生水解,生成,所以A错。
电荷守恒:c(H+)+c(Na+)=c()+2c()+c(OH-)物料守恒:c(Na+)=c()+ c()+c(H2CO3) 两式相减得 :c(H+)+c(H2CO3)=c()+c(OH-),所以B项错误。
C项中,生成CH3COONa,CH3COO-水解呈碱性,故C正确。
相同pH,相同体积的HCl和CH3COOH,因为CH3COOH为弱酸,所以CH3COOH的物质的量浓度大,CH3COOH所消耗的NaOH的物质的量多,D错。
8.(2008重庆高考)如右图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是
A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生
答案:B 解析:a、b均能形成原电池,a中Fe作负极:Fe Fe2++2e-, 发生氧化反应,Cu作正极:O2+4e-+2H2O4OH-,发生还原反应,铜丝附近呈现红色;B中Al作负极:Al-3e-Al3+,发生氧化反应,而Fe作正极:2H++2e-H2↑,发生还原反应。
9.早在1807年化学家戴维用电解熔融氢氧化钠制得钠,4NaOH(熔)4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:
3Fe+4NaOHFe3O4+2H2↑+4Na↑。下列有关说法正确的是
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH-H2↑+O2↑+2e-
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨为阳极,铁为阴极
答案:D 解析:A项中,阳极反应式应为:4OH--4e-2H2O+O2↑;B项中,应为钠的还原性比铁强;C项中,前者转移电子数为4,后者为8。
10.对于重水(D2O)可以采用同pH一样的定义来规定pD,pD=-lg[D+],则pOD=(lg[OD-]。已知某温度下重水电离D2OD++OD-达一平衡时,[D+][OD-]=1×10-15,据此,在该温度下的下列叙述正确的是
A.0.1molDCl溶于D2O配成1L溶液,其pD=1
B.0.001molNaOD和重水配成1L溶液,pD=11
C.纯重水的pD=7
D.用重水配制FeCl3溶液,溶液中pD>pOD
答案:A 解析:由于[D+]·[OD-]=1×10-15,为中性,故C错。A项,pD=-lg[D+]=1;B项,pD=13,故A正确,B错误。由于FeCl3水解呈酸性,[D+]与pD是相反的关系,应是pD<pOD才对,故D错。本题应选A。
11.右图中的两条曲线分别表示200℃和300℃时,反应A(g)+B(g)C(g)ΔH体系中B的百分含量和时间t的关系,下列对ΔH的数值和表示300℃时的变化曲线的说法正确的是
A.ΔH<0,R曲线 B.ΔH>0,R曲线
C.ΔH<0,S曲线 D.ΔH>0,S曲线
答案:A 解析:由图像中的曲线可知R曲线先达到平衡(先“拐”先“平”),所以R为300 ℃时的变化曲线;由图像又可知温度升高,B%变大,平衡左移,故正反应为放热反应,ΔH<0。
12.(2008全国高考理综Ⅱ)在相同温度和压强下,对反应CO2(g)+H2(g)CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
物质实验物质的量
上述四种情况达到平衡后,n(CO)的大小顺序是
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
答案:A 解析:
CO2(g)+H2(g)CO(g)+H2O(g)?
甲: a mol a mol 0 mol 0 mol?
乙: 2a mol a mol 0 mol 0 mol?
等效后的丙:a mol a mol 0 mol 0 mol?
等效后的丁:2a mol a mol 0 mol 0 mol
13.(2008上海高考改编)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是
组别
c(HCl)(mol/L)
温度(℃)
状态
1
2.0
25
块状
2
2.5
30
块状
3
2.5
50
块状
4
2.5
30
粉末状
①4—3—2—1 ②1—2—3—4 ③3—4—2—1 ④1—2—4—3
A.①或④ B.②或④ C.①或② D.①或③
答案:D 解析:化学反应速率与温度、浓度和固体物质的表面积的大小有关,实验1的盐酸的浓度最小,反应的温度最低,所以化学反应速率最慢;由于实验3的反应温度比实验2的反应温度高,所以反应速率实验3大于实验2;而实验4和实验3虽然浓度相同,但反应的温度不同,物质的状态也不相同,所以不能比较。
14.(2008宁夏高考)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)NH3(g)+HI(g);②2HI(g)H2(g)+I2(g)。达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
A.9 B.16 C.20 D.25
答案:C 解析:由平衡时氢气的浓度可求得反应②分解消耗HI的浓度,c(HI)=0.5 mol·L-1×2=1 mol·L-1,故①式生成c(HI)①=c(HI)平衡+c(HI)分解=4 mol·L-1+1 mol·L-1=5 mol·L-1,c(NH3)平衡=c(HI)①=5 mol·L-1,根据化学平衡常数公式K=c(NH3)平衡×c(HI)平衡=5 mol·L-1×4 mol·L-1,故答案选C。
15.25℃时,在25mL0.1mol·L-1的氢氧化钠溶液中,逐滴加入0.2mol·L-1CH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是
A.若B点的横坐标a=12.5,则有c(Na+)=c(CH3COO-)
B.C点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
C.D点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.对曲线上A、B间任何一点,溶液中都有:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
答案:C 解析:A不对,因二者刚好反应时,由于生成物水解,溶液呈碱性,故c(Na+)不等于c(CH3COO-);B不对,当c(H+)=c(OH-)时,根据电荷守恒c(Na+)=c(CH3COO-);根据物料守恒判断出C正确,;D不对,初始阶段 c(OH-) > c(CH3COO-)。
第Ⅱ卷(非选择题,共55分)
二、填空题(本题包括4个小题,共50分)
16.(10分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃)
10
20
30
加热煮沸后冷却到50℃
pH
8.3
8.4
8.5
8.8
甲同学认为,该溶液的pH升高的原因是的水解程度增大,故碱性增强,该反应的离子方程式为_____________。乙同学类比加热Ca(HCO3)2溶液,会出现___________现象,认为NaHCO3溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度___________(填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则说明___________(填“甲”或“乙”)判断正确。试剂X是___________。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH____________(填“高于”“低于”或“等于”)8.3,则说明另一判断正确。
(3)加热Ca(HCO3)2溶液发生的离子方程式为_______________________________________。
答案:+H2OH2CO3+OH-浑浊大于(1)乙B(2)等于
(3)Ca2++CaCO3↓+CO2↑+H2O
解析:(1)加热煮沸NaHCO3溶液后,无论其分解与否,加入A、C,都可产生沉淀。若证明其未分解,只能加入BaCl2溶液,因为它可与Na2CO3反应生成?CaCO3?,而不与NaHCO3溶液反应。(2)由(1)知另一判断即为甲的观点,若甲的观点正确,则加热后的溶液冷却到10 ℃后pH应不变。(3)Ca(HCO3)2溶液加热会分解为难溶的CaCO3。
17.(15分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。工业上生产硝酸铵的流程图如右图:
请回答下列问题:
(1)已知:N2(g)+3H2(g)2NH3(g),ΔH=-92.4kJ·mol-1?。
①图中气体X的成分是___________,理由是_________________________________。
②在上述条件下向一密闭容器中充入1molN2和?3molH2?,充分反应后,放出的热量是46.2kJ,则N2的转化率是___________。
③为提高合成氨反应的效率,实际生产中宜采取的措施有___________。
A.降低温度 B.最适合催化剂活性的适当高温
C.增大压强 D.降低压强
E.循环利用 F.原料气中氮气和氢气的配比为1∶2.8G.及时分离出氨
(2)已知氨的催化氧化反应发生后,不需要继续加热,铂铑合金网仍然会保持红热。试写出该反应的化学平衡常数表达式K=___________,当温度升高时,K值___________(填“增大”“减小”或“无影响”),其原因是_______________________________________________________。
(3)常温下某无色透明溶液中仅含有和等四种离子,请回答下列问题:
①该溶液所含的离子中除上述两种外还应有___________(填离子符号)两种离子。
②该溶液所含的上述四种离子的物质的量浓度大小有多种可能,以下选项中不可能的是______________。
A.c()>c()>c(H+)>c(OH-)
B.c()>c(H+)>c()>c(OH-)
C.c()>c(OH-)>c()>c(H+)
D.c()>c()>c(OH-)>c(H+)
E.c()>c(OH-)>c()>c(H+)
③如溶液中c()=c(),则溶液中的溶质为_______(填化学式),该溶液的pH____7(填“<”“>”或“=”)
(4)工业上还可利用侯氏制碱法制取小苏打,进而得到纯碱。
已知:Na2CO3·10H2O(s)====Na2CO3(s)+10H2O(g) ΔH1=+532.36kJ·mol-1?
Na2CO3·10H2O(s)====Na2CO3·H2O(s)+9H2O(g) ΔH1=+473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:__________________________。
答案:答案:(1)①N2、H2、NH3该反应为可逆反应,不可能进行完全②50%③BCEFG
(2) 减小 氨的催化氧化反应是放热反应?(3)①H+、OH-?②C?③NH4NO3、NH3·H2O=(4)Na2CO3·H2O(s)====Na2CO3(s)+H2O(g)ΔH=58.73 kJ·mol-1
解析:(1)①合成氨反应是可逆反应,不可能进行完全,所以气体X是混合气体。②热量与转化的氮气成正比,所以氮气的转化率为(46.2÷92.4)×100%=50%。③提高氨的合成效率,既要提高反应速率,又要提高氮气、氢气,尤其是氢气的转化率。A条件是降低了反应速率,不利于提高氨的产量,D条件不仅降低了反应速率,还不利于平衡的正向移动,降低了氢气的转化率。(2)氨的催化氧化反应发生后,铂铑合金网仍然会保持红热,说明该反应是放热反应,所以升温后,平衡逆向移动,平衡常数减小。(3)①水溶液中一定有H+、OH-。②由题意知溶质可能是NH4NO3或NH4NO3、NH3·H2O或NH4 NO3、HNO3,且若为混合物时,物质的相对量不同时,离子浓度大小顺序不同。③溶液显中性,电荷守恒式为c()+c(H+)=c(OH-)+ c(),若c()=c(),则c(H+)=c(OH-),溶液显中性。(4)通过观察两个热化学方程式,根据盖斯定律,将两式相减,即可得到热化学方程式。
18.(15分)某无色澄清溶液,可能含有Cu2+、Ba2+、、、I-、Cl-、H+、K+等离子中的两种或多种,做如下实验:
①取适量溶液加入少量Na2SO3后有气体产生,也有白色沉淀生成,再加盐酸沉淀不消失,过滤;
②在①的滤液中加入AgNO3溶液,又有白色沉淀生成,再加硝酸沉淀不消失。
回答下列问题:
(1)在第①步反应中生成无色易溶于水的气体是__________,生成的白色沉淀是__________;在第②步反应中生成的白色沉淀是____________。
(2)由以上实验,可判断原溶液中一定含有的离子是____________,一定不含有的离子是____________。
(3)设计一个简单实验,对可能含有的阴离子进一步确认:__________________________。
答案:(1)SO2 BaSO4 AgCl(2)H+、、Ba2+ Cu2+、、I-(3)取原液少许,加入AgNO3溶液,若有白色沉淀,再加硝酸沉淀不消失,则含Cl-,否则不含(未取原液不给分,因原溶液中已含H+,加不加硝酸均可)
解析:由无色澄清溶液知:不含有Cu2+(蓝色);由①知:溶液中含有H+、、Ba2+,则不含有(与Ba2+生成沉淀)、I-(易被H+、氧化);若由②推得“一定含有Cl-”则错,因为①操作中已加入盐酸。
19.(10分)将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
金属
电子流动方向
电压(V)
A
A→Cu
+0.78
B
Cu→B
-0.15
C
C→Cu
+1.35
D
D→Cu
+0.30
已知:构成两电极的金属的金属活泼性相差越大,电压表的读数越大。请依据表中数据判断:
(1)_________金属可能是最强的还原剂;_________金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上看到析出蓝色沉淀的是_________(填字母)金属。其对应的原电池的电极反应式为:负极_________,正极_________。
答案:(1)CB(2)B2Cu-4e-2Cu2+ ;2H2O+O2+4e-4OH-
解析:(1)因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子的流动方向,各金属的活泼性顺序为C>A>D>Cu>B。
(2)若用NaOH溶液作电解质,在滤纸上能看到有蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。
三、计算题(本题5分)
20.(5分)已知下列两个热化学方程式:
①2H2(气)+O2(气)====2H2O(液) ΔH=-571.6kJ
②C2H8(气)+5O2(气)====3CO2(气)+4H2O(液) ΔH=-2220kJ
实验测得H2与C3H8的混合气体共5mol完全燃烧时放热3847kJ,则混合气体中H2与C3H8的体积比是多少?
答案:3∶1
解析:设混合气体中H2的物质的量为x,则C3H8为(5-x)
根据反应①可知H2的燃烧热为:
根据反应②可知C3H8的燃烧热为:2 220 kJ·mol-1
则:285.8x+2 220(5-x)=3 847
x=3.75(mol)
n(H2)∶n(C3H8)=V(H2)∶V(C3H8)=3.75∶1.25=3∶1
