鲁教版初中化学九年级上册第5单元《定量研究化学反应》单元测试题(解析版)
文档属性
| 名称 | 鲁教版初中化学九年级上册第5单元《定量研究化学反应》单元测试题(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 179.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-01-07 16:40:14 | ||
图片预览



文档简介
第5单元《定量研究化学反应》单元测试题
一、单选题(每小题只有一个正确答案)
1.目前我国自主研发的抗癌新药西达苯胺即将上市。西达苯胺的化学式是C22H19FN4O2,下列关于西达苯胺的说法不正确的是( )
A.西达苯胺由碳、氢、氟、氮、氧五种元素组成
B.一个西达苯胺分子由48个原子构成
C.西达苯胺中碳、氮、氧三种元素的质量比是11:2:1
D.西达苯胺属于化合物
2.下列各项中,名称与化学式相符的是( )
A.氮气N B.氧化铜CuO2 C.碳酸钠NaCO3 D.五氧化二磷P2O5
3.下列着火情况下,相应灭火措施及其理由均正确的是( )
选项 着火情况 灭火措施 理由
A 不慎将酒精灯内酒精洒在实验桌上燃烧起来 用湿抹布扑盖 隔绝空气,降低可燃物着火点
B 在寝室吸烟引起被褥燃烧 迅速打开门窗并泼水 通风透气,降低可燃物温度
C 歌厅因电线老化短路起火 首先使用泡沫灭火器灭火, 然后断开电源 降低可燃物温度并隔绝空气
D 林区发生火灾 砍倒附近树本开辟隔离带 移走可燃物
4.某反应的微观示意图如下,下列说法正确的是(??)
A.该反应说明原子在化学反应中可再分 B.反应物的分子个数比为3:2
C.所有参与反应的物质都是化合物 D.D物质中氯元素的化合价是+1
5.根据质量守恒定律,下列说法正确的是( )
A.燃烧的镁带和生成的白色粉末质量相等
B.蜡烛燃烧,固体质量减少,不符合质量守恒定律
C.水分解的质量等于生成的氢气和氧气的质量总和
D.a g碳在b g氧气中充分燃烧,一定能生成(a+b)g二氧化碳
6.如图表示在一定条件下发生的某化学反应,则下列说法正确的是 ( )
A.该反应属于化合反应 B.该反应不符合质量守恒定律
C.该反应前后元素的种类发生了改变 D.两种反应物均为化合物
7.如图所示微观变化的化学反应类型,与下列反应的反应类型一致的是(?? )
A.2KClO32KCl+3O2 B.2HI+Cl2═2HCl+I2
C.CO2+C 2CO D.2HCl+CuO═CuCl2+H2O
8.中国科学家屠呦呦在2015年获得诺贝尔医学生理学奖。她成功提取出的青蒿素(化学式C15H22O5),被誉为“拯救2亿人口”的发现。下列有关青蒿素说法不正确的是( )
A.青蒿素由42个原子构成
B.青蒿素中氢元素质量分数最小
C.青蒿素由碳、氢、氧三种元素组成
D.青蒿素中碳、氢、氧元素的原子个数比为15∶22∶5
9.下列化学方程式书写正确的是( )
A.2Fe + 6HCl = 2FeCl3+ 3H2↑ B.H2O2 H2↑+ O2↑
C.2Mg + O22MgO D.4Fe + 3O22Fe2O3
10.下图是四位同学正在讨论某化学方程式表示的意义,他们所描述的化学方程式是( )
A.2H2 + O2?2H2O B.2H2O O2↑ + 2H2↑
C.2CO + O2?2CO2 D.CH4 + 2O2 CO2 + 2H2O
11.25℃时,某气态碳氢化合物与氧气混合后装入密闭容器中,经充分反应后,又恢复25℃,此时容器内气体分子是反应前的一半。再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。此碳氢化合物可能是( )
A.CH4 B.C2H6 C.C2H2 D.C3H8
12.将一定量甲烷和氧气置于密闭容器中引燃,测得反应前后各物质的质量如下表:
下列判断正确的是( )
A.X可能是反应物 B.X可能是该反应的催化剂
C.X中含有氢元素 D.氧气增加能减少X的生成
二、填空题
13.写出反应的化学方程式并判断反应类型:实验室用锌和稀反应生成硫酸锌和氢气,________、___________。
14.如图是某化学反应前后的微观示意图,根据图示回答问题。
(1)该反应生成物中____单质(填“有”或“无”);
(2)该反应属于____(填反应类型);
(3)参加反应的甲、乙两种分子的个数比是____;
(4)发生化学反应前后____元素化合价发生变化(填“有”或“无”)。
15.分析物质之间的相互转化关系,是学好元素化合物的一种方法。根据下列你所熟知的物质之间的关系(部分反应物、生成物及反应条件未列出),回答有关问题。
(1)若A为碳酸钙,D的溶解度随温度的升高而减小,根据上述物质相互转化关系,则:B的分子式为 ;C与D反应的化学方程式为 。
(2)若A为液态氧化物,D为黑色固体,根据上述物质相互转化关系,则:氧化物A分子中另一种元素(不是氧元素)的质量分数是 ;其中属于置换反应的化学方程式为 。
16.化学用语是学习化学的重要工具。
(1)请用合适的化学用语填空:
①2个氯原子________________;②硝酸中的阴离子_____________;
③2个甲烷分子_________________;④氧化铝中铝元素的化合价_______________。
(2)写出下列反应的符号表达式:
①红磷在空气中燃烧生成五氧化二磷_______________________;
②电解水___________________________。
17.水是人及一切生物生存所必需的,我们应该了解有关水的一些知识。
(1)硬水给生活和生产带来很多麻烦,含有________(填一种微粒符号)较多的水称为硬水。
(2)下列物质分别加入蒸馏水中,不断搅拌后,能形成无色溶液的是__________(填序号)。
A.硫酸铜??B.?粉笔灰???C.?蔗糖??D.?食用油
(3)下图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢气、氯气和一种强碱,该反应的化学方程式为________。
(4)在细菌作用下,可以用氨气处理含有甲醇(CH3OH)的工业废水,有关反应的化学方程式为5CH3OH+12O2+6NH3 ?3X+5CO2+19H2O,则X的化学式为________。
三、实验题
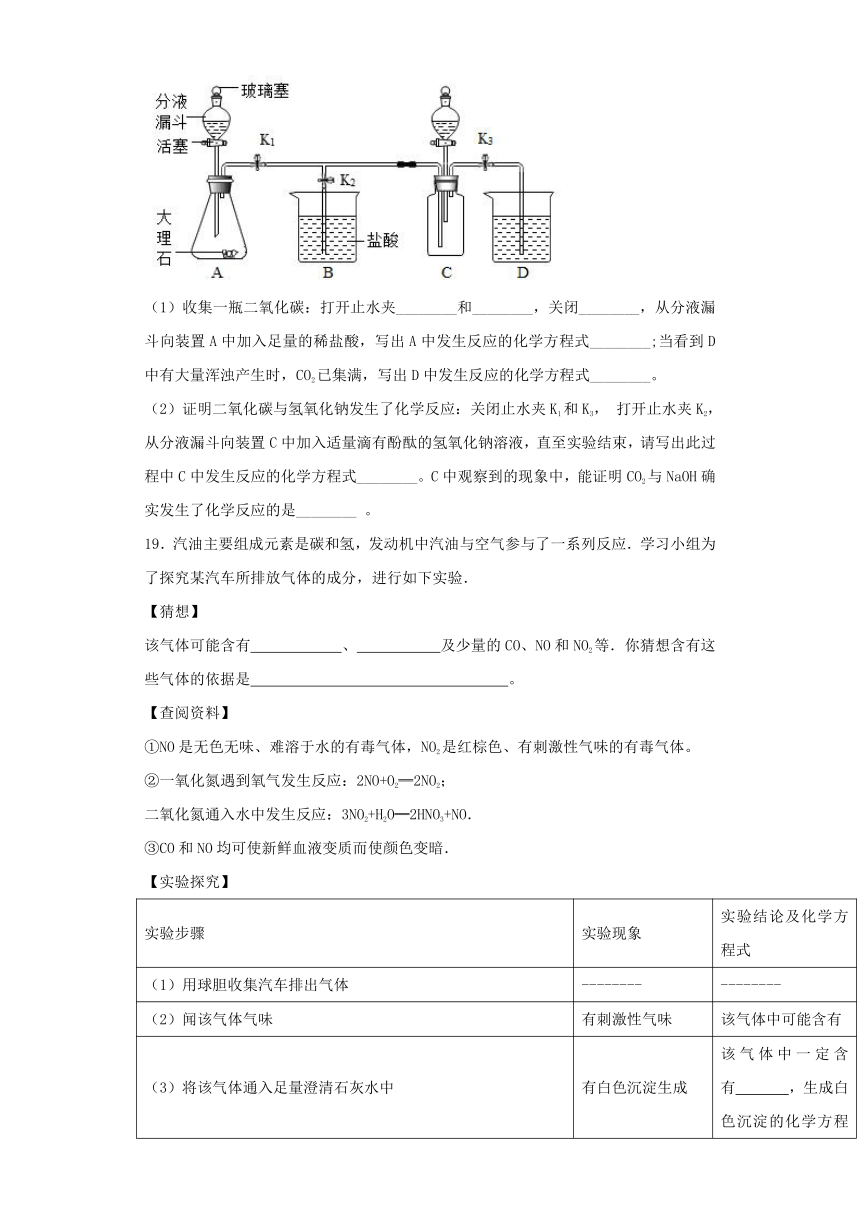
18.化学兴趣小组用下图所示装置进行以下实验。
(1)收集一瓶二氧化碳:打开止水夹________和________,关闭________,从分液漏斗向装置A中加入足量的稀盐酸,写出A中发生反应的化学方程式________;当看到D中有大量浑浊产生时,CO2已集满,写出D中发生反应的化学方程式________。
(2)证明二氧化碳与氢氧化钠发生了化学反应:关闭止水夹K1和K3, 打开止水夹K2, 从分液漏斗向装置C中加入适量滴有酚酞的氢氧化钠溶液,直至实验结束,请写出此过程中C中发生反应的化学方程式________。C中观察到的现象中,能证明CO2与NaOH确实发生了化学反应的是________ 。
19.汽油主要组成元素是碳和氢,发动机中汽油与空气参与了一系列反应.学习小组为了探究某汽车所排放气体的成分,进行如下实验.
【猜想】
该气体可能含有 、 及少量的CO、NO和NO2等.你猜想含有这些气体的依据是 。
【查阅资料】
①NO是无色无味、难溶于水的有毒气体,NO2是红棕色、有刺激性气味的有毒气体。
②一氧化氮遇到氧气发生反应:2NO+O2═2NO2;
二氧化氮通入水中发生反应:3NO2+H2O═2HNO3+NO.
③CO和NO均可使新鲜血液变质而使颜色变暗.
【实验探究】
实验步骤 实验现象 实验结论及化学方程式
(1)用球胆收集汽车排出气体 -------- --------
(2)闻该气体气味 有刺激性气味 该气体中可能含有
(3)将该气体通入足量澄清石灰水中 有白色沉淀生成 该气体中一定含有 ,生成白色沉淀的化学方程式是 。
(4) C中新鲜血液颜色变暗;D中有红棕色气体产生。 该气体中,除了(3)所确定的成分外,下列有关其余成分的说法一定不正确的是 ①只含NO ②只含NO2 ③只含CO ④含NO和NO2 ⑤含CO和NO2 ⑥含CO和NO ⑦含CO、NO和NO2
(5)将(4)中C导出的气体通入 观察到 . 该气体中一定含有CO
【计算】将汽车排放的废气经过处理只含二氧化碳和一氧化碳,若用10g这种气体通过足量的氧化铁,高温一段时间后收集到12.4g气体,则10g气体中二氧化碳的质量为 。
四、推断题
20.有A、B、C、D四种物质,A是空气中含量最多的气体,B是一种黄色固体,在纯净的D中剧烈燃烧发出明亮的蓝紫色火焰,生成有刺激气味的气体C.根据以上描述试推断:
(1)A为______、C为______.(写化学式)
(2)写出B在D中燃烧的文字表达式:______.
五、计算题
21.实验室用碳酸钙与盐酸反应制取二氧化碳,如果制取8.8g 二氧化碳,至少需要__________克碳酸钙?
22.某学生称取31.6g高锰酸钾制氧气,可制取氧气多少?2KMnO4K2MnO4+MnO2+O2↑
试卷第4页,总6页
参考答案
1.C
【解析】
【详解】
A、由西达苯胺的化学式可知,西达苯胺由碳、氢、氟、氮、氧五种元素组成,选项正确;B、由西达苯胺的化学式可知,一个西达苯胺分子由48个原子构成,选项正确;C、西达苯胺中碳、氮、氧三种元素的质量比是33:7:4,不是11:2:1,选项错误;D、西达苯胺是一种有机物,属于化合物,选项正确,故选C。
2.D
【解析】
【详解】
A、氮气是由分子直接构成的,其化学式直接用元素符号N2来表示,故错误;B、氧化铜中铜元素的化合价为+2价,氧元素显-2价,其化学式为:CuO,故错误;C、碳酸钠中钠元素显+1价,碳酸根显-2价,其化学式为Na2CO3,故错误;D、五氧化二磷中,磷元素显+5价,氧元素显-2价,其化学式为P2O5,故正确。故选D。
3.D
【解析】
试题分析:A、酒精灯内酒精洒在实验桌上燃烧起来,用湿抹布扑盖,隔绝空气,使温度降到着火点以下;可燃物的着火点一般是不变的,不能降低可燃物的着火点,故选项说法错误.
B、在寝室吸烟引起被褥燃烧,不能立即打开门窗,否则空气流通,火势更旺,故选项说法错误.
C、歌厅因电线老化短路起火,为防止触电,首先应切断电源,再使用泡沫灭火器灭火,故选项说法错误.
D、林区发生火灾,砍倒附近树本开辟隔离带,是利用了移除可燃物的原理,故选项说法正确.
故选D.
考点:灭火的原理和方法.
点评:本题难度不大,掌握灭火原理(清除或隔离可燃物,隔绝氧气或空气,使温度降到可燃物的着火点以下)并能灵活运用是正确解答本题的关键.
4.A
【解析】
【详解】
A、在化学反应中,分子可分,原子不再分,选项错误;B、由图可知,反应物A、B的分子个数比为1:1,不是3:2,选项错误;C、反应物B是一种单质,不是化合物,选项错误;D、由图可知。生成物D为次氯酸,其中氯元素的化合价为+1价,选项正确,故选D。
5.C
【解析】A、燃烧的镁带和氧气的质量之和等于生成的白色粉末质量,错误;B、蜡烛燃烧,固体质量减少,是因为生成的气体逸散到空气中,符合质量守恒定律,错误;C、由质量守恒定律,水分解的质量等于生成的氢气和氧气的质量总和,正确;D、a g碳在b g氧气中充分燃烧,碳或氧气可能有剩余,不一定能生成(a+b)g二氧化碳,错误。故选C。
6.A
【解析】
试题分析:从图示看:该反应的反应物中有两种物质,而生成物只有一种属于化合反应;该反应符合质量守恒定律;该反应前后元素的种类没有发生了改变;两种反应物只有一种是化合物,而另一种物质中只有一种元素,属于单质。故选A.
考点:化学变化的实质
7.B
【解析】
由图可知,1个和2个分子反应可以生成1个和2个,故B符合,故选B。
8.A
【解析】A、青蒿素是由分子构成的而不是由原子直接构成的,错误;B、青蒿素中C、H、O三种元素的质量比为(12×15):(1×22):(16×5)=90:11:40,可见其中氢元素的质量分数最小,正确;C、由青蒿素的化学式可知,它是由碳、氢、氧三种元素组成的,正确;D、由青蒿素的化学式可知,青蒿素中碳、氢、氧元素的原子个数比为15∶22∶5,正确。故选A。
点睛:
结合新信息、灵活运用化学式的含义。
9.C
【解析】
【详解】
A、铁在置换反应中生成FeCl2,而不是FeCl3,选项错误;B、过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O22H2O+O2↑,原化学方程式没有配平,选项错误;C、该化学方程式书写完全正确;D、铁在氧气中燃烧生成四氧化三铁,正确的化学方程式为3Fe+2O2Fe3O4,选项错误。故选C。
【点睛】
化学方程式正误判断方法是:先看化学式是否正确,再看配平,再看反应条件,再看气体和沉淀,最后短线改成等号。
10.A
【解析】反应在点燃条件下进行,排除B;是化合反应,排除D;A、氢气、氧气、水三种物质的质量比为:2×2:32:2×18=1:8:9,正确;C、一氧化碳、氧气、二氧化碳三种物质的质量比为:2×28:32:2×44=7:4:11,错误。故选A。
点睛:化学方程式的意义。
11.D
【解析】容器内气体分子是反应前的一半。再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。由定组成定律和化学方程式知,此碳氢化合物可能是D. C3H8。
点睛∶本题主要考查化学方程式的应用。
12.D
【解析】A、密闭容器中,反应前的质量等于反应后的质量,4.8+16=10.8+4.4+a得a=5.6,X的质量增加,则X为生成物,错误;
B、X在反应前后质量改变了,不可能是催化剂,错误;
C、甲烷中氢元素的质量为: =1.2g,生成物水中氢元素的质量为: =1.2g ,故X中不含有氢元素,错误;
D、由题可知,该反应中氧气不足使使反应由了X 的生成,故增加氧气的质量可以减少X的生成,正确。故选D 。
13.置换反应
【解析】
【详解】
实验室用锌和稀H2SO4反应生成硫酸锌(ZnSO4)和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;该反应由一种单质与一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,属于置换反应。
14. 无 化合反应 1:3 有
【解析】(1)由两种或两种以上物质组成的物质叫混合物;由一种物质组成的物质叫纯净物;由一种元素组成的纯净物叫单质;由不同元素组成的纯净物叫化合物;由图中信息可知,反应后的单质是剩余的反应物,不是生成的,所以生成物质无单质;(2) 由两种或两种以上物质生成一种物质的反应叫化合反应;由一种物质生成两种或两种以上物质的反应叫分解反应;该反应属于化合反应;(3)据质量守恒定律可知反应前后原子的种类个数不变,参加反应的甲、乙两种分子的个数比是1:3;(4)单质中元素的化合价为零,化合物中元素的化合价代数和为零。发生化学反应前后乙元素化合价发生变化。
15.(1)CaO;CO2+Ca(OH)2=CaCO3↓+H2O
(2)11.1%;Fe3O4+4H23Fe+4H2O或CuO+H2Cu+H2O
【解析】
试题分析:若A为碳酸钙,D的溶解度随温度的升高而减小,D为氢氧化钙,B为氧化钙;二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,方程式为CO2 + Ca(OH)2 =CaCO3 ↓ + H2O;A为液态氧化物,D为黑色固体,则A为水,B为氧气,C为氢气,D为四氧化三铁,氢气和四氧化三铁在加热条件下反应生成水和铁,,水中氢的质量分数为2÷18×100%≈11.1%;一种单质和一种化合物生成另一种单质和另一种化合物的反应叫置换反应;Fe3O4 + 4H2 3Fe + 4H2O 或 CuO + H2 Cu + H2O都是置换反应。
考点:
16. 2Cl NO3 2CH4 2O3 4P+5O2?2P2O5 2H2O2H2↑+O2↑
【解析】本题主要考查学生对化学用语的书写和理解能力,书写时注意书写规范。
(1)①原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个氯原子,就可表示为:2Cl;
②离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故硝酸中的阴离子可表示为:NO3﹣;
③表示多个分子,在其化学式前加上相应的数字,所以2个甲烷分子可表示为:2CH4;
④元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氧化铝中铝元素的化合价,故可表示为:2O3;
(2)①红磷在空气中燃烧时生成五氧化二磷,反应的化学方程式是4P+5O2 2P2O5;
②水通电分解生成氢气和氧气,反应的化学方程式为:2H2O2H2↑+O2↑。
17.Ca2+或Mg2+C2NaCl+2H2O 2NaOH+H2↑+Cl2↑N2
【解析】
(1). 硬水是含可溶钙镁化合物(Ca2+或Mg2+)较多的水 (2). 溶液是均一稳定的混合物,在溶液中物质以分子或离子等微观粒子的的形式相互混合,因没有阻挡光线的微粒,所以溶液都是澄清透明的。蔗糖能和水形成均一稳定的的混合物,是溶液。 (3). 据质量守恒定律可推知生成的强碱是氢氧化钠,所以电解食盐水的方程式为:2NaCl+2H2O通电2NaOH+H2↑+Cl2↑ (4). 据质量守恒定律可知,化学反应前后原子的种类、个数不变,反应前有29个氧原子、5个碳原子、38个氢原子、6个氮原子,反应后有29个氧原子、5个碳原子、38个氢原子,所以一个X的分子中有2个氮原子;X的化学式为N2
18.K1 K3K2CaCO3 + 2HCl = CaCl2 + H2O + CO2↑CO2+ Ca(OH)2= CaCO3↓+H2ONa2CO3 + 2HCl = 2NaCl + H2O + CO2↑?C中有气泡产生
【解析】
【详解】
(1)打开止水夹K1和K3、关闭K2,从分液漏斗向装置A中加入足量的稀盐酸,稀盐酸与A中大理石反应生成二氧化碳,此时装置A中发生反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;当看到D中有大量浑浊产生时,CO2已集满,D中发生反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)关闭K1和K3,打开止水夹K2,从分液漏斗向装置C中加入适量滴有酚酞的氢氧化钠溶液,集气瓶中的二氧化碳与氢氧化钠反应,装置C中反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O;锥形瓶中的二氧化碳与氢氧化钠反应,压强变小,B装置中的压强大,就会将烧杯内的盐酸流入C中,然后盐酸与反应生成的碳酸钠反应,生成二氧化碳,因此有气泡生成。
19.【猜想】 CO2 、 水蒸气; 质量守恒定律,反应前后元素的种类不变
【实验探究】(2)NO2 (3) CO2 ; Ca(OH)2+CO2===H2O+CaCO3↓(4)①②③ (5)灼热的氧化铜 (或氧化铁) 黑色固体变为红色 (或红色固体变为黑色) (6)5.8g
【解析】
试题分析:该气体可能含有CO2 、 水蒸气;及少量的CO、NO和NO2等.你猜想含有这些气体的依据是质量守恒定律,反应前后元素的种类不变;将该气体通入足量澄清石灰水中,变浑浊说明该气体是二氧化碳,发生的反应为Ca(OH)2+CO2===H2O+CaCO3↓;C中新鲜血液颜色变暗;D中有红棕色气体产生,说明该气体含有一氧化碳和二氧化氮气体,所以①②③不正确;将(4)中C导出的气体通入灼热的氧化铜 (或氧化铁) 黑色固体变为红色 (或红色固体变为黑色),说明该气体中不含有一氧化碳。分析发现,每一个分子的一氧化碳变为一分子的二氧化碳后增加了一个氧原子,所以增加的氧元素的质量和一氧化碳中的氧元素的质量恰好相等,所以设原气体中一氧化碳的质量为X,则:X×16/28=12.4克-10.0克 求得X=4.2克;则则10g气体中二氧化碳的质量为=10.克-4.2克=5.8克。
考点:质量守恒定律 元素的质量的计算
20.N2 SO2 硫+氧气二氧化硫
【解析】
【详解】
(1)A是空气中含量最多的气体,故A为氮气,化学式为N2,B是一种黄色固体,在纯净的D中剧烈燃烧发出明亮的蓝紫色火焰,生成有刺激气味的气体C,通过该现象可知,此为硫粉在氧气中燃烧的现象,故B为硫粉,化学式为S,C为二氧化硫,化学式为SO2,D为氧气,化学式为O2;
(2)由(1)可知,硫在氧气中燃烧生成二氧化硫,故文字表达式为硫+氧气二氧化硫。
21.20g
【解析】
【分析】
由二氧化碳的质量根据碳酸钙与盐酸反应的化学方程式可以计算出需要的碳酸钙的质量。
【详解】
解:设需要碳酸钙的质量为x,
x=20g;
答:至少需要20g碳酸钙。
22.3.2g
【解析】设加热31.6g高锰酸钾可制取氧气的质量为x
2KMnO4 K2MnO4+MnO2+O2↑
316 32
31.6g x
31631.6g=32/x x=3.2g
答:加热31.6g高锰酸钾可制取氧气的质量为3.2g。
一、单选题(每小题只有一个正确答案)
1.目前我国自主研发的抗癌新药西达苯胺即将上市。西达苯胺的化学式是C22H19FN4O2,下列关于西达苯胺的说法不正确的是( )
A.西达苯胺由碳、氢、氟、氮、氧五种元素组成
B.一个西达苯胺分子由48个原子构成
C.西达苯胺中碳、氮、氧三种元素的质量比是11:2:1
D.西达苯胺属于化合物
2.下列各项中,名称与化学式相符的是( )
A.氮气N B.氧化铜CuO2 C.碳酸钠NaCO3 D.五氧化二磷P2O5
3.下列着火情况下,相应灭火措施及其理由均正确的是( )
选项 着火情况 灭火措施 理由
A 不慎将酒精灯内酒精洒在实验桌上燃烧起来 用湿抹布扑盖 隔绝空气,降低可燃物着火点
B 在寝室吸烟引起被褥燃烧 迅速打开门窗并泼水 通风透气,降低可燃物温度
C 歌厅因电线老化短路起火 首先使用泡沫灭火器灭火, 然后断开电源 降低可燃物温度并隔绝空气
D 林区发生火灾 砍倒附近树本开辟隔离带 移走可燃物
4.某反应的微观示意图如下,下列说法正确的是(??)
A.该反应说明原子在化学反应中可再分 B.反应物的分子个数比为3:2
C.所有参与反应的物质都是化合物 D.D物质中氯元素的化合价是+1
5.根据质量守恒定律,下列说法正确的是( )
A.燃烧的镁带和生成的白色粉末质量相等
B.蜡烛燃烧,固体质量减少,不符合质量守恒定律
C.水分解的质量等于生成的氢气和氧气的质量总和
D.a g碳在b g氧气中充分燃烧,一定能生成(a+b)g二氧化碳
6.如图表示在一定条件下发生的某化学反应,则下列说法正确的是 ( )
A.该反应属于化合反应 B.该反应不符合质量守恒定律
C.该反应前后元素的种类发生了改变 D.两种反应物均为化合物
7.如图所示微观变化的化学反应类型,与下列反应的反应类型一致的是(?? )
A.2KClO32KCl+3O2 B.2HI+Cl2═2HCl+I2
C.CO2+C 2CO D.2HCl+CuO═CuCl2+H2O
8.中国科学家屠呦呦在2015年获得诺贝尔医学生理学奖。她成功提取出的青蒿素(化学式C15H22O5),被誉为“拯救2亿人口”的发现。下列有关青蒿素说法不正确的是( )
A.青蒿素由42个原子构成
B.青蒿素中氢元素质量分数最小
C.青蒿素由碳、氢、氧三种元素组成
D.青蒿素中碳、氢、氧元素的原子个数比为15∶22∶5
9.下列化学方程式书写正确的是( )
A.2Fe + 6HCl = 2FeCl3+ 3H2↑ B.H2O2 H2↑+ O2↑
C.2Mg + O22MgO D.4Fe + 3O22Fe2O3
10.下图是四位同学正在讨论某化学方程式表示的意义,他们所描述的化学方程式是( )
A.2H2 + O2?2H2O B.2H2O O2↑ + 2H2↑
C.2CO + O2?2CO2 D.CH4 + 2O2 CO2 + 2H2O
11.25℃时,某气态碳氢化合物与氧气混合后装入密闭容器中,经充分反应后,又恢复25℃,此时容器内气体分子是反应前的一半。再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。此碳氢化合物可能是( )
A.CH4 B.C2H6 C.C2H2 D.C3H8
12.将一定量甲烷和氧气置于密闭容器中引燃,测得反应前后各物质的质量如下表:
下列判断正确的是( )
A.X可能是反应物 B.X可能是该反应的催化剂
C.X中含有氢元素 D.氧气增加能减少X的生成
二、填空题
13.写出反应的化学方程式并判断反应类型:实验室用锌和稀反应生成硫酸锌和氢气,________、___________。
14.如图是某化学反应前后的微观示意图,根据图示回答问题。
(1)该反应生成物中____单质(填“有”或“无”);
(2)该反应属于____(填反应类型);
(3)参加反应的甲、乙两种分子的个数比是____;
(4)发生化学反应前后____元素化合价发生变化(填“有”或“无”)。
15.分析物质之间的相互转化关系,是学好元素化合物的一种方法。根据下列你所熟知的物质之间的关系(部分反应物、生成物及反应条件未列出),回答有关问题。
(1)若A为碳酸钙,D的溶解度随温度的升高而减小,根据上述物质相互转化关系,则:B的分子式为 ;C与D反应的化学方程式为 。
(2)若A为液态氧化物,D为黑色固体,根据上述物质相互转化关系,则:氧化物A分子中另一种元素(不是氧元素)的质量分数是 ;其中属于置换反应的化学方程式为 。
16.化学用语是学习化学的重要工具。
(1)请用合适的化学用语填空:
①2个氯原子________________;②硝酸中的阴离子_____________;
③2个甲烷分子_________________;④氧化铝中铝元素的化合价_______________。
(2)写出下列反应的符号表达式:
①红磷在空气中燃烧生成五氧化二磷_______________________;
②电解水___________________________。
17.水是人及一切生物生存所必需的,我们应该了解有关水的一些知识。
(1)硬水给生活和生产带来很多麻烦,含有________(填一种微粒符号)较多的水称为硬水。
(2)下列物质分别加入蒸馏水中,不断搅拌后,能形成无色溶液的是__________(填序号)。
A.硫酸铜??B.?粉笔灰???C.?蔗糖??D.?食用油
(3)下图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢气、氯气和一种强碱,该反应的化学方程式为________。
(4)在细菌作用下,可以用氨气处理含有甲醇(CH3OH)的工业废水,有关反应的化学方程式为5CH3OH+12O2+6NH3 ?3X+5CO2+19H2O,则X的化学式为________。
三、实验题
18.化学兴趣小组用下图所示装置进行以下实验。
(1)收集一瓶二氧化碳:打开止水夹________和________,关闭________,从分液漏斗向装置A中加入足量的稀盐酸,写出A中发生反应的化学方程式________;当看到D中有大量浑浊产生时,CO2已集满,写出D中发生反应的化学方程式________。
(2)证明二氧化碳与氢氧化钠发生了化学反应:关闭止水夹K1和K3, 打开止水夹K2, 从分液漏斗向装置C中加入适量滴有酚酞的氢氧化钠溶液,直至实验结束,请写出此过程中C中发生反应的化学方程式________。C中观察到的现象中,能证明CO2与NaOH确实发生了化学反应的是________ 。
19.汽油主要组成元素是碳和氢,发动机中汽油与空气参与了一系列反应.学习小组为了探究某汽车所排放气体的成分,进行如下实验.
【猜想】
该气体可能含有 、 及少量的CO、NO和NO2等.你猜想含有这些气体的依据是 。
【查阅资料】
①NO是无色无味、难溶于水的有毒气体,NO2是红棕色、有刺激性气味的有毒气体。
②一氧化氮遇到氧气发生反应:2NO+O2═2NO2;
二氧化氮通入水中发生反应:3NO2+H2O═2HNO3+NO.
③CO和NO均可使新鲜血液变质而使颜色变暗.
【实验探究】
实验步骤 实验现象 实验结论及化学方程式
(1)用球胆收集汽车排出气体 -------- --------
(2)闻该气体气味 有刺激性气味 该气体中可能含有
(3)将该气体通入足量澄清石灰水中 有白色沉淀生成 该气体中一定含有 ,生成白色沉淀的化学方程式是 。
(4) C中新鲜血液颜色变暗;D中有红棕色气体产生。 该气体中,除了(3)所确定的成分外,下列有关其余成分的说法一定不正确的是 ①只含NO ②只含NO2 ③只含CO ④含NO和NO2 ⑤含CO和NO2 ⑥含CO和NO ⑦含CO、NO和NO2
(5)将(4)中C导出的气体通入 观察到 . 该气体中一定含有CO
【计算】将汽车排放的废气经过处理只含二氧化碳和一氧化碳,若用10g这种气体通过足量的氧化铁,高温一段时间后收集到12.4g气体,则10g气体中二氧化碳的质量为 。
四、推断题
20.有A、B、C、D四种物质,A是空气中含量最多的气体,B是一种黄色固体,在纯净的D中剧烈燃烧发出明亮的蓝紫色火焰,生成有刺激气味的气体C.根据以上描述试推断:
(1)A为______、C为______.(写化学式)
(2)写出B在D中燃烧的文字表达式:______.
五、计算题
21.实验室用碳酸钙与盐酸反应制取二氧化碳,如果制取8.8g 二氧化碳,至少需要__________克碳酸钙?
22.某学生称取31.6g高锰酸钾制氧气,可制取氧气多少?2KMnO4K2MnO4+MnO2+O2↑
试卷第4页,总6页
参考答案
1.C
【解析】
【详解】
A、由西达苯胺的化学式可知,西达苯胺由碳、氢、氟、氮、氧五种元素组成,选项正确;B、由西达苯胺的化学式可知,一个西达苯胺分子由48个原子构成,选项正确;C、西达苯胺中碳、氮、氧三种元素的质量比是33:7:4,不是11:2:1,选项错误;D、西达苯胺是一种有机物,属于化合物,选项正确,故选C。
2.D
【解析】
【详解】
A、氮气是由分子直接构成的,其化学式直接用元素符号N2来表示,故错误;B、氧化铜中铜元素的化合价为+2价,氧元素显-2价,其化学式为:CuO,故错误;C、碳酸钠中钠元素显+1价,碳酸根显-2价,其化学式为Na2CO3,故错误;D、五氧化二磷中,磷元素显+5价,氧元素显-2价,其化学式为P2O5,故正确。故选D。
3.D
【解析】
试题分析:A、酒精灯内酒精洒在实验桌上燃烧起来,用湿抹布扑盖,隔绝空气,使温度降到着火点以下;可燃物的着火点一般是不变的,不能降低可燃物的着火点,故选项说法错误.
B、在寝室吸烟引起被褥燃烧,不能立即打开门窗,否则空气流通,火势更旺,故选项说法错误.
C、歌厅因电线老化短路起火,为防止触电,首先应切断电源,再使用泡沫灭火器灭火,故选项说法错误.
D、林区发生火灾,砍倒附近树本开辟隔离带,是利用了移除可燃物的原理,故选项说法正确.
故选D.
考点:灭火的原理和方法.
点评:本题难度不大,掌握灭火原理(清除或隔离可燃物,隔绝氧气或空气,使温度降到可燃物的着火点以下)并能灵活运用是正确解答本题的关键.
4.A
【解析】
【详解】
A、在化学反应中,分子可分,原子不再分,选项错误;B、由图可知,反应物A、B的分子个数比为1:1,不是3:2,选项错误;C、反应物B是一种单质,不是化合物,选项错误;D、由图可知。生成物D为次氯酸,其中氯元素的化合价为+1价,选项正确,故选D。
5.C
【解析】A、燃烧的镁带和氧气的质量之和等于生成的白色粉末质量,错误;B、蜡烛燃烧,固体质量减少,是因为生成的气体逸散到空气中,符合质量守恒定律,错误;C、由质量守恒定律,水分解的质量等于生成的氢气和氧气的质量总和,正确;D、a g碳在b g氧气中充分燃烧,碳或氧气可能有剩余,不一定能生成(a+b)g二氧化碳,错误。故选C。
6.A
【解析】
试题分析:从图示看:该反应的反应物中有两种物质,而生成物只有一种属于化合反应;该反应符合质量守恒定律;该反应前后元素的种类没有发生了改变;两种反应物只有一种是化合物,而另一种物质中只有一种元素,属于单质。故选A.
考点:化学变化的实质
7.B
【解析】
由图可知,1个和2个分子反应可以生成1个和2个,故B符合,故选B。
8.A
【解析】A、青蒿素是由分子构成的而不是由原子直接构成的,错误;B、青蒿素中C、H、O三种元素的质量比为(12×15):(1×22):(16×5)=90:11:40,可见其中氢元素的质量分数最小,正确;C、由青蒿素的化学式可知,它是由碳、氢、氧三种元素组成的,正确;D、由青蒿素的化学式可知,青蒿素中碳、氢、氧元素的原子个数比为15∶22∶5,正确。故选A。
点睛:
结合新信息、灵活运用化学式的含义。
9.C
【解析】
【详解】
A、铁在置换反应中生成FeCl2,而不是FeCl3,选项错误;B、过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O22H2O+O2↑,原化学方程式没有配平,选项错误;C、该化学方程式书写完全正确;D、铁在氧气中燃烧生成四氧化三铁,正确的化学方程式为3Fe+2O2Fe3O4,选项错误。故选C。
【点睛】
化学方程式正误判断方法是:先看化学式是否正确,再看配平,再看反应条件,再看气体和沉淀,最后短线改成等号。
10.A
【解析】反应在点燃条件下进行,排除B;是化合反应,排除D;A、氢气、氧气、水三种物质的质量比为:2×2:32:2×18=1:8:9,正确;C、一氧化碳、氧气、二氧化碳三种物质的质量比为:2×28:32:2×44=7:4:11,错误。故选A。
点睛:化学方程式的意义。
11.D
【解析】容器内气体分子是反应前的一半。再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。由定组成定律和化学方程式知,此碳氢化合物可能是D. C3H8。
点睛∶本题主要考查化学方程式的应用。
12.D
【解析】A、密闭容器中,反应前的质量等于反应后的质量,4.8+16=10.8+4.4+a得a=5.6,X的质量增加,则X为生成物,错误;
B、X在反应前后质量改变了,不可能是催化剂,错误;
C、甲烷中氢元素的质量为: =1.2g,生成物水中氢元素的质量为: =1.2g ,故X中不含有氢元素,错误;
D、由题可知,该反应中氧气不足使使反应由了X 的生成,故增加氧气的质量可以减少X的生成,正确。故选D 。
13.置换反应
【解析】
【详解】
实验室用锌和稀H2SO4反应生成硫酸锌(ZnSO4)和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;该反应由一种单质与一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,属于置换反应。
14. 无 化合反应 1:3 有
【解析】(1)由两种或两种以上物质组成的物质叫混合物;由一种物质组成的物质叫纯净物;由一种元素组成的纯净物叫单质;由不同元素组成的纯净物叫化合物;由图中信息可知,反应后的单质是剩余的反应物,不是生成的,所以生成物质无单质;(2) 由两种或两种以上物质生成一种物质的反应叫化合反应;由一种物质生成两种或两种以上物质的反应叫分解反应;该反应属于化合反应;(3)据质量守恒定律可知反应前后原子的种类个数不变,参加反应的甲、乙两种分子的个数比是1:3;(4)单质中元素的化合价为零,化合物中元素的化合价代数和为零。发生化学反应前后乙元素化合价发生变化。
15.(1)CaO;CO2+Ca(OH)2=CaCO3↓+H2O
(2)11.1%;Fe3O4+4H23Fe+4H2O或CuO+H2Cu+H2O
【解析】
试题分析:若A为碳酸钙,D的溶解度随温度的升高而减小,D为氢氧化钙,B为氧化钙;二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,方程式为CO2 + Ca(OH)2 =CaCO3 ↓ + H2O;A为液态氧化物,D为黑色固体,则A为水,B为氧气,C为氢气,D为四氧化三铁,氢气和四氧化三铁在加热条件下反应生成水和铁,,水中氢的质量分数为2÷18×100%≈11.1%;一种单质和一种化合物生成另一种单质和另一种化合物的反应叫置换反应;Fe3O4 + 4H2 3Fe + 4H2O 或 CuO + H2 Cu + H2O都是置换反应。
考点:
16. 2Cl NO3 2CH4 2O3 4P+5O2?2P2O5 2H2O2H2↑+O2↑
【解析】本题主要考查学生对化学用语的书写和理解能力,书写时注意书写规范。
(1)①原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个氯原子,就可表示为:2Cl;
②离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故硝酸中的阴离子可表示为:NO3﹣;
③表示多个分子,在其化学式前加上相应的数字,所以2个甲烷分子可表示为:2CH4;
④元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氧化铝中铝元素的化合价,故可表示为:2O3;
(2)①红磷在空气中燃烧时生成五氧化二磷,反应的化学方程式是4P+5O2 2P2O5;
②水通电分解生成氢气和氧气,反应的化学方程式为:2H2O2H2↑+O2↑。
17.Ca2+或Mg2+C2NaCl+2H2O 2NaOH+H2↑+Cl2↑N2
【解析】
(1). 硬水是含可溶钙镁化合物(Ca2+或Mg2+)较多的水 (2). 溶液是均一稳定的混合物,在溶液中物质以分子或离子等微观粒子的的形式相互混合,因没有阻挡光线的微粒,所以溶液都是澄清透明的。蔗糖能和水形成均一稳定的的混合物,是溶液。 (3). 据质量守恒定律可推知生成的强碱是氢氧化钠,所以电解食盐水的方程式为:2NaCl+2H2O通电2NaOH+H2↑+Cl2↑ (4). 据质量守恒定律可知,化学反应前后原子的种类、个数不变,反应前有29个氧原子、5个碳原子、38个氢原子、6个氮原子,反应后有29个氧原子、5个碳原子、38个氢原子,所以一个X的分子中有2个氮原子;X的化学式为N2
18.K1 K3K2CaCO3 + 2HCl = CaCl2 + H2O + CO2↑CO2+ Ca(OH)2= CaCO3↓+H2ONa2CO3 + 2HCl = 2NaCl + H2O + CO2↑?C中有气泡产生
【解析】
【详解】
(1)打开止水夹K1和K3、关闭K2,从分液漏斗向装置A中加入足量的稀盐酸,稀盐酸与A中大理石反应生成二氧化碳,此时装置A中发生反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;当看到D中有大量浑浊产生时,CO2已集满,D中发生反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)关闭K1和K3,打开止水夹K2,从分液漏斗向装置C中加入适量滴有酚酞的氢氧化钠溶液,集气瓶中的二氧化碳与氢氧化钠反应,装置C中反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O;锥形瓶中的二氧化碳与氢氧化钠反应,压强变小,B装置中的压强大,就会将烧杯内的盐酸流入C中,然后盐酸与反应生成的碳酸钠反应,生成二氧化碳,因此有气泡生成。
19.【猜想】 CO2 、 水蒸气; 质量守恒定律,反应前后元素的种类不变
【实验探究】(2)NO2 (3) CO2 ; Ca(OH)2+CO2===H2O+CaCO3↓(4)①②③ (5)灼热的氧化铜 (或氧化铁) 黑色固体变为红色 (或红色固体变为黑色) (6)5.8g
【解析】
试题分析:该气体可能含有CO2 、 水蒸气;及少量的CO、NO和NO2等.你猜想含有这些气体的依据是质量守恒定律,反应前后元素的种类不变;将该气体通入足量澄清石灰水中,变浑浊说明该气体是二氧化碳,发生的反应为Ca(OH)2+CO2===H2O+CaCO3↓;C中新鲜血液颜色变暗;D中有红棕色气体产生,说明该气体含有一氧化碳和二氧化氮气体,所以①②③不正确;将(4)中C导出的气体通入灼热的氧化铜 (或氧化铁) 黑色固体变为红色 (或红色固体变为黑色),说明该气体中不含有一氧化碳。分析发现,每一个分子的一氧化碳变为一分子的二氧化碳后增加了一个氧原子,所以增加的氧元素的质量和一氧化碳中的氧元素的质量恰好相等,所以设原气体中一氧化碳的质量为X,则:X×16/28=12.4克-10.0克 求得X=4.2克;则则10g气体中二氧化碳的质量为=10.克-4.2克=5.8克。
考点:质量守恒定律 元素的质量的计算
20.N2 SO2 硫+氧气二氧化硫
【解析】
【详解】
(1)A是空气中含量最多的气体,故A为氮气,化学式为N2,B是一种黄色固体,在纯净的D中剧烈燃烧发出明亮的蓝紫色火焰,生成有刺激气味的气体C,通过该现象可知,此为硫粉在氧气中燃烧的现象,故B为硫粉,化学式为S,C为二氧化硫,化学式为SO2,D为氧气,化学式为O2;
(2)由(1)可知,硫在氧气中燃烧生成二氧化硫,故文字表达式为硫+氧气二氧化硫。
21.20g
【解析】
【分析】
由二氧化碳的质量根据碳酸钙与盐酸反应的化学方程式可以计算出需要的碳酸钙的质量。
【详解】
解:设需要碳酸钙的质量为x,
x=20g;
答:至少需要20g碳酸钙。
22.3.2g
【解析】设加热31.6g高锰酸钾可制取氧气的质量为x
2KMnO4 K2MnO4+MnO2+O2↑
316 32
31.6g x
31631.6g=32/x x=3.2g
答:加热31.6g高锰酸钾可制取氧气的质量为3.2g。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
