化学(苏教版选修2):《硫酸工业》课件
文档属性
| 名称 | 化学(苏教版选修2):《硫酸工业》课件 |

|
|
| 格式 | rar | ||
| 文件大小 | 616.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-01-18 16:56:00 | ||
图片预览



文档简介
课件12张PPT。硫酸工业高考要求1、了解硫酸工业的原理、流程及设备
2、理解硫酸工业的效益问题
3、理解物质转化率的问题预习提示:培烧黄铁矿的炉子为什么称为沸腾炉?
为什么通入接触室的混和气必须预先净化?
SO2接触氧化反应在什么温度、压强下进行最为有利?
在接触室中装有热交换器,它的作用是什么?
吸收SO3为什么不用水,而用的98.3%浓硫酸,这样的浓硫酸为什么要从塔顶喷下来?
为什么硫酸厂的尾气不经处理不准直接排入大气?
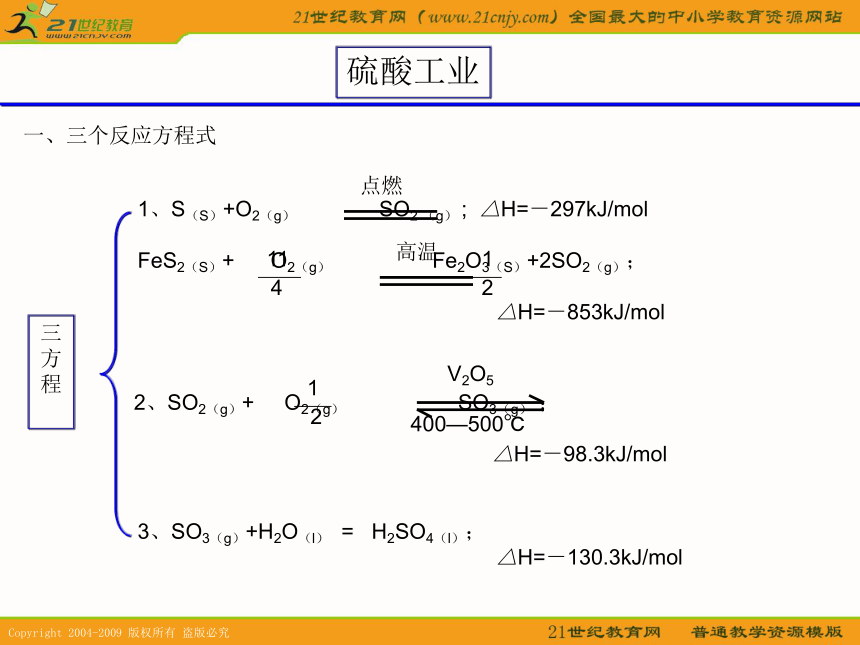
硫酸工业三方程3、SO3(g)+H2O(l) = H2SO4(l);
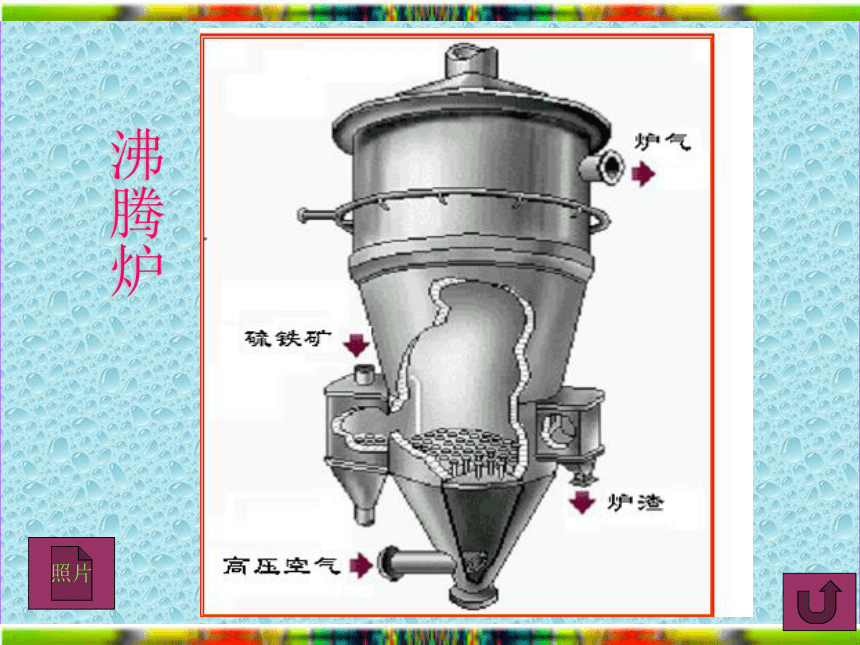
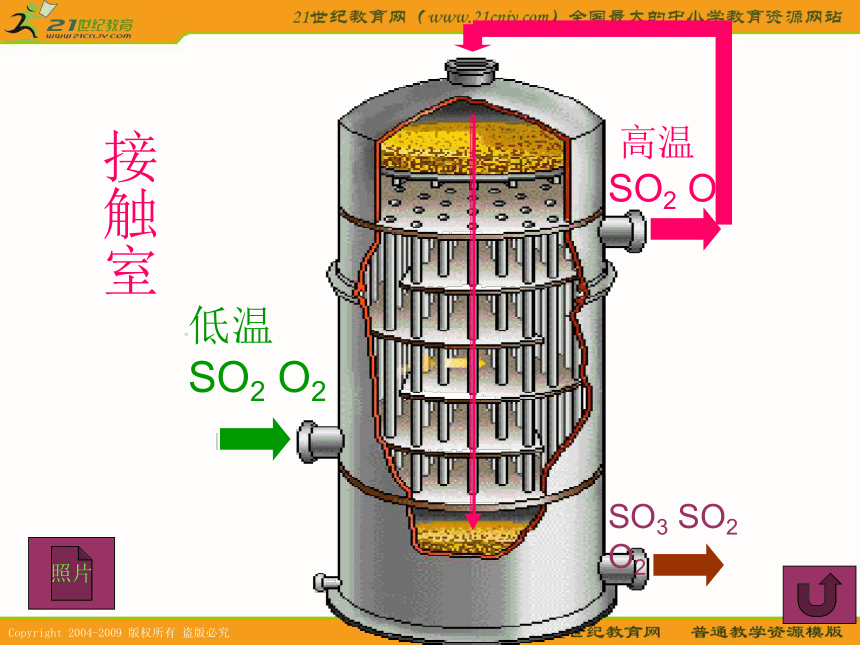
△H=-130.3kJ/mol一、三个反应方程式二、三个反应设备三设备1、沸腾炉:发生的是氧化还原反应。2、接触室:发生氧化还原反应,需要催化剂。3、吸收塔:发生的是非氧化还原反应。注意:为什么使用沸腾炉来制备SO2气体?注意:为什么要在不增加压强、却升高温度,并使用催化剂的条件下进行?注意:为什么要使用98.3%的浓硫酸替代水来吸收SO3?最后的尾气如何处理?沸腾炉沸腾炉照片接触室接触室照片低温 SO2 O2 高温
SO2 O2SO3 SO2 O2吸收塔吸收塔
硫酸工业生产流程动画 硫酸的工业生产沸腾炉接触室吸收塔净化冷却三、三个生产原理三原理1、平衡移动原理:选择适当且合理的反应条件。2、热交换原理:充分地利用热量,提高经济效益。3、逆流原理:提高吸收效率。四、气体的成分和流向沸腾炉进气
O2
N2出气
SO2
O2
N2
灰尘接触室进气
SO2
O2
N2出气
SO3
SO2
N2
O2吸收塔进气
SO3
SO2
N2
O2出气
SO2
O2
N2净化、预热五、硫酸工业三废的处理1、尾气吸收SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O2、污水处理Ca(OH)2+H2SO4=CaSO4+2H2O3、废渣的处理:主要是回收利用,制造水泥、砖,还可以 用含铁量高的炉渣进行炼铁。六、生产规模和厂址选择1、是否有市场需求 2、是否接近原料供应地
3、土地供应是否充足 4、水源是否充足
5、能源是否充足且廉价 6、交通运输是否方便
7、能否达到环境保护要求七、物质转化率问题例如:用黄铁矿可以制备硫酸,再用硫酸制取化肥硫酸铵。今燃烧含FeS280%的黄铁矿75吨,生产出79.2吨硫酸铵。若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制硫酸时的损失率是多少?解:设黄铁矿制硫酸时的利用率为x
由题意可得如下关系式:
FeS2————2(NH4)2SO4
120 2×132
75×80%×90%×x 79.2
解得:x=66.67%
则FeS2的损失率为100%-66.67%=33.33%关键:
1、理解每步反应的转化率和能够区分转化率和百分含量
2、能够找出恰当的关系式
2、理解硫酸工业的效益问题
3、理解物质转化率的问题预习提示:培烧黄铁矿的炉子为什么称为沸腾炉?
为什么通入接触室的混和气必须预先净化?
SO2接触氧化反应在什么温度、压强下进行最为有利?
在接触室中装有热交换器,它的作用是什么?
吸收SO3为什么不用水,而用的98.3%浓硫酸,这样的浓硫酸为什么要从塔顶喷下来?
为什么硫酸厂的尾气不经处理不准直接排入大气?
硫酸工业三方程3、SO3(g)+H2O(l) = H2SO4(l);
△H=-130.3kJ/mol一、三个反应方程式二、三个反应设备三设备1、沸腾炉:发生的是氧化还原反应。2、接触室:发生氧化还原反应,需要催化剂。3、吸收塔:发生的是非氧化还原反应。注意:为什么使用沸腾炉来制备SO2气体?注意:为什么要在不增加压强、却升高温度,并使用催化剂的条件下进行?注意:为什么要使用98.3%的浓硫酸替代水来吸收SO3?最后的尾气如何处理?沸腾炉沸腾炉照片接触室接触室照片低温 SO2 O2 高温
SO2 O2SO3 SO2 O2吸收塔吸收塔
硫酸工业生产流程动画 硫酸的工业生产沸腾炉接触室吸收塔净化冷却三、三个生产原理三原理1、平衡移动原理:选择适当且合理的反应条件。2、热交换原理:充分地利用热量,提高经济效益。3、逆流原理:提高吸收效率。四、气体的成分和流向沸腾炉进气
O2
N2出气
SO2
O2
N2
灰尘接触室进气
SO2
O2
N2出气
SO3
SO2
N2
O2吸收塔进气
SO3
SO2
N2
O2出气
SO2
O2
N2净化、预热五、硫酸工业三废的处理1、尾气吸收SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O2、污水处理Ca(OH)2+H2SO4=CaSO4+2H2O3、废渣的处理:主要是回收利用,制造水泥、砖,还可以 用含铁量高的炉渣进行炼铁。六、生产规模和厂址选择1、是否有市场需求 2、是否接近原料供应地
3、土地供应是否充足 4、水源是否充足
5、能源是否充足且廉价 6、交通运输是否方便
7、能否达到环境保护要求七、物质转化率问题例如:用黄铁矿可以制备硫酸,再用硫酸制取化肥硫酸铵。今燃烧含FeS280%的黄铁矿75吨,生产出79.2吨硫酸铵。若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制硫酸时的损失率是多少?解:设黄铁矿制硫酸时的利用率为x
由题意可得如下关系式:
FeS2————2(NH4)2SO4
120 2×132
75×80%×90%×x 79.2
解得:x=66.67%
则FeS2的损失率为100%-66.67%=33.33%关键:
1、理解每步反应的转化率和能够区分转化率和百分含量
2、能够找出恰当的关系式
同课章节目录
- 专题一 多样化的水处理技术
- 第一单元 水的净化与污水处理
- 第二单元 硬水软化
- 第三单元 海水淡化
- 专题二 从自然资源到化学品
- 第一单元 氨的合成
- 第二单元 氯碱生产
- 第三单元 硫酸工业
- 第四单元 镁和铝的冶炼
- 专题三 让有机反应为人类造福
- 第一单元 有机药物制备
- 第二单元 合成洗涤济的生产
- 第三单元 纤维素的化学加工
- 第四单元 有机高分子合成
- 专题四 材料加工与性能优化
- 第一单元 材料的加工处理
- 第二单元 材料组成的优化
- 第三单元 复合材料的制造
- 专题五 为现代农业技术添翼
- 第一单元 土壤酸碱性的改良
- 第二单元 化肥的生产与合理使用
- 第三单元 无土栽培技术
- 第四单元 化学农药的发展
- 专题六 从污染防治到绿色化学
- 第一单元 环境污染的化学防治
- 第二单元 绿色化学与可持续发展
