化学(苏教版选修2):《氯碱生成》课件
文档属性
| 名称 | 化学(苏教版选修2):《氯碱生成》课件 |

|
|
| 格式 | rar | ||
| 文件大小 | 497.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-01-18 00:00:00 | ||
图片预览






文档简介
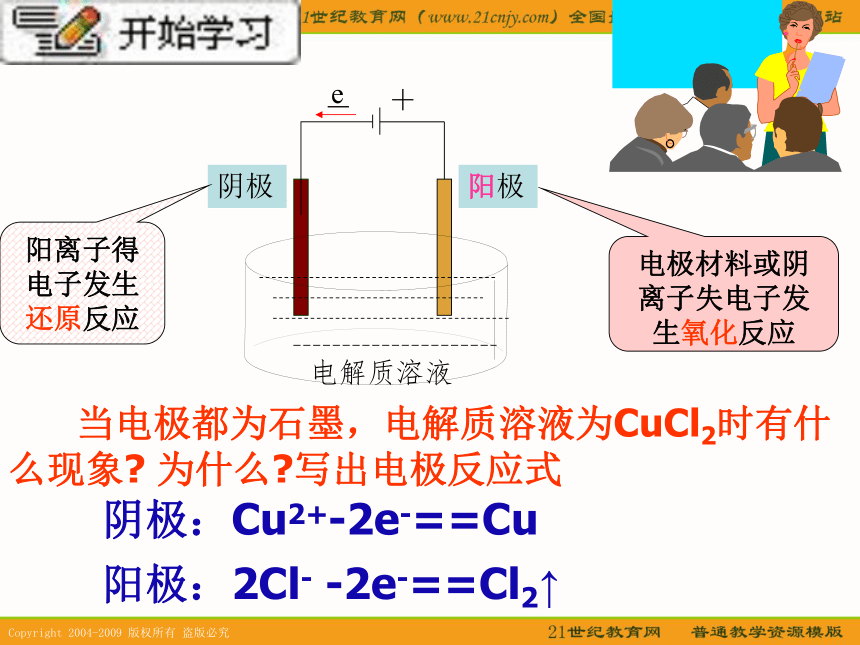
课件16张PPT。第二单元 氯碱生产专题2 从自然资源到化学品 于是,人们将目光投向海水、盐湖,这里蕴藏着丰富的食盐资源。食盐不仅来源广、价廉易得,从其组成看也是制取烧碱和氯气的理想原料。在反复研制的基础上,人们终于以食盐为主要原料制得了烧碱和氯气并由此形成了氯碱工业 随着纺织、造纸、石油化工以及有机合成工业的迅速发展,对烧碱和氯气的需求量剧增,而为了获取大量的烧碱和氯气,关键又在于寻求理想的原料和采用新的生产方法。 知识支持 一般在惰性电极时,阴、阳离子的放电顺序如下: 阴离子放电顺序:S2-> I-> Br->Cl-> OH->含氧酸根> F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+。 e阴极阳极阳离子得电子发生还原反应电极材料或阴离子失电子发生氧化反应电解质溶液 当电极都为石墨,电解质溶液为CuCl2时有什么现象? 为什么?写出电极反应式阴极:Cu2+-2e-==Cu阳极:2Cl- -2e-==Cl2↑ 电解质溶液为氯化钠时,情况如何?写出电极反应式和总反应式阴极:2H+ +2e— = H2↑阳极:2Cl— +2e— = Cl2↑溶液中存在的离子为:Na+ 、OH—NaOH烧碱和氯气是重要的基本化工原料 在电解饱和食盐水的实验中,阳极产生的氯气与阴极产生的氢气、NaOH溶液之间能否发生化学反应?若能发生,会产生什么危害?你认为可以采用什么方法来避免?请你与同学们交流讨论。交流.研讨1、H2和Cl2混合不安全
2、Cl2会和NaOH反应,会使得到的NaOH不纯
氯碱工业:通过电解饱和食盐水来生产烧碱、氯气和氢气,并以它们为原料生产一系列化工产品的工业一、氯碱生产的核心技术——电解 使电流通过电解质溶液或熔融态的电解质,在阴、阳两极分别发生还原反应和氧化反应的过程叫做电解。 对电解槽结构进行优化设计,合理选用电极和隔膜材料,是电解生产的核心。石棉隔膜电解槽 离子交换膜电解槽2NaCl+2H2O 2NaOH+Cl2↑+H2↑ 1.离子膜电解槽的简单构造如何? 2.离子膜的作用是什么? 3.工业制碱的简单生产流程怎样?二、食盐水电解工艺——阳离子交换膜法电解 1、生产的主体设备:离子膜电解槽
简单构造:阳极:金属钛网(涂钛钌氧化物)
阴极:碳钢网(有镍涂层)
阳离子交换膜:只允许阳离子通过,
把电解槽隔成阴极室和阳极室。
2、添加原料
阳极室:精制的饱和食盐水
阴极室:添加纯水(加一定量的NaOH溶液)
3、离子交换膜的作用:
(1)防止Cl2和H2混合而引起爆炸
(2)避免Cl2与NaOH反应生成NaClO,影响NaOH的产量三、氯碱生产的流程1.用什么方法除去泥沙?
2.用什么试剂除去Ca2+、Mg2+、Fe3+、SO42-?
3.所用试剂只有过量才能除净这些杂质,试设计一个合理的顺序逐一除杂。
思考:粗盐水(Ca2+、Mg2+、Fe3+、SO42-)Ba2+ + SO42- =BaSO4↓Na+ 、 Ca2+、Mg2+、Fe3+、Ba2+ 、 Cl-BaSO4↓Ca2+ + CO32- = CaCO3↓
Ba2+ + CO32- = BaCO3↓CaCO3↓
BaCO3↓过量Na2CO3Na+、 Mg2+、 Ca2+ 、 Cl- 、 OH-Mg2+ + 2OH- = Mg(OH)2↓
Fe3+ + 3OH- = Fe(OH)3↓过量NaOHFe(OH)3↓
Mg(OH)2↓Mg2+、 Ca2+、 Na+、 Cl- 、 OH-、CO32-精制食盐水适量HCl,调节PH通过阳离子交换树脂Na+、 Cl-四、氯碱工业产品的应用五、法拉第电解定律
1、法拉第电解第一定律
——电解时在电极上析出(或溶解)的物质的物质的量跟通过的电量成正比。
2、法拉第电解第二定律——在电解时,电极上每通过96500库仑的电量就会有1mol电子发生转移,产生1/Zmol(Z是电极上放电离子得失的电子数)电解产物。定律的应用:详见课本P26 讨论:利用惰性电极对硫酸钠水溶液进行电解可得产品氢气、氧气、氢氧化钠和硫酸四种纯净物,试设计实验装置图。阳离子交换膜Na2SO4O2H2SO2-4→←Na+
2、Cl2会和NaOH反应,会使得到的NaOH不纯
氯碱工业:通过电解饱和食盐水来生产烧碱、氯气和氢气,并以它们为原料生产一系列化工产品的工业一、氯碱生产的核心技术——电解 使电流通过电解质溶液或熔融态的电解质,在阴、阳两极分别发生还原反应和氧化反应的过程叫做电解。 对电解槽结构进行优化设计,合理选用电极和隔膜材料,是电解生产的核心。石棉隔膜电解槽 离子交换膜电解槽2NaCl+2H2O 2NaOH+Cl2↑+H2↑ 1.离子膜电解槽的简单构造如何? 2.离子膜的作用是什么? 3.工业制碱的简单生产流程怎样?二、食盐水电解工艺——阳离子交换膜法电解 1、生产的主体设备:离子膜电解槽
简单构造:阳极:金属钛网(涂钛钌氧化物)
阴极:碳钢网(有镍涂层)
阳离子交换膜:只允许阳离子通过,
把电解槽隔成阴极室和阳极室。
2、添加原料
阳极室:精制的饱和食盐水
阴极室:添加纯水(加一定量的NaOH溶液)
3、离子交换膜的作用:
(1)防止Cl2和H2混合而引起爆炸
(2)避免Cl2与NaOH反应生成NaClO,影响NaOH的产量三、氯碱生产的流程1.用什么方法除去泥沙?
2.用什么试剂除去Ca2+、Mg2+、Fe3+、SO42-?
3.所用试剂只有过量才能除净这些杂质,试设计一个合理的顺序逐一除杂。
思考:粗盐水(Ca2+、Mg2+、Fe3+、SO42-)Ba2+ + SO42- =BaSO4↓Na+ 、 Ca2+、Mg2+、Fe3+、Ba2+ 、 Cl-BaSO4↓Ca2+ + CO32- = CaCO3↓
Ba2+ + CO32- = BaCO3↓CaCO3↓
BaCO3↓过量Na2CO3Na+、 Mg2+、 Ca2+ 、 Cl- 、 OH-Mg2+ + 2OH- = Mg(OH)2↓
Fe3+ + 3OH- = Fe(OH)3↓过量NaOHFe(OH)3↓
Mg(OH)2↓Mg2+、 Ca2+、 Na+、 Cl- 、 OH-、CO32-精制食盐水适量HCl,调节PH通过阳离子交换树脂Na+、 Cl-四、氯碱工业产品的应用五、法拉第电解定律
1、法拉第电解第一定律
——电解时在电极上析出(或溶解)的物质的物质的量跟通过的电量成正比。
2、法拉第电解第二定律——在电解时,电极上每通过96500库仑的电量就会有1mol电子发生转移,产生1/Zmol(Z是电极上放电离子得失的电子数)电解产物。定律的应用:详见课本P26 讨论:利用惰性电极对硫酸钠水溶液进行电解可得产品氢气、氧气、氢氧化钠和硫酸四种纯净物,试设计实验装置图。阳离子交换膜Na2SO4O2H2SO2-4→←Na+
同课章节目录
- 专题一 多样化的水处理技术
- 第一单元 水的净化与污水处理
- 第二单元 硬水软化
- 第三单元 海水淡化
- 专题二 从自然资源到化学品
- 第一单元 氨的合成
- 第二单元 氯碱生产
- 第三单元 硫酸工业
- 第四单元 镁和铝的冶炼
- 专题三 让有机反应为人类造福
- 第一单元 有机药物制备
- 第二单元 合成洗涤济的生产
- 第三单元 纤维素的化学加工
- 第四单元 有机高分子合成
- 专题四 材料加工与性能优化
- 第一单元 材料的加工处理
- 第二单元 材料组成的优化
- 第三单元 复合材料的制造
- 专题五 为现代农业技术添翼
- 第一单元 土壤酸碱性的改良
- 第二单元 化肥的生产与合理使用
- 第三单元 无土栽培技术
- 第四单元 化学农药的发展
- 专题六 从污染防治到绿色化学
- 第一单元 环境污染的化学防治
- 第二单元 绿色化学与可持续发展
