2011届上海市黄浦区高三第一学期期终基础学业测评化学卷
文档属性
| 名称 | 2011届上海市黄浦区高三第一学期期终基础学业测评化学卷 |

|
|
| 格式 | zip | ||
| 文件大小 | 326.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-01-22 00:00:00 | ||
图片预览



文档简介
黄浦区2010学年度第一学期期终基础学业测评
高三化学试卷 2011.1
(满分100分,考试时间90分钟)
相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Na-23 Mg-24 Al-27 P-31 Ca-40 Fe-56 Cu-64
一、选择题(每小题只有1个正确选项,第1~10题每小题1分,第11~22题每小题2分,共34分)
1.化学与能源开发、环境保护、资源利用等密切相关。下列说法错误的是( )
A.为提高农作物的产量和质量,应适量合理使用化肥和农药
B.垃圾是放错地方的资源,应分类回收利用
C.实现化石燃料清洁利用,同时需要开发新能源
D.绿色化学的核心是应用化学原理对环境污染进行治理
2.下列仪器名称正确的是 ( )
A.三脚架 B.表面皿 C.镊子 D.瓷钳锅
3. 化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.NaOH的电子式: B.氯的原子结构示意图
C.Na2S的电子式: D.质量数为37的氯原子Cl
4.方志敏烈士在狱中曾用米汤给鲁迅先生写信,鲁迅先生收到信后,为了看清信的内容,使用的化学试剂是( )
A.硝酸银溶液 B.碘化钾淀粉试液
C.石蕊试液 D.碘酒
5.2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于Pt的说法正确的是( )
A.Pt和Pt的核外电子数相同,是同一种原子
B.Pt和Pt的中子数相同,互称为同位素
C.Pt和Pt的质子数相同,互称为同位素
D.Pt和Pt的质量数不同,不能互称为同位素
6.下列有关实验操作错误的是( )
A.用药匙取用粉末状或小颗粒状固体 B.用胶头滴管滴加少量液体
C.给盛有体积液体的试管加热 D.倾倒液体时试剂瓶标签面向手心
7.原子结构模型的演变:①道尔顿实心球式原子模型; ②卢瑟福行星运转式原子模型;③汤姆孙葡萄干面包式原子模型;④近代量子力学原子模型;⑤玻尔轨道式原子模型。下列排序符合历史演变顺序的是( )
A.①③②⑤④ B.①②③④⑤
C.①⑤③②④ D.①③⑤④②
8.14C是宇宙射线与大气中的氮通过核反应产生的,下列有关14C的说法中错误的是( )
A.0.012kg的14C中所含碳原子数等于阿伏加德罗常数
B.可根据14C在生物体内的含量来计算生物体的死亡年代
C.等物质的量的14C与12C所含的中子数不同
D.14C与12C互为同位素
9. 将Cl2制成漂粉精的主要目的是( )
A. 增强漂白和消毒作用
B. 使它转化为较稳定物质,便于保存和运输
C.使它转化为较易溶于水的物质
D. 增加氯的质量分数,有利于漂白、消毒
10.化合物N5AsF6中含有高能量的阳离子N5+,下列有关叙述错误的是 ( )
A.1个N5+阳离子共有34个核外电子
B.N5+中氮氮原子间以共用电子对结合
C.化合物N5AsF6中As元素的化合价为+1
D.化合物N5AsF6中F元素的化合价为-1
11.在右图所示的实验装置中,先打开活塞B,在A处通入干燥氯气,C中红色布条颜色无变化;再关闭活塞B,继续在A处通入干燥氯气,C处红色布条颜色褪去。可见D瓶中盛有的溶液是( )
A.浓硫酸 B.饱和NaCl溶液
C.浓NaOH溶液 D.浓NaBr溶液
12.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列5 项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液; ⑤加过量的氯化钡溶液。下列正确的操作顺序是( )
A. ①④②⑤③ B. ⑤②①④③
C. ④①②⑤③ D. ②⑤④①③
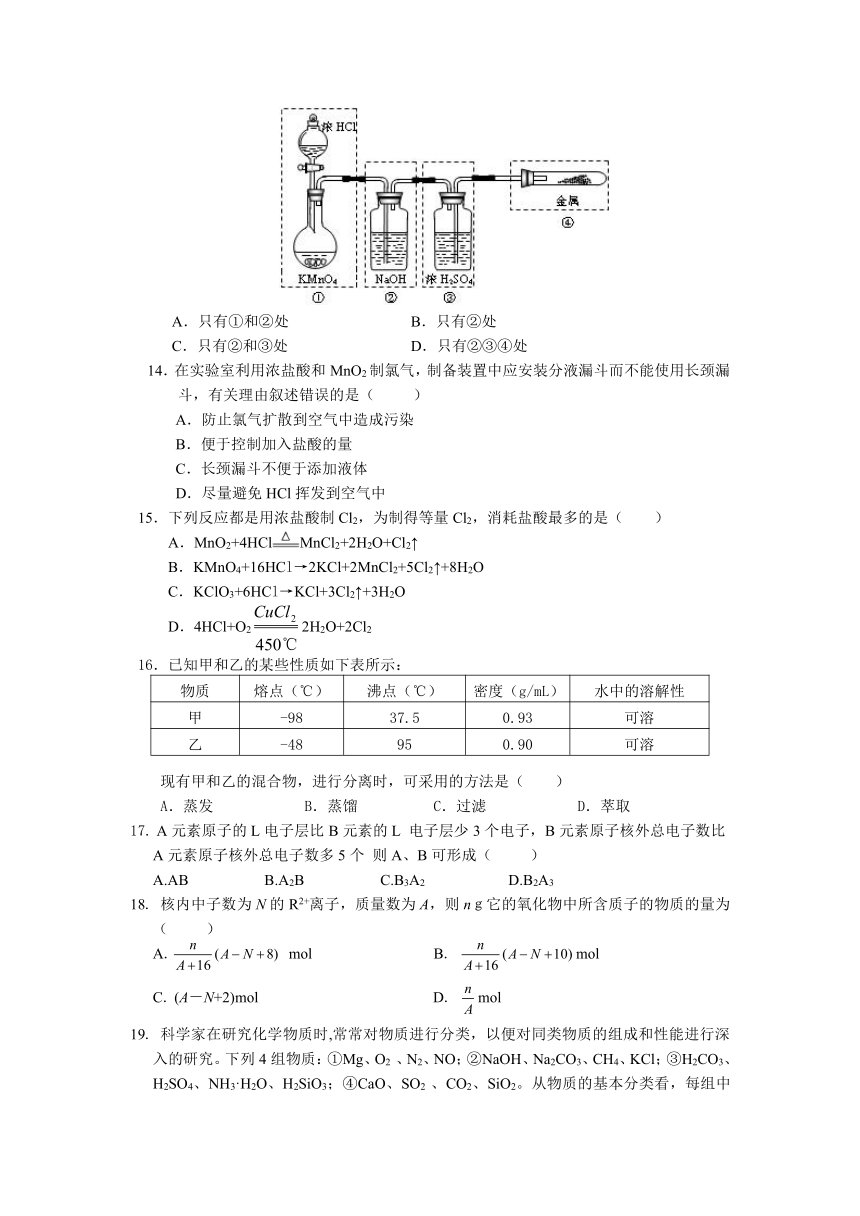
13.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
A.只有①和②处 B.只有②处
C.只有②和③处 D.只有②③④处
14.在实验室利用浓盐酸和MnO2制氯气,制备装置中应安装分液漏斗而不能使用长颈漏斗,有关理由叙述错误的是( )
A.防止氯气扩散到空气中造成污染
B.便于控制加入盐酸的量
C.长颈漏斗不便于添加液体
D.尽量避免HCl挥发到空气中
15.下列反应都是用浓盐酸制Cl2,为制得等量Cl2,消耗盐酸最多的是( )
A.MnO2+4HClMnCl2+2H2O+Cl2↑
B.KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
C.KClO3+6HCl→KCl+3Cl2↑+3H2O
D.4HCl+O22H2O+2Cl2
16.已知甲和乙的某些性质如下表所示:
物质 熔点(℃) 沸点(℃) 密度(g/mL) 水中的溶解性
甲 -98 37.5 0.93 可溶
乙 -48 95 0.90 可溶
现有甲和乙的混合物,进行分离时,可采用的方法是( )
A.蒸发 B.蒸馏 C.过滤 D.萃取
17. A元素原子的L电子层比B元素的L 电子层少3个电子,B元素原子核外总电子数比A元素原子核外总电子数多5个 则A、B可形成( )
A.AB B.A2B C.B3A2 D.B2A3
18. 核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的量为( )
A. mol B. mol
C. (A-N+2)mol D. mol
19. 科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。下列4组物质:①Mg、O2 、N2、NO;②NaOH、Na2CO3、CH4、KCl;③H2CO3、H2SO4、NH3·H2O、H2SiO3;④CaO、SO2 、CO2、SiO2。从物质的基本分类看,每组中都有一种物质与其它物质不属于同一类,这4种物质分别是( )
A.Mg、Na2CO3、H2CO3、CaO B.O2、NaOH、H2SO4、SiO2
C.NO、CH4、NH3·H2O、CaO D.NO、KCl、H2SiO3、SO2
20.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
A.35Cl原子所含质子数为18
B.1 mol的1H35Cl分子所含中子数约为19×6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 L
D.35Cl2气体的摩尔质量为70 g·mol-1
21.元素X与Y组成A、B两种化合物,A中X的质量占,B中X的质量占,则化合物A和B的分子式分别是 ( )
A.XY和XY2 B.X2Y和X2Y3 C.XY2和X2Y D.XY3和X2Y4
22.20℃时有a g硫酸铜溶液V mL,将溶液蒸发掉b g水后恢复到20℃,恰好全部生成硫酸铜晶体(CuSO4·5H2O),则下列关系式错误的是( )
A.原硫酸铜溶液的密度为
B.生成硫酸铜晶体的物质的量为
C.原硫酸铜溶液的物质的量浓度为
D.原硫酸铜溶液的质量分数
二、理论题(本大题有4小题,共29分)
23.某元素M的原子核内质子数与中子数相等,它形成气态氢化物在标准状况下的密度是1.518g/L,该氢化物0.5mol充分燃烧,生成9g水,则M的元素符号为 ,原子序数是 ,原子结构示意图为 ,M的阴离子电子层结构与____________等微粒相同。
24.(1)用滴管将新制的饱和氯水逐滴滴入含酚酞的氢氧化钠的稀溶液中,当滴到最后一滴时,红色突然褪去。产生该现象的原因可能有两个:
①是由于__________________________________________________;
②是由于__________________________________________________。
用实验证明红色褪去的原因是①或者是②,其方法是:______________________
_______________________________________。
(2)在一定条件下氯气可与氯化铵发生反应:xCl2+yNH4Cl→yNCln+(x+y)HCl
当消耗6.72 L标准状况下的氯气时,生成0.10 mol氮的氯化物,则此氮的氯化物的化学式为________。
25.1811年法国化学家库特瓦用硫酸处理海藻灰时发现了碘。碘单质通常状况下为_______色固体,其制剂可用来消毒和治疗甲状腺肿。碘缺乏病是目前已知的导致人类智力障碍的主要原因,因此碘元素称作“智慧元素”。碘的单质有两种特性,一是物理特性:_____________________;二是化学特性:____________________________。
1824年法国化学家巴拉尔用氯气处理提取食盐后的盐水母液时发现了溴。溴元素的99%存在于海洋,称作“海洋元素”,其化合物可用作镇静剂。溴的原子序数为35,其原子结构简图为________________;溴化钠中存在的化学键是____________,在物理性质上表现出_______________________。氯化钠的电子式为_________,溴化钠的电离方程式为_________________ 。检验某固体试样中是否有Br-的方法为____________
_______________________________________________________。
26.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则该气体的物质的量为 mol,该气体所含原子总数为 个,在标准状况下该气体的体积为 L。若该气体不与水反应,将其溶于1L水中,所得溶液中溶质的质量分数为 ,该气体溶于水后形成VL溶液,其溶液的物质的量浓度为 mol/L。
三、实验题(本大题有3小题,共31分。其中第29题为分叉题,普通中学做29A,重点中学做29B)
27.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
(1) 从上述步骤中可知,海带中含有的碘元素的主要存在形式是 。
(2) 步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是 。
(3) 步骤④中的转化还可以Cl2或双氧水,请分别写出反应的离子方程式:
、 。
(4) 步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出
下列实验装置中的错误之处。
①
②
进行上述蒸馏操作时,使用水浴的
原因是 、
______________________________,
最后晶态碘在 里聚集。
28.某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):
试回答下列问题:
(1) 下列方法中,可制得氯气的是________________。
① MnO2和浓盐酸混合共热 ② MnO2、NaCl和浓硫酸混合共热
③ 次氯酸钠和浓盐酸混合 ④ KClO3和浓盐酸混合共热
⑤ KMnO4和浓盐酸混合
(2) 若用含有0.2mol HCl 的浓盐酸与足量MnO2反应制取Cl2,制得的Cl2在标准状况下的体积总是小于1.12L的原因是___________________________________。
(3) ①装置B的作用是__________,现象是______________________________。
②装置C和D出现的不同现象说明的问题是___________________________________。
③装置E 的作用应该是___________________________________________。
④写出装置F中发生反应的离子方程式_______________________________。
(4)乙同学认为甲同学的实验有缺陷,不能确认最终通入AgNO3溶液中的气体只有一种,为了保证实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在______之间(填装置字母序号),装置中应加入_______________________。
29.(A)实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2) 比较制取氯酸钾和次氯酸钠的条件,二者的差异是:
反应完毕经冷却后,②的试管中有大量晶体析出。
右图中符合该晶体溶解度曲线的是
(填写编号字母);冷却后从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是 ,实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 原因
溶液最初从紫色逐渐变为 色 氯气与水反应生成的H+使石蕊变色
随后溶液逐渐变为无色
然后溶液从无色逐渐变为 色
29.(B)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的一种方法: 。
(2)将NaCl溶液电解,在电解槽中可直接得到的产品H2、 、 ,或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 _________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了解到如下装置:
请你参与分析讨论:
① 图中仪器B的名称: 。
② 整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________________
。
③ 实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
④ C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
四、计算题(本题为分叉题,普通中学做30A,重点中学做30B,共6分)
30.(A)使一定量的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第1支玻璃管中装有铜屑,第2支玻璃管中装有氧化铜,第1支玻璃管中由于发生如下反应:2PH3+CuCu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第2支玻璃管中物质的质量减少了5.76 g。
(1)计算原混合气体中磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
30.(B)生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L标准状况下的该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuOCO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管中物质的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1) 试计算原混合气体中甲烷的物质的量。
(2) 原混合气体中氮气的体积分数为多少?
黄浦区2010学年度第一学期高三化学期终测试题
参考答案与评分要求
一、选择题(每小题只有1个正确选项,第1~10题每小题1分,第11~22题每小题2分,共34分)
1.D 2.B 3.A 4.D 5.C 6.C 7.A 8. A 9.B 10.C 11. B 12.D 13.D 14.C 15.A 16.B 17.C 18.A 19.C 20.D 21.D 22.C
二、理论题(本题共29分)
23.(每空1分,共4分)
S 16 P3-、 Cl-、Ar、K+、Ca2+(任选一种)
24.(9分)(1)①氯水中H+与碱中和(2分) ②氯水中HClO强氧化性所致(2分) 向褪色溶液中再滴加NaOH溶液,若红色再现,则是①;若红色不再现,则是②。(3分)
(2)NCl3(2分)
25.(11分,最后一空3分,其余每空1分)
紫黑 易升华,遇淀粉显蓝色 离子键
熔沸点较高、硬度较大(选答一点即给分) NaBr→Na+ + Br-
取固体试样少许用蒸馏水溶解(1分),再滴加硝酸酸化的硝酸银溶液(1分),若有浅黄色沉淀生成,则证实有Br-存在。(1分)
26.(5分,每空1分) ×100%
三、实验题(本大题有3题,共31分。其中第29题为分叉题,普通中学做29A,重点中学做29B)
27.(每空1分,共9分)
(1)有机碘(或化合态碘)(2)坩埚 、酒精灯、坩埚钳 (3)2I- +Cl2→I2+Cl- ,
2I -+H2O2+2H+→I2+2H2O (4)①温度计水银球位置没有放在蒸馏烧瓶的支管口
②冷凝管中的水流方向错误 ③加热时在烧杯上没有垫石棉网(可任选两点)
受热均匀;容易控制反应温度;反应温度低于100℃(可任选两点) 蒸馏烧瓶
28.(10分)(1)①②③④⑤(2分,不全面给1分)
(2)浓盐酸的浓度随反应的不断进行逐渐变稀,变稀后将不再反应 (1分)
(3)①证明有水蒸气产生(1分);白色固体变蓝色(1分)
②氯气无漂白性,次氯酸有漂白性(1分)
③吸收氯气(1分) ④Ag++Cl―→ AgCl↓(1分)
(4)E与F(1分) (5)碘化钾淀粉试液(1分)
29.(A)(12分,本题除已标注的2分外其余每空1分)
(1)分液漏斗 B
(2)碱溶液(或反应物)的浓度不同,反应温度不同(2分) M 过滤
(3)Cl2+2OH-→ClO-+Cl-+H2O (2分)
红
氯气与水反应生成的HClO将石蕊氧化为无色物质
黄绿 继续通入的氯气溶于水使溶液呈黄绿色
29.(B)(12分)
(1)蒸馏法,电渗析法,离子交换法等(1分,只要求1种方法)
(2)Cl2 NaOH,NaClO (2分) (3)富集溴元素 (1分)
(4)SO2 +Br2+2H2O → 4H++ 2Br-+SO42- (2分)
强酸对设备的严重腐蚀(1分)
(5)①冷凝管 (1分) ②Br2腐蚀橡胶(1分)
③控制温度计b的温度,并收集59℃时的馏分(1分)
④深红棕色;分液(或蒸馏)(2分)
四、计算题(本题为分叉题,普通中学做30A,重点中学做30B,共6分)
(每小题3分,要求有计算过程)
30(A).(1)
解法1.第2支试管中氧化铜失去的质量为氧元素,其物质的量是5.76/16=0.36 mol,与氧元素结合成H2O的是氢元素,相当于H2亦为0.36 mol。
第1支试管获得的质量是磷元素,其物质的量为4.96/31=0.16 mol,即原PH30.16 mol,它释放的H2为0.24 mol,原H2的物质的量则为0.36-0.24=0.12 mol。
故原混合气体中磷化氢和氢气的体积比 4∶3
解法2.2PH3 + 3Cu→Cu3P2(s)+3H2 增加的质量
68 6 62
m(PH3) m(H2) 4.96
解得:m(PH3) =5.44g,
解得:m(H2) =0.48g
H2+CuO→Cu+H2O 减少的质量
2 16
m(H2‘) 5.76g
解得:m(H2‘) =0.72g
即原来氢气的质量是0.72-0.48=0.24g,
n(PH3)==0.16mol,n(H2)==0.12mol
故磷化氢和氢气的体积比=磷化氢和氢气的物质的量之比=0.16∶0.12=4∶3
(2)原混合气体平均摩尔质量= =20.3g/mol
在标准状况下,原混合气体的密度==0.91g/L
30(B).
(1)硬质玻璃管中物质减少的质量为CuO中的氧的质量
n(CuO)= = 0.3mol
由化学方程式可知反应的CH4的物质的量为0.075mol。
(2)生成的CO2也为0.075mol
将气体通过澄清的石灰水生成8.5g沉淀,所以n(CO2)=0.085mol
原混合气体中的n(CO2)=0.01mol,气体的总物质的量= =0.09mol,
n(N2)=0.005mol,N2的体积分数= ×100%=5.56%。
2
8
6
+167
2
8
184
7
+35
高三化学试卷 2011.1
(满分100分,考试时间90分钟)
相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Na-23 Mg-24 Al-27 P-31 Ca-40 Fe-56 Cu-64
一、选择题(每小题只有1个正确选项,第1~10题每小题1分,第11~22题每小题2分,共34分)
1.化学与能源开发、环境保护、资源利用等密切相关。下列说法错误的是( )
A.为提高农作物的产量和质量,应适量合理使用化肥和农药
B.垃圾是放错地方的资源,应分类回收利用
C.实现化石燃料清洁利用,同时需要开发新能源
D.绿色化学的核心是应用化学原理对环境污染进行治理
2.下列仪器名称正确的是 ( )
A.三脚架 B.表面皿 C.镊子 D.瓷钳锅
3. 化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.NaOH的电子式: B.氯的原子结构示意图
C.Na2S的电子式: D.质量数为37的氯原子Cl
4.方志敏烈士在狱中曾用米汤给鲁迅先生写信,鲁迅先生收到信后,为了看清信的内容,使用的化学试剂是( )
A.硝酸银溶液 B.碘化钾淀粉试液
C.石蕊试液 D.碘酒
5.2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于Pt的说法正确的是( )
A.Pt和Pt的核外电子数相同,是同一种原子
B.Pt和Pt的中子数相同,互称为同位素
C.Pt和Pt的质子数相同,互称为同位素
D.Pt和Pt的质量数不同,不能互称为同位素
6.下列有关实验操作错误的是( )
A.用药匙取用粉末状或小颗粒状固体 B.用胶头滴管滴加少量液体
C.给盛有体积液体的试管加热 D.倾倒液体时试剂瓶标签面向手心
7.原子结构模型的演变:①道尔顿实心球式原子模型; ②卢瑟福行星运转式原子模型;③汤姆孙葡萄干面包式原子模型;④近代量子力学原子模型;⑤玻尔轨道式原子模型。下列排序符合历史演变顺序的是( )
A.①③②⑤④ B.①②③④⑤
C.①⑤③②④ D.①③⑤④②
8.14C是宇宙射线与大气中的氮通过核反应产生的,下列有关14C的说法中错误的是( )
A.0.012kg的14C中所含碳原子数等于阿伏加德罗常数
B.可根据14C在生物体内的含量来计算生物体的死亡年代
C.等物质的量的14C与12C所含的中子数不同
D.14C与12C互为同位素
9. 将Cl2制成漂粉精的主要目的是( )
A. 增强漂白和消毒作用
B. 使它转化为较稳定物质,便于保存和运输
C.使它转化为较易溶于水的物质
D. 增加氯的质量分数,有利于漂白、消毒
10.化合物N5AsF6中含有高能量的阳离子N5+,下列有关叙述错误的是 ( )
A.1个N5+阳离子共有34个核外电子
B.N5+中氮氮原子间以共用电子对结合
C.化合物N5AsF6中As元素的化合价为+1
D.化合物N5AsF6中F元素的化合价为-1
11.在右图所示的实验装置中,先打开活塞B,在A处通入干燥氯气,C中红色布条颜色无变化;再关闭活塞B,继续在A处通入干燥氯气,C处红色布条颜色褪去。可见D瓶中盛有的溶液是( )
A.浓硫酸 B.饱和NaCl溶液
C.浓NaOH溶液 D.浓NaBr溶液
12.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列5 项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液; ⑤加过量的氯化钡溶液。下列正确的操作顺序是( )
A. ①④②⑤③ B. ⑤②①④③
C. ④①②⑤③ D. ②⑤④①③
13.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
A.只有①和②处 B.只有②处
C.只有②和③处 D.只有②③④处
14.在实验室利用浓盐酸和MnO2制氯气,制备装置中应安装分液漏斗而不能使用长颈漏斗,有关理由叙述错误的是( )
A.防止氯气扩散到空气中造成污染
B.便于控制加入盐酸的量
C.长颈漏斗不便于添加液体
D.尽量避免HCl挥发到空气中
15.下列反应都是用浓盐酸制Cl2,为制得等量Cl2,消耗盐酸最多的是( )
A.MnO2+4HClMnCl2+2H2O+Cl2↑
B.KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
C.KClO3+6HCl→KCl+3Cl2↑+3H2O
D.4HCl+O22H2O+2Cl2
16.已知甲和乙的某些性质如下表所示:
物质 熔点(℃) 沸点(℃) 密度(g/mL) 水中的溶解性
甲 -98 37.5 0.93 可溶
乙 -48 95 0.90 可溶
现有甲和乙的混合物,进行分离时,可采用的方法是( )
A.蒸发 B.蒸馏 C.过滤 D.萃取
17. A元素原子的L电子层比B元素的L 电子层少3个电子,B元素原子核外总电子数比A元素原子核外总电子数多5个 则A、B可形成( )
A.AB B.A2B C.B3A2 D.B2A3
18. 核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的量为( )
A. mol B. mol
C. (A-N+2)mol D. mol
19. 科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。下列4组物质:①Mg、O2 、N2、NO;②NaOH、Na2CO3、CH4、KCl;③H2CO3、H2SO4、NH3·H2O、H2SiO3;④CaO、SO2 、CO2、SiO2。从物质的基本分类看,每组中都有一种物质与其它物质不属于同一类,这4种物质分别是( )
A.Mg、Na2CO3、H2CO3、CaO B.O2、NaOH、H2SO4、SiO2
C.NO、CH4、NH3·H2O、CaO D.NO、KCl、H2SiO3、SO2
20.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
A.35Cl原子所含质子数为18
B.1 mol的1H35Cl分子所含中子数约为19×6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 L
D.35Cl2气体的摩尔质量为70 g·mol-1
21.元素X与Y组成A、B两种化合物,A中X的质量占,B中X的质量占,则化合物A和B的分子式分别是 ( )
A.XY和XY2 B.X2Y和X2Y3 C.XY2和X2Y D.XY3和X2Y4
22.20℃时有a g硫酸铜溶液V mL,将溶液蒸发掉b g水后恢复到20℃,恰好全部生成硫酸铜晶体(CuSO4·5H2O),则下列关系式错误的是( )
A.原硫酸铜溶液的密度为
B.生成硫酸铜晶体的物质的量为
C.原硫酸铜溶液的物质的量浓度为
D.原硫酸铜溶液的质量分数
二、理论题(本大题有4小题,共29分)
23.某元素M的原子核内质子数与中子数相等,它形成气态氢化物在标准状况下的密度是1.518g/L,该氢化物0.5mol充分燃烧,生成9g水,则M的元素符号为 ,原子序数是 ,原子结构示意图为 ,M的阴离子电子层结构与____________等微粒相同。
24.(1)用滴管将新制的饱和氯水逐滴滴入含酚酞的氢氧化钠的稀溶液中,当滴到最后一滴时,红色突然褪去。产生该现象的原因可能有两个:
①是由于__________________________________________________;
②是由于__________________________________________________。
用实验证明红色褪去的原因是①或者是②,其方法是:______________________
_______________________________________。
(2)在一定条件下氯气可与氯化铵发生反应:xCl2+yNH4Cl→yNCln+(x+y)HCl
当消耗6.72 L标准状况下的氯气时,生成0.10 mol氮的氯化物,则此氮的氯化物的化学式为________。
25.1811年法国化学家库特瓦用硫酸处理海藻灰时发现了碘。碘单质通常状况下为_______色固体,其制剂可用来消毒和治疗甲状腺肿。碘缺乏病是目前已知的导致人类智力障碍的主要原因,因此碘元素称作“智慧元素”。碘的单质有两种特性,一是物理特性:_____________________;二是化学特性:____________________________。
1824年法国化学家巴拉尔用氯气处理提取食盐后的盐水母液时发现了溴。溴元素的99%存在于海洋,称作“海洋元素”,其化合物可用作镇静剂。溴的原子序数为35,其原子结构简图为________________;溴化钠中存在的化学键是____________,在物理性质上表现出_______________________。氯化钠的电子式为_________,溴化钠的电离方程式为_________________ 。检验某固体试样中是否有Br-的方法为____________
_______________________________________________________。
26.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则该气体的物质的量为 mol,该气体所含原子总数为 个,在标准状况下该气体的体积为 L。若该气体不与水反应,将其溶于1L水中,所得溶液中溶质的质量分数为 ,该气体溶于水后形成VL溶液,其溶液的物质的量浓度为 mol/L。
三、实验题(本大题有3小题,共31分。其中第29题为分叉题,普通中学做29A,重点中学做29B)
27.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
(1) 从上述步骤中可知,海带中含有的碘元素的主要存在形式是 。
(2) 步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是 。
(3) 步骤④中的转化还可以Cl2或双氧水,请分别写出反应的离子方程式:
、 。
(4) 步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出
下列实验装置中的错误之处。
①
②
进行上述蒸馏操作时,使用水浴的
原因是 、
______________________________,
最后晶态碘在 里聚集。
28.某化学实验兴趣小组为探究实验室制备Cl2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略):
试回答下列问题:
(1) 下列方法中,可制得氯气的是________________。
① MnO2和浓盐酸混合共热 ② MnO2、NaCl和浓硫酸混合共热
③ 次氯酸钠和浓盐酸混合 ④ KClO3和浓盐酸混合共热
⑤ KMnO4和浓盐酸混合
(2) 若用含有0.2mol HCl 的浓盐酸与足量MnO2反应制取Cl2,制得的Cl2在标准状况下的体积总是小于1.12L的原因是___________________________________。
(3) ①装置B的作用是__________,现象是______________________________。
②装置C和D出现的不同现象说明的问题是___________________________________。
③装置E 的作用应该是___________________________________________。
④写出装置F中发生反应的离子方程式_______________________________。
(4)乙同学认为甲同学的实验有缺陷,不能确认最终通入AgNO3溶液中的气体只有一种,为了保证实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在______之间(填装置字母序号),装置中应加入_______________________。
29.(A)实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2) 比较制取氯酸钾和次氯酸钠的条件,二者的差异是:
反应完毕经冷却后,②的试管中有大量晶体析出。
右图中符合该晶体溶解度曲线的是
(填写编号字母);冷却后从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是 ,实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 原因
溶液最初从紫色逐渐变为 色 氯气与水反应生成的H+使石蕊变色
随后溶液逐渐变为无色
然后溶液从无色逐渐变为 色
29.(B)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的一种方法: 。
(2)将NaCl溶液电解,在电解槽中可直接得到的产品H2、 、 ,或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 _________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了解到如下装置:
请你参与分析讨论:
① 图中仪器B的名称: 。
② 整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________________
。
③ 实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
。
④ C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
四、计算题(本题为分叉题,普通中学做30A,重点中学做30B,共6分)
30.(A)使一定量的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第1支玻璃管中装有铜屑,第2支玻璃管中装有氧化铜,第1支玻璃管中由于发生如下反应:2PH3+CuCu3P2(s)+3H2,玻璃管中物质的质量增加4.96 g,第2支玻璃管中物质的质量减少了5.76 g。
(1)计算原混合气体中磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
30.(B)生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L标准状况下的该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuOCO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管中物质的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1) 试计算原混合气体中甲烷的物质的量。
(2) 原混合气体中氮气的体积分数为多少?
黄浦区2010学年度第一学期高三化学期终测试题
参考答案与评分要求
一、选择题(每小题只有1个正确选项,第1~10题每小题1分,第11~22题每小题2分,共34分)
1.D 2.B 3.A 4.D 5.C 6.C 7.A 8. A 9.B 10.C 11. B 12.D 13.D 14.C 15.A 16.B 17.C 18.A 19.C 20.D 21.D 22.C
二、理论题(本题共29分)
23.(每空1分,共4分)
S 16 P3-、 Cl-、Ar、K+、Ca2+(任选一种)
24.(9分)(1)①氯水中H+与碱中和(2分) ②氯水中HClO强氧化性所致(2分) 向褪色溶液中再滴加NaOH溶液,若红色再现,则是①;若红色不再现,则是②。(3分)
(2)NCl3(2分)
25.(11分,最后一空3分,其余每空1分)
紫黑 易升华,遇淀粉显蓝色 离子键
熔沸点较高、硬度较大(选答一点即给分) NaBr→Na+ + Br-
取固体试样少许用蒸馏水溶解(1分),再滴加硝酸酸化的硝酸银溶液(1分),若有浅黄色沉淀生成,则证实有Br-存在。(1分)
26.(5分,每空1分) ×100%
三、实验题(本大题有3题,共31分。其中第29题为分叉题,普通中学做29A,重点中学做29B)
27.(每空1分,共9分)
(1)有机碘(或化合态碘)(2)坩埚 、酒精灯、坩埚钳 (3)2I- +Cl2→I2+Cl- ,
2I -+H2O2+2H+→I2+2H2O (4)①温度计水银球位置没有放在蒸馏烧瓶的支管口
②冷凝管中的水流方向错误 ③加热时在烧杯上没有垫石棉网(可任选两点)
受热均匀;容易控制反应温度;反应温度低于100℃(可任选两点) 蒸馏烧瓶
28.(10分)(1)①②③④⑤(2分,不全面给1分)
(2)浓盐酸的浓度随反应的不断进行逐渐变稀,变稀后将不再反应 (1分)
(3)①证明有水蒸气产生(1分);白色固体变蓝色(1分)
②氯气无漂白性,次氯酸有漂白性(1分)
③吸收氯气(1分) ④Ag++Cl―→ AgCl↓(1分)
(4)E与F(1分) (5)碘化钾淀粉试液(1分)
29.(A)(12分,本题除已标注的2分外其余每空1分)
(1)分液漏斗 B
(2)碱溶液(或反应物)的浓度不同,反应温度不同(2分) M 过滤
(3)Cl2+2OH-→ClO-+Cl-+H2O (2分)
红
氯气与水反应生成的HClO将石蕊氧化为无色物质
黄绿 继续通入的氯气溶于水使溶液呈黄绿色
29.(B)(12分)
(1)蒸馏法,电渗析法,离子交换法等(1分,只要求1种方法)
(2)Cl2 NaOH,NaClO (2分) (3)富集溴元素 (1分)
(4)SO2 +Br2+2H2O → 4H++ 2Br-+SO42- (2分)
强酸对设备的严重腐蚀(1分)
(5)①冷凝管 (1分) ②Br2腐蚀橡胶(1分)
③控制温度计b的温度,并收集59℃时的馏分(1分)
④深红棕色;分液(或蒸馏)(2分)
四、计算题(本题为分叉题,普通中学做30A,重点中学做30B,共6分)
(每小题3分,要求有计算过程)
30(A).(1)
解法1.第2支试管中氧化铜失去的质量为氧元素,其物质的量是5.76/16=0.36 mol,与氧元素结合成H2O的是氢元素,相当于H2亦为0.36 mol。
第1支试管获得的质量是磷元素,其物质的量为4.96/31=0.16 mol,即原PH30.16 mol,它释放的H2为0.24 mol,原H2的物质的量则为0.36-0.24=0.12 mol。
故原混合气体中磷化氢和氢气的体积比 4∶3
解法2.2PH3 + 3Cu→Cu3P2(s)+3H2 增加的质量
68 6 62
m(PH3) m(H2) 4.96
解得:m(PH3) =5.44g,
解得:m(H2) =0.48g
H2+CuO→Cu+H2O 减少的质量
2 16
m(H2‘) 5.76g
解得:m(H2‘) =0.72g
即原来氢气的质量是0.72-0.48=0.24g,
n(PH3)==0.16mol,n(H2)==0.12mol
故磷化氢和氢气的体积比=磷化氢和氢气的物质的量之比=0.16∶0.12=4∶3
(2)原混合气体平均摩尔质量= =20.3g/mol
在标准状况下,原混合气体的密度==0.91g/L
30(B).
(1)硬质玻璃管中物质减少的质量为CuO中的氧的质量
n(CuO)= = 0.3mol
由化学方程式可知反应的CH4的物质的量为0.075mol。
(2)生成的CO2也为0.075mol
将气体通过澄清的石灰水生成8.5g沉淀,所以n(CO2)=0.085mol
原混合气体中的n(CO2)=0.01mol,气体的总物质的量= =0.09mol,
n(N2)=0.005mol,N2的体积分数= ×100%=5.56%。
2
8
6
+167
2
8
184
7
+35
同课章节目录
