鲁教版初中化学九年级上册第5单元《定量研究化学反应》单元测试题(解析版)
文档属性
| 名称 | 鲁教版初中化学九年级上册第5单元《定量研究化学反应》单元测试题(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 161.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-01-09 15:27:39 | ||
图片预览




文档简介
第5单元《定量研究化学反应》单元测试题
一、单选题(每小题只有一个正确答案)
1.化学用语是学习和交流化学知识的通用语言,以下化学符号所表示的意义最多的是( )
A.Fe B.H C.S2- D.2H2O
2.漂白粉在生活生产中有重要的应用。氯气和石灰乳反应制得漂白粉的化学方程式为 2Cl2+2Ca(OH)2=Ca(ClO)2+X+2H2O,其中X的化学式是( )
A.CaO B.CaH2 C.Ca(ClO2)2 D.CaCl2
3.“苏丹红”往往被不法分子添加到食品中。如果长期食用含该类物质的食品会增加人体患癌的危险性。其中“苏丹红一号”的化学式为C16H12ON2。对该物质的叙述正确的是( )
A.苏丹红一号是一种氧化物
B.苏丹红一号是一种有机化合物
C.苏丹红一号中氧元素的质量分数最小
D.苏丹红一号中碳元素和氮元素的质量比为8∶1
4.在化学变化中一定没有发生变化的是: ( )
①原子种类 ②分子种类 ③元素种类 ④原子数目 ⑤分子数目
A.② B.①②③④⑤ C.②⑤ D.①③④
5.镁带在耐高温的密闭容器中(内含空气)加热发生反应3Mg+N2Mg3N2,下列图中能正确表示容器里所盛物质总质量变化的是( )
A. B. C. D.
6.每年世界上都有成千上万的家庭发生火灾,如果知道一些家庭防火知识和紧急灭火措施,就能避免火灾,下列说法你认为不正确的是( )
A.电器着火应用水扑灭
B.及时更换老化破损电线,修理失灵电器
C.油锅中的油着火,可用锅盖盖灭
D.室内起火时不要急于打开门窗
7.下列叙述错误的是( )
A.绿色植物通过光合作用可以把太阳能转化为化学能
B.在化学反应X+3O22CO2+3H20中X的化学式为C2H6
C.房屋失火用水扑灭是为了将燃烧物的温度降低到着火点以下
D.钢铁厂用赤铁矿炼铁的主要原理为Fe2O3+3CO2Fe+3CO2
8.北京奥运火炬用的燃料是丙烷(C3H8),它燃烧时火苗高且亮。下列关于丙烷的叙述正确的是 ( )
①丙烷由碳、氢两种元素组成;②丙烷由丙烷分子构成;③丙烷分子由碳、氢两种元素组成;④丙烷由3个碳原子和8个氢原子组成;⑤丙烷分子由碳原子和氢原子构成
A.①②③④⑤ B.①②⑤ C.③④ D.①②④⑤
9.一个密闭容器中有四种物质,在一定的条件下发生反应,测得反应前后各物质的质量如下表所示。下列推理正确的是( )
A.Y一定是该反应的催化剂 B.该反应属于化合反应
C.反应后Q的质量为l0 g D.该反应中消耗X与Q的质量之比为4:11
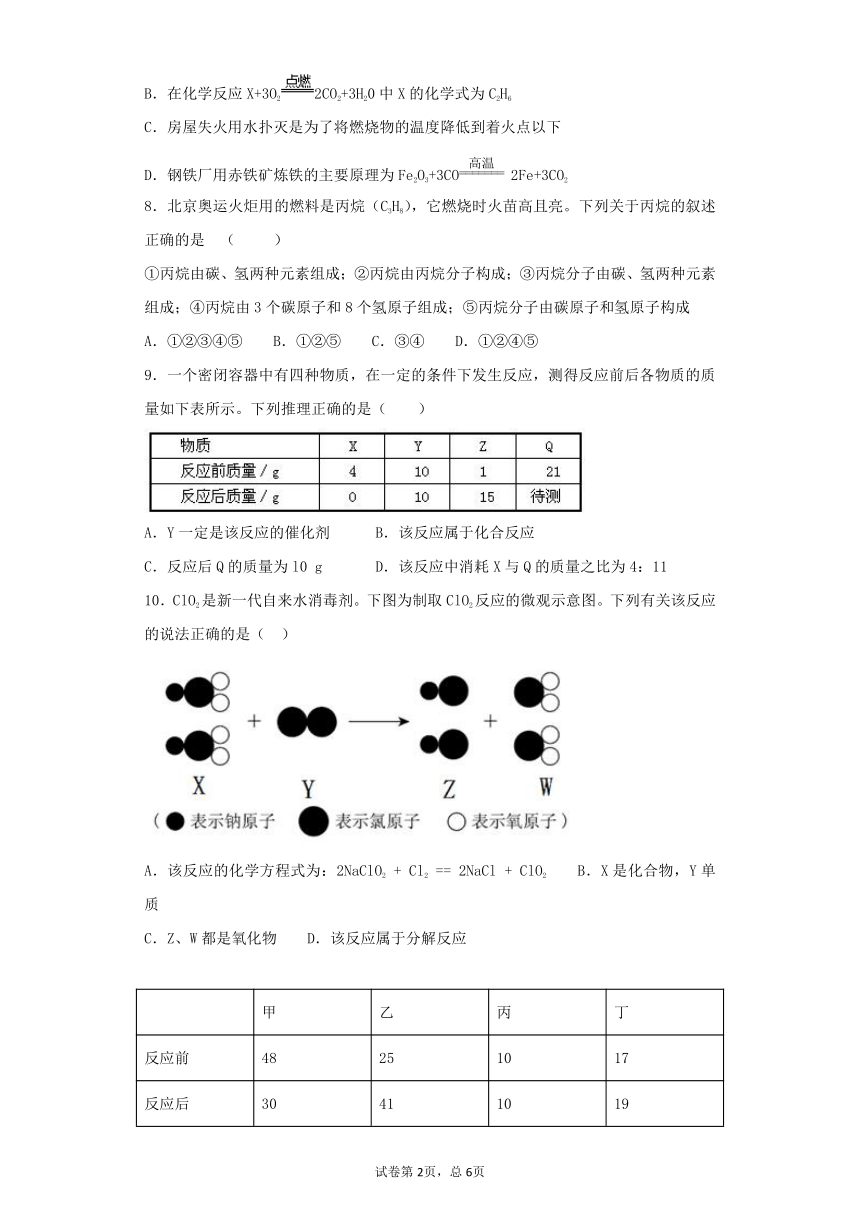
10.ClO2是新一代自来水消毒剂。下图为制取ClO2反应的微观示意图。下列有关该反应的说法正确的是( )
A.该反应的化学方程式为:2NaClO2 + Cl2 == 2NaCl + ClO2 B.X是化合物,Y单质
C.Z、W都是氧化物 D.该反应属于分解反应
甲 乙 丙 丁
反应前 48 25 10 17
反应后 30 41 10 19
12.在下图中,四位同学说的是关于同一个化学反应的内容,这个反应是( )
A.红磷在空气中燃烧 B.铁与硫酸铜溶液反应
C.二氧化碳与水反应 D.一氧化碳在氧气中燃烧
13.石墨烯是一种革命性材料,具有优异的光学、电学和力学特性。图为金刚石、石墨和石墨烯的结构模型图,图中小球代表碳原子。下列说法正确的是( )
①石墨烯是一种新型化合物
②三种物质分别在足量的氧气中完全燃烧的产物相同
③金刚石和石墨烯是组成相同但结构不同的两种物质
④石墨烯有超强的导电性和导热性,说明石墨烯的化学性质和金属相似
A.①④ B.②③ C.①③ D.②③④
14.下列化学方程式书写正确的是( )
A.P2+2.5O2P2O5 B.2Mg+CO22MgO+C
C.S+O2SO2↑ D.4Fe+3O22Fe2O3
二、填空题
15.由C、H、O、Na、四种元素组成的一种盐的化学式为_________________。
16.某电视节目中有个“土壤兄弟”,提倡人们不要随地乱丢废旧电池,你认为这样做的理由是________,还有个“空气兄弟”建议我们少开私家车,多乘坐公交车、骑自行车或步行,你认为这样做的理由是________;
实验室有两瓶标签破损的无色溶液,推知它们只能是碳酸钠溶液和硝酸钡溶液.某校兴趣小组的同学设计实验区分它们,请你参与实验,选择下列试剂进行区分,并回答有关问题.试剂:
①试纸 ②溶液 ③溶液 ④稀硫酸⑤溶液
所选试剂(填序号,每种方法只选择一种) 实验现象及结论
方法一 ________________ ________________
方法二 ________________ ________________
17.化学用语是最简明、信息丰富、国际通用的语言。
(1)用化学符号和有关数字表示:四个五氧化二磷分子________三个铵根离子 ________两个氦原子________
(2)指出下列化学符号中数字“2”的意义:2Cu________S2- ________________
18.配平下列化学方程式。
(1)____H2O2____H2O+____O2↑
(2)____ Fe+____O2____Fe3O4
(3)____C6H6+____O2____CO2+____H2O
(4)____Fe+____CuSO4===____Cu+____FeSO4[
(5)____H2O____H2↑+____O2↑
19.发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染。
(1)反应的化学方程式为:2N2H4+N2O43________+4_________,请在横线上将化学式补充完整。
(2)请计算9.6 kg N2H4完全燃烧需要助燃物N2O4的质量_________。
三、推断题
20.已知甲、乙、丙为初中化学常见的物质,且都含有地壳中含量最多的元素,甲,乙元素组成相同,且乙常温下为无色无味液体,丙为单质。
(1)写出甲转化为丙的化学方程式__________
(2)写出甲乙性质不同的原因____________
21.已知A、B、C、D、E、F六种物质间有下列转化关系:
(1)A+B→C+H2O (2)C+KOH→D↓(蓝色)+E
(3)B+Ba(NO3)2→F↓+HNO3写出这三个反应的化学方程式?
(1)________________________________________________
(2)________________________________________________
(3)________________________________________________
四、实验题
22.某化学兴趣小组的同学发现发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致,发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈 性.
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有 .
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式: .
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是 .
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表(只要求填写其中一行.若两行都写,按第一行计分):
实 验 操 作 预期实验现象 结 论
固体产物是Na2CO3,而不是NaOH.
固体产物是NaOH,而不是Na2CO3.
【小结】NaHCO3受热发生变化的化学方程式为 .
【拓展应用】
碳酸氢钠、碳酸钙、氢氧化镁等常用于制作抗酸药,用来治疗胃酸过多.但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠、碳酸钙等碳酸盐,其原因是 .
23.请仔细观察下图:
⑴ 把铝片放进硫酸铜溶液前,应进行的一个步骤是: ,为什么要进行这个步骤 ;
⑵ 相同质量的铝和铜,哪种物质所含的原子的个数多 ;
⑶ 请写出铝片放入硫酸铜溶液的化学方程式 ;
⑷ 反应前后的烧杯中有什么离子是没有改变的,请写出该离子的符号 ;
⑸ 试从微观粒子变化的角度分析该反应的实质是: 。
五、计算题
24.足量盐酸与350g碳酸钙反应,生成二氧化碳的质量是多少?
25.高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。现有20t贝壳,煅烧后质量减少了6.6t,请计算:
(1)碳酸钙中Ca、C、O元素的质量比为多少?
(2)可制得氧化钙的质量是多少?(假设其他成分不参加反应)
试卷第6页,总6页
参考答案
1.A
【解析】
【分析】
【详解】
A、Fe:微观:表示一个原子;宏观:1、表示一种物质;2、表示该物质的元素组成,故选项正确;B、H 表示氢元素或1个氢原子,故选项错误;C、S2-表示一个硫离子,故选项错误;D、2H2O 表示2个水分子,故选项错误。故选A。
【点睛】
分子构成的物质的化学式一般有4层含义:微观1、表示物质的一个分子;2、表示一个分子的构成,宏观:1、表示一种物质;2、表示该物质的元素组成。由原子构成的物质的化学式一般有3层含义:微观1、表示一个原子宏观:1、表示一种物质;2、表示该物质的元素组成。
2.D
【解析】据质量守恒定律可知,化学反应前后原子的种类、个数不变,反应前有4个氧原子、4个氯原子、 4个氢原子、2个钙原子,反应后有1个钙原子、 4个氢原子、4个氧原子、2个氯原子,所以一个X的分子中有2个氯原子、1个钙原子;X的化学式为CaCl2。故选D。
3.B
【解析】“苏丹红一号”的化学式为C16H12ON2。A、苏丹红一号是一种有机物,不是氧化物,氧化物只有两种元素组成,故A错误;B、苏丹红一号是一种有机化合物,故B正确;C、苏丹红一号中,碳氢氧氮质量比∶12×16∶12∶16∶14×2=48∶3∶4∶7,,氢元素的质量分数最小,故C错误;D、苏丹红一号中碳元素和氮元素的质量比为12×16∶14×2=48∶7,故D错误。
点睛∶⑴宏观意义①.表示一种物质;②表示该物质的元素组成;⑵微观意义①表示该物质的一个分子;②表示该物质的分子构成;⑶量的意义①表示物质的一个分子中各原子个数;②表示组成物质的各元素质量比。
4.D
【解析】在化学反应中,分子破裂成原子,原子重新排列组合生成新物质的过程,因此原子种类、原子数目、原子的质量及原子的相对原子质量一定不变,而在化学反应中生成新的物质,那么物质的种类或分子种类必然改变。而元素种类不变,各物质质量总和质量不变,可能改变的是分子数目。故选D。
5.C
【解析】
试题分析:镁和空气中的氧气反应生成氧化镁,随着镁和氧气的减少,氧化镁增多,减少的镁和氧气的质量之和等于生成的氧化镁的质量;镁和空气中的氮气反应生成氮化镁,随着镁和氮气的减少,氮化镁增多,减少的镁和氮气的质量之和等于生成的氮化镁的质量,因此容器中的总质量保持不变,C选项符合题意.故选:C.
考点:质量守恒定律及其应用
6.A
【解析】
试题分析:A、电器着火时,为了防止触电,应先切断电源,再用水扑灭;B、如不及时更换老化破损电线,修理失灵电器,电能转化成热能温度达到可燃物的着火点,引起火灾;C、油锅中的油着火时,盖上锅盖,可以隔绝氧气或空气,从而达到灭火的目的;D、室内起火时不能打开门窗,否则会使室内空气对流,反而为燃烧提供了大量的氧气.
考点:灭火的原理和方法.
7.B
【解析】
试题分析:A、光合作用的条件是光照,生成物是有机物和氧气,所以将太阳能转化为化学能,故A说法正确;B、根据反应前后各原子的种类和数目不变,可知X的化学式是C2H6O,故B说法错误;C、房屋失火用水扑灭时,水受热变为水蒸气,水汽化吸热,从而降低了温度,降到着火点以下,火就会熄灭,故C说法正确;D、反应物是氧化铁和一氧化碳,生成物是铁和二氧化碳,根据得失氧进行配平,反应条件是高温,所以方程式是:Fe2O3+3CO2Fe+3CO2,故D说法正确.故选B
考点:物质发生化学变化时的能量变化;铁的冶炼;质量守恒定律及其应用;灭火的原理和方法
8.B
【解析】丙烷(C3H8),①丙烷由碳、氢两种元素组成,故①正确;②丙烷由丙烷分子构成,故②正确;③丙烷分子由碳、氢两种原子构成,故③错误;④一个丙烷分子由3个碳原子和8个氢原子构成,故④错误;⑤丙烷分子由碳原子和氢原子构成,故⑤正确。故选B。
9.B
【解析】
试题分析:根据前后质量的变化判断是反应物还是生成物,X反应前是4g,反应后为0,质量减少了4g,是反应物,Z反应前是1g,反应后为15g,质量增加了14g,是生成物,而Y质量不变,根据质量守恒定律,可判断Q为反应物,且反应了的质量为14g-4g=10g,故反应可表示为:X+Q=Z,A、Y可能是该反应的催化剂,因为只是质量没变,但是否能改变化学反应速率不知道,错误,B、该反应属于化合反应,正确,C.反应后Q的质量=21g-10g=l1g,错误,D.该反应中消耗X与Q的质量之比为4:10,错误,故选B
考点:质量守恒定律
10.B
【解析】由制取ClO2反应的微观示意图中物质的微观构成可知,反应物是NaClO2和Cl2,生成物是NaCl和ClO2,反应的方程式是2NaClO2+Cl2═2NaCl+2ClO2,由此可知:A、该化学方程式未配平,错误;B、由以上分析可知X是NaClO2,由三种元素组成,属于化合物,Y是Cl2,属于单质;正确;C、Z是氯化钠,不含有氧元素,不是氧化物,错误;D、由上述分析可知,反应物是两种物质,不属于分解反应,错误。故选B。
点睛:根据构成物质的分子的微观模型图,可判断分子的构成,由分子的构成可确定物质的组成及物质的化学式,再写出反应的方程式,由方程式即可进行有关的分析和判断。
11.B
【解析】由四种物质反应前后各物质的质量可知,反应前后甲的质量减少了48-30=18,故甲是反应物;同理可以确定乙的质量增加了41-25=16,故乙是生成物;丙的质量不变,可能作该反应的催化剂,也可能是杂质没有参加反应;丁的质量增加了19-17=2,丁是生成物;该反应中乙、丁是生成物,甲质量减少,为反应物,符合“一变多”的特点,为分解反应。A、由分析可知:丁是生成物,可能是化合物,错误;B、参加反应的甲的质量一定等于生成的丁和乙的质量之和,正确;C、参加反应的物质的质量比为18:16:2,故不可能是碳酸钙的分解,错误;D、丙的质量不变,可能没有参加反应,也可能作该反应的催化剂,错误。故选B。
点睛:解题的关键是分析图中数据,灵活运用质量守恒定律。
12.D
【解析】试题分析:二氧化碳与水反应和铁与硫酸铜溶液反应不需要点燃,所以BC错误,红磷在空气中燃烧各种微粒的数目比是:4:5:2,所以A错误。故选D.
考点:化学方程式的意义
13.B
【解析】
①由结构模型图看出,石墨烯是一种单质,错误;②三种物质都是碳元素组成的单质,分别在足量的氧气中完全燃烧的产物都是二氧化碳,正确;③金刚石和石墨烯是组成相同但结构不同的两种物质,正确;④石墨烯有超强的导电性和导热性,说明石墨烯的物理性质和金属相似,错误。故选B。
14.B
15.NaHCO3
【解析】由两种或两种以上物质组成的物质叫混合物;由一种物质组成的物质叫纯净物;由一种元素组成的纯净物叫单质;由不同元素组成的纯净物叫化合物;由两种元素组成,且其中一种是氧的化合物叫氧化物。溶于水产生的阳离子只有氢离子的化合物是酸 。由金属或铵根和酸根组成的化合物叫盐,由金属或铵根和氢氧根组成的物质叫碱。所以由C、H、O、Na、四种元素组成的一种盐的化学式为NaHCO3。
16.防止废旧电池中的重金属等泄漏而造成土壤污染 减少由于汽车尾气的直接排放而造成的大气污染 ① 的是,的是 ③ 有白色沉淀的是,无现象的是
【解析】
【详解】
(1)随地乱丢废旧电池,废旧电池中的重金属等泄漏会造成土壤污染;少开私家车,多乘坐公交车、骑自行车或步行,可以减少由于汽车尾气的直接排放而造成的大气污染;
(2)
方法一:碳酸钠溶液显碱性,硝酸钡溶液显中性,故可用选用①pH试纸进行鉴别,的是,的是;
方法二:碳酸根离子可以和钙离子结合生成白色沉淀碳酸钙,而硝酸钡不和钙离子反应,故可选用③溶液进行鉴别,有白色沉淀的是,无现象的是。
17.4P2O5 3NH4+ 2He 铜原子的个数为2个 一个硫离子带2个单位的负电荷 氧在水中显+2价
【解析】
【详解】
(1)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则4个五氧化二磷分子可表示为:4P2O5;由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略;若表示多个该离子,就在其离子符号前加上相应的数字,故3个铵根离子可表示为:3NH4+;表示原子个数或分子个数的方法是在元素符号或化学式前面直接加数字,故两个氦原子的符号为2He;
(2)根据标在元素符号前面的数字表示原子的个数,故2Cu中的2表示铜原子的个数为2个;根据标在元素符号右上角的数字表示离子所带的电荷数,故S2-中的2表示一个硫离子带2个单位的负电荷;元素的化合价的正确标法是在元素符号或原子团符号的正上方标明化合价的种类和价目,故中的2表示氧在水中显+2价。
18.2 2 13 2 12151261111221
【解析】
【详解】
(1)利用最小公倍数法进行配平,以氧原子作为配平的起点,氧气、水前面的化学计量数分别为:1、2,最后调整过氧化氢前面的化学计量数为2;(2)利用最小公倍数法进行配平,以氧原子作为配平的起点,氧气、四氧化三铁前面的化学计量数分别为:1、2,最后调整铁前面的化学计量数为3;(3)本题可利用“定一法”进行配平,把C6H6的化学计量数定为1,则氧气、二氧化碳、水前面的化学计量数分别为:、6、3,各化学计量数都乘以2,所以各物质前的计量数分别为:2、15、12、6;(4)本题可利用“定一法”进行配平,把CuSO4的化学计量数定为1,则其它三种物质前面的化学计量数分别为:1、1、1;(5)利用最小公倍数法进行配平,以氧原子作为配平的起点,氧气、水前面的化学计量数分别为:1、2,最后调整氢气前面的化学计量数为2。
【点睛】
配平时化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数,配平过程中若出现分数,必须把分数去分母转化为整数。
19.N2H2O13.8 kg
【解析】
【详解】
根据题意及反应前后元素种类不变,反应的化学方程式为:2N2H4+N2O43N2+4H2O。(2)设9.6kgN2H4完全燃烧需要助燃物N2O4的质量是x
=,解得x=13.8gkg
20略
21. CuO+H2SO4=CuSO4 +H2O CuSO4 +2KOH =Cu(OH)2 ↓ +K2SO4 ; H2SO4+Ba(NO3)2=BaSO4↓+HNO3
【解析】根据已有的知识进行分析,D是蓝色沉淀,则D是氢氧化铜,C中含有铜离子,E中含有钾离子;B和F反应生成硝酸则B是一种酸,生成的F不溶于稀硝酸,说明是硫酸钡,故B是硫酸;A和B能反应生成C和水,则C中含有硫酸根离子,据此解答即可。B+Ba(NO3)2→F↓+HNO3,说明B中含有氢离子,生成的F是不溶于稀硝酸的白色沉淀,则F是硫酸钡,说明B是硫酸;C+KOH→D↓(蓝色)+E,D是蓝色沉淀,说明D是氢氧化铜,C中含有铜离子,E中含有钾离子;A+B→C+H2O,B是硫酸,且C中含有铜离子,则C是硫酸铜,故A可能是氧化铜,E是硫酸钾,代入题干,推断合理。(1)CuO+H2SO4=CuSO4+H2O;(2)CuSO4 +2KOH=Cu(OH)2 ↓ +K2SO4;(3)H2SO4+Ba(NO3)2=BaSO4↓+HNO3。
点睛:完成此题,关键是找准解题的突破口,直接得出有关物质的化学式,然后根据物质的性质及其相互间的反应,推断得出其它物质的化学式。
22.实验一:碱;
实验二:(1)水珠;
(2)Ca(OH)2+CO2=CaCO3↓+H2O;
(3)①质量守恒定律.
②
实 验 操 作 预期现象 结 论
向固体中加入足量的稀盐酸 产生大量气泡 固体产物是Na2CO3,而不是NaOH
向固体中加入足量的稀盐酸 没有气泡产生 固体产物是NaOH,而不是Na2CO3
2NaHCO3==Na2CO3+CO2↑+H2O
(4)碳酸盐与胃酸(或HCl)反应生成二氧化碳气体,可能会加重胃溃疡病情.
【解析】实验一:用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈碱性.故填:碱.
实验二:(1)加热一段时间后,观察到烧杯内壁有水珠.故填:水珠.
(2)氢氧化钙和二氧化碳反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)①兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3的依据是质量守恒定律.故填:质量守恒定律.
②碳酸钠和稀盐酸反应能生成氯化钠、水和二氧化碳,氢氧化钠稀盐酸反应能生成氯化钠和水.
实 验 操 作 预期现象 结 论
向固体中加入足量的稀盐酸 产生大量气泡 固体产物是Na2CO3,而不是NaOH
向固体中加入足量的稀盐酸 没有气泡产生 固体产物是NaOH,而不是Na2CO3
碳酸氢钠在加热条件下反应生成碳酸钠、水和二氧化碳.
该反应的化学方程式为:2NaHCO3==Na2CO3+CO2↑+H2O.
(4)碳酸盐与酸反应能生成二氧化碳气体,生成的二氧化碳使胃中气压增大,可能引起胃穿孔,加大病情,所以本题答案为:碳酸盐与胃酸(或HCl)反应生成二氧化碳气体,可能会加重胃溃疡病情.
23.(1)打磨铝片(1分), 除去氧化膜(1分);
(2)Al;(1分)
(3)2Al + 3CuSO4 == Al2(SO4)3 + 3Cu; (2分)
(4)SO42-;(1分)
(5)铝原子变为离子,铜离子变为原子。(1分)
【解析】(1)由于铝容易在表面形成氧化铝的保护膜,所以为防止铝与硫酸铜反应受阻应在反应前除掉氧化铝的保护膜;
(2)由于原子的质量与其相对原子质量成正比,而铝的相对原子质量小于铜的相对原子质量,所以相同质量的铝和铜,哪种物质所含的原子的个数多的是铝;
(3)铝的活动性比铜强,所以铝能置换出硫酸铜中的铜并生成硫酸铝,其方程式为:2Al+3CuSO4═Al2(SO4)3+3Cu;
(4)根据反应的方程式2Al+3CuSO4═Al2(SO4)3+3Cu可知反应前溶液中含有铜离子和硫酸根离子,反应后溶液中存在铝离子和硫酸根离子,因此不变的离子是硫酸根离子;
(5)从反应前后原子与离子的变化可知该反应的实质是铝原子变为离子,铜离子变为原子.
24.154g
【解析】利用化学方程式,根据二氧化碳与碳酸钙反应的质量比即可计算出生成的二氧化碳的质量。
设生成的二氧化碳的质量为x;
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
350g x
x=154g
答:生成二氧化碳的质量为154g。
25.(1)10:3:12 (2)8.4t
【解析】(1)根据碳酸钙的化学式计算;(2)根据生成二氧化碳的质量结合反应的化学方程式求解生成氧化钙的质量。(1)碳酸钙的化学式为CaCO3。碳酸钙中Ca、C、O元素的质量比为40:12:(16×3)=10:3:12;
(2)设可制得氧化钙的质量为x。
CaCO3高温CaO+CO2↑
56 44
x 6.6t
x=8.4t
答:(1)碳酸钙中Ca、C、O元素的质量比为10:3:12;(2)可制得氧化钙的质量是8.4t。
一、单选题(每小题只有一个正确答案)
1.化学用语是学习和交流化学知识的通用语言,以下化学符号所表示的意义最多的是( )
A.Fe B.H C.S2- D.2H2O
2.漂白粉在生活生产中有重要的应用。氯气和石灰乳反应制得漂白粉的化学方程式为 2Cl2+2Ca(OH)2=Ca(ClO)2+X+2H2O,其中X的化学式是( )
A.CaO B.CaH2 C.Ca(ClO2)2 D.CaCl2
3.“苏丹红”往往被不法分子添加到食品中。如果长期食用含该类物质的食品会增加人体患癌的危险性。其中“苏丹红一号”的化学式为C16H12ON2。对该物质的叙述正确的是( )
A.苏丹红一号是一种氧化物
B.苏丹红一号是一种有机化合物
C.苏丹红一号中氧元素的质量分数最小
D.苏丹红一号中碳元素和氮元素的质量比为8∶1
4.在化学变化中一定没有发生变化的是: ( )
①原子种类 ②分子种类 ③元素种类 ④原子数目 ⑤分子数目
A.② B.①②③④⑤ C.②⑤ D.①③④
5.镁带在耐高温的密闭容器中(内含空气)加热发生反应3Mg+N2Mg3N2,下列图中能正确表示容器里所盛物质总质量变化的是( )
A. B. C. D.
6.每年世界上都有成千上万的家庭发生火灾,如果知道一些家庭防火知识和紧急灭火措施,就能避免火灾,下列说法你认为不正确的是( )
A.电器着火应用水扑灭
B.及时更换老化破损电线,修理失灵电器
C.油锅中的油着火,可用锅盖盖灭
D.室内起火时不要急于打开门窗
7.下列叙述错误的是( )
A.绿色植物通过光合作用可以把太阳能转化为化学能
B.在化学反应X+3O22CO2+3H20中X的化学式为C2H6
C.房屋失火用水扑灭是为了将燃烧物的温度降低到着火点以下
D.钢铁厂用赤铁矿炼铁的主要原理为Fe2O3+3CO2Fe+3CO2
8.北京奥运火炬用的燃料是丙烷(C3H8),它燃烧时火苗高且亮。下列关于丙烷的叙述正确的是 ( )
①丙烷由碳、氢两种元素组成;②丙烷由丙烷分子构成;③丙烷分子由碳、氢两种元素组成;④丙烷由3个碳原子和8个氢原子组成;⑤丙烷分子由碳原子和氢原子构成
A.①②③④⑤ B.①②⑤ C.③④ D.①②④⑤
9.一个密闭容器中有四种物质,在一定的条件下发生反应,测得反应前后各物质的质量如下表所示。下列推理正确的是( )
A.Y一定是该反应的催化剂 B.该反应属于化合反应
C.反应后Q的质量为l0 g D.该反应中消耗X与Q的质量之比为4:11
10.ClO2是新一代自来水消毒剂。下图为制取ClO2反应的微观示意图。下列有关该反应的说法正确的是( )
A.该反应的化学方程式为:2NaClO2 + Cl2 == 2NaCl + ClO2 B.X是化合物,Y单质
C.Z、W都是氧化物 D.该反应属于分解反应
甲 乙 丙 丁
反应前 48 25 10 17
反应后 30 41 10 19
12.在下图中,四位同学说的是关于同一个化学反应的内容,这个反应是( )
A.红磷在空气中燃烧 B.铁与硫酸铜溶液反应
C.二氧化碳与水反应 D.一氧化碳在氧气中燃烧
13.石墨烯是一种革命性材料,具有优异的光学、电学和力学特性。图为金刚石、石墨和石墨烯的结构模型图,图中小球代表碳原子。下列说法正确的是( )
①石墨烯是一种新型化合物
②三种物质分别在足量的氧气中完全燃烧的产物相同
③金刚石和石墨烯是组成相同但结构不同的两种物质
④石墨烯有超强的导电性和导热性,说明石墨烯的化学性质和金属相似
A.①④ B.②③ C.①③ D.②③④
14.下列化学方程式书写正确的是( )
A.P2+2.5O2P2O5 B.2Mg+CO22MgO+C
C.S+O2SO2↑ D.4Fe+3O22Fe2O3
二、填空题
15.由C、H、O、Na、四种元素组成的一种盐的化学式为_________________。
16.某电视节目中有个“土壤兄弟”,提倡人们不要随地乱丢废旧电池,你认为这样做的理由是________,还有个“空气兄弟”建议我们少开私家车,多乘坐公交车、骑自行车或步行,你认为这样做的理由是________;
实验室有两瓶标签破损的无色溶液,推知它们只能是碳酸钠溶液和硝酸钡溶液.某校兴趣小组的同学设计实验区分它们,请你参与实验,选择下列试剂进行区分,并回答有关问题.试剂:
①试纸 ②溶液 ③溶液 ④稀硫酸⑤溶液
所选试剂(填序号,每种方法只选择一种) 实验现象及结论
方法一 ________________ ________________
方法二 ________________ ________________
17.化学用语是最简明、信息丰富、国际通用的语言。
(1)用化学符号和有关数字表示:四个五氧化二磷分子________三个铵根离子 ________两个氦原子________
(2)指出下列化学符号中数字“2”的意义:2Cu________S2- ________________
18.配平下列化学方程式。
(1)____H2O2____H2O+____O2↑
(2)____ Fe+____O2____Fe3O4
(3)____C6H6+____O2____CO2+____H2O
(4)____Fe+____CuSO4===____Cu+____FeSO4[
(5)____H2O____H2↑+____O2↑
19.发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染。
(1)反应的化学方程式为:2N2H4+N2O43________+4_________,请在横线上将化学式补充完整。
(2)请计算9.6 kg N2H4完全燃烧需要助燃物N2O4的质量_________。
三、推断题
20.已知甲、乙、丙为初中化学常见的物质,且都含有地壳中含量最多的元素,甲,乙元素组成相同,且乙常温下为无色无味液体,丙为单质。
(1)写出甲转化为丙的化学方程式__________
(2)写出甲乙性质不同的原因____________
21.已知A、B、C、D、E、F六种物质间有下列转化关系:
(1)A+B→C+H2O (2)C+KOH→D↓(蓝色)+E
(3)B+Ba(NO3)2→F↓+HNO3写出这三个反应的化学方程式?
(1)________________________________________________
(2)________________________________________________
(3)________________________________________________
四、实验题
22.某化学兴趣小组的同学发现发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致,发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈 性.
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有 .
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式: .
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是 .
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表(只要求填写其中一行.若两行都写,按第一行计分):
实 验 操 作 预期实验现象 结 论
固体产物是Na2CO3,而不是NaOH.
固体产物是NaOH,而不是Na2CO3.
【小结】NaHCO3受热发生变化的化学方程式为 .
【拓展应用】
碳酸氢钠、碳酸钙、氢氧化镁等常用于制作抗酸药,用来治疗胃酸过多.但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸过多时,却不宜服用碳酸氢钠、碳酸钙等碳酸盐,其原因是 .
23.请仔细观察下图:
⑴ 把铝片放进硫酸铜溶液前,应进行的一个步骤是: ,为什么要进行这个步骤 ;
⑵ 相同质量的铝和铜,哪种物质所含的原子的个数多 ;
⑶ 请写出铝片放入硫酸铜溶液的化学方程式 ;
⑷ 反应前后的烧杯中有什么离子是没有改变的,请写出该离子的符号 ;
⑸ 试从微观粒子变化的角度分析该反应的实质是: 。
五、计算题
24.足量盐酸与350g碳酸钙反应,生成二氧化碳的质量是多少?
25.高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。现有20t贝壳,煅烧后质量减少了6.6t,请计算:
(1)碳酸钙中Ca、C、O元素的质量比为多少?
(2)可制得氧化钙的质量是多少?(假设其他成分不参加反应)
试卷第6页,总6页
参考答案
1.A
【解析】
【分析】
【详解】
A、Fe:微观:表示一个原子;宏观:1、表示一种物质;2、表示该物质的元素组成,故选项正确;B、H 表示氢元素或1个氢原子,故选项错误;C、S2-表示一个硫离子,故选项错误;D、2H2O 表示2个水分子,故选项错误。故选A。
【点睛】
分子构成的物质的化学式一般有4层含义:微观1、表示物质的一个分子;2、表示一个分子的构成,宏观:1、表示一种物质;2、表示该物质的元素组成。由原子构成的物质的化学式一般有3层含义:微观1、表示一个原子宏观:1、表示一种物质;2、表示该物质的元素组成。
2.D
【解析】据质量守恒定律可知,化学反应前后原子的种类、个数不变,反应前有4个氧原子、4个氯原子、 4个氢原子、2个钙原子,反应后有1个钙原子、 4个氢原子、4个氧原子、2个氯原子,所以一个X的分子中有2个氯原子、1个钙原子;X的化学式为CaCl2。故选D。
3.B
【解析】“苏丹红一号”的化学式为C16H12ON2。A、苏丹红一号是一种有机物,不是氧化物,氧化物只有两种元素组成,故A错误;B、苏丹红一号是一种有机化合物,故B正确;C、苏丹红一号中,碳氢氧氮质量比∶12×16∶12∶16∶14×2=48∶3∶4∶7,,氢元素的质量分数最小,故C错误;D、苏丹红一号中碳元素和氮元素的质量比为12×16∶14×2=48∶7,故D错误。
点睛∶⑴宏观意义①.表示一种物质;②表示该物质的元素组成;⑵微观意义①表示该物质的一个分子;②表示该物质的分子构成;⑶量的意义①表示物质的一个分子中各原子个数;②表示组成物质的各元素质量比。
4.D
【解析】在化学反应中,分子破裂成原子,原子重新排列组合生成新物质的过程,因此原子种类、原子数目、原子的质量及原子的相对原子质量一定不变,而在化学反应中生成新的物质,那么物质的种类或分子种类必然改变。而元素种类不变,各物质质量总和质量不变,可能改变的是分子数目。故选D。
5.C
【解析】
试题分析:镁和空气中的氧气反应生成氧化镁,随着镁和氧气的减少,氧化镁增多,减少的镁和氧气的质量之和等于生成的氧化镁的质量;镁和空气中的氮气反应生成氮化镁,随着镁和氮气的减少,氮化镁增多,减少的镁和氮气的质量之和等于生成的氮化镁的质量,因此容器中的总质量保持不变,C选项符合题意.故选:C.
考点:质量守恒定律及其应用
6.A
【解析】
试题分析:A、电器着火时,为了防止触电,应先切断电源,再用水扑灭;B、如不及时更换老化破损电线,修理失灵电器,电能转化成热能温度达到可燃物的着火点,引起火灾;C、油锅中的油着火时,盖上锅盖,可以隔绝氧气或空气,从而达到灭火的目的;D、室内起火时不能打开门窗,否则会使室内空气对流,反而为燃烧提供了大量的氧气.
考点:灭火的原理和方法.
7.B
【解析】
试题分析:A、光合作用的条件是光照,生成物是有机物和氧气,所以将太阳能转化为化学能,故A说法正确;B、根据反应前后各原子的种类和数目不变,可知X的化学式是C2H6O,故B说法错误;C、房屋失火用水扑灭时,水受热变为水蒸气,水汽化吸热,从而降低了温度,降到着火点以下,火就会熄灭,故C说法正确;D、反应物是氧化铁和一氧化碳,生成物是铁和二氧化碳,根据得失氧进行配平,反应条件是高温,所以方程式是:Fe2O3+3CO2Fe+3CO2,故D说法正确.故选B
考点:物质发生化学变化时的能量变化;铁的冶炼;质量守恒定律及其应用;灭火的原理和方法
8.B
【解析】丙烷(C3H8),①丙烷由碳、氢两种元素组成,故①正确;②丙烷由丙烷分子构成,故②正确;③丙烷分子由碳、氢两种原子构成,故③错误;④一个丙烷分子由3个碳原子和8个氢原子构成,故④错误;⑤丙烷分子由碳原子和氢原子构成,故⑤正确。故选B。
9.B
【解析】
试题分析:根据前后质量的变化判断是反应物还是生成物,X反应前是4g,反应后为0,质量减少了4g,是反应物,Z反应前是1g,反应后为15g,质量增加了14g,是生成物,而Y质量不变,根据质量守恒定律,可判断Q为反应物,且反应了的质量为14g-4g=10g,故反应可表示为:X+Q=Z,A、Y可能是该反应的催化剂,因为只是质量没变,但是否能改变化学反应速率不知道,错误,B、该反应属于化合反应,正确,C.反应后Q的质量=21g-10g=l1g,错误,D.该反应中消耗X与Q的质量之比为4:10,错误,故选B
考点:质量守恒定律
10.B
【解析】由制取ClO2反应的微观示意图中物质的微观构成可知,反应物是NaClO2和Cl2,生成物是NaCl和ClO2,反应的方程式是2NaClO2+Cl2═2NaCl+2ClO2,由此可知:A、该化学方程式未配平,错误;B、由以上分析可知X是NaClO2,由三种元素组成,属于化合物,Y是Cl2,属于单质;正确;C、Z是氯化钠,不含有氧元素,不是氧化物,错误;D、由上述分析可知,反应物是两种物质,不属于分解反应,错误。故选B。
点睛:根据构成物质的分子的微观模型图,可判断分子的构成,由分子的构成可确定物质的组成及物质的化学式,再写出反应的方程式,由方程式即可进行有关的分析和判断。
11.B
【解析】由四种物质反应前后各物质的质量可知,反应前后甲的质量减少了48-30=18,故甲是反应物;同理可以确定乙的质量增加了41-25=16,故乙是生成物;丙的质量不变,可能作该反应的催化剂,也可能是杂质没有参加反应;丁的质量增加了19-17=2,丁是生成物;该反应中乙、丁是生成物,甲质量减少,为反应物,符合“一变多”的特点,为分解反应。A、由分析可知:丁是生成物,可能是化合物,错误;B、参加反应的甲的质量一定等于生成的丁和乙的质量之和,正确;C、参加反应的物质的质量比为18:16:2,故不可能是碳酸钙的分解,错误;D、丙的质量不变,可能没有参加反应,也可能作该反应的催化剂,错误。故选B。
点睛:解题的关键是分析图中数据,灵活运用质量守恒定律。
12.D
【解析】试题分析:二氧化碳与水反应和铁与硫酸铜溶液反应不需要点燃,所以BC错误,红磷在空气中燃烧各种微粒的数目比是:4:5:2,所以A错误。故选D.
考点:化学方程式的意义
13.B
【解析】
①由结构模型图看出,石墨烯是一种单质,错误;②三种物质都是碳元素组成的单质,分别在足量的氧气中完全燃烧的产物都是二氧化碳,正确;③金刚石和石墨烯是组成相同但结构不同的两种物质,正确;④石墨烯有超强的导电性和导热性,说明石墨烯的物理性质和金属相似,错误。故选B。
14.B
15.NaHCO3
【解析】由两种或两种以上物质组成的物质叫混合物;由一种物质组成的物质叫纯净物;由一种元素组成的纯净物叫单质;由不同元素组成的纯净物叫化合物;由两种元素组成,且其中一种是氧的化合物叫氧化物。溶于水产生的阳离子只有氢离子的化合物是酸 。由金属或铵根和酸根组成的化合物叫盐,由金属或铵根和氢氧根组成的物质叫碱。所以由C、H、O、Na、四种元素组成的一种盐的化学式为NaHCO3。
16.防止废旧电池中的重金属等泄漏而造成土壤污染 减少由于汽车尾气的直接排放而造成的大气污染 ① 的是,的是 ③ 有白色沉淀的是,无现象的是
【解析】
【详解】
(1)随地乱丢废旧电池,废旧电池中的重金属等泄漏会造成土壤污染;少开私家车,多乘坐公交车、骑自行车或步行,可以减少由于汽车尾气的直接排放而造成的大气污染;
(2)
方法一:碳酸钠溶液显碱性,硝酸钡溶液显中性,故可用选用①pH试纸进行鉴别,的是,的是;
方法二:碳酸根离子可以和钙离子结合生成白色沉淀碳酸钙,而硝酸钡不和钙离子反应,故可选用③溶液进行鉴别,有白色沉淀的是,无现象的是。
17.4P2O5 3NH4+ 2He 铜原子的个数为2个 一个硫离子带2个单位的负电荷 氧在水中显+2价
【解析】
【详解】
(1)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则4个五氧化二磷分子可表示为:4P2O5;由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略;若表示多个该离子,就在其离子符号前加上相应的数字,故3个铵根离子可表示为:3NH4+;表示原子个数或分子个数的方法是在元素符号或化学式前面直接加数字,故两个氦原子的符号为2He;
(2)根据标在元素符号前面的数字表示原子的个数,故2Cu中的2表示铜原子的个数为2个;根据标在元素符号右上角的数字表示离子所带的电荷数,故S2-中的2表示一个硫离子带2个单位的负电荷;元素的化合价的正确标法是在元素符号或原子团符号的正上方标明化合价的种类和价目,故中的2表示氧在水中显+2价。
18.2 2 13 2 12151261111221
【解析】
【详解】
(1)利用最小公倍数法进行配平,以氧原子作为配平的起点,氧气、水前面的化学计量数分别为:1、2,最后调整过氧化氢前面的化学计量数为2;(2)利用最小公倍数法进行配平,以氧原子作为配平的起点,氧气、四氧化三铁前面的化学计量数分别为:1、2,最后调整铁前面的化学计量数为3;(3)本题可利用“定一法”进行配平,把C6H6的化学计量数定为1,则氧气、二氧化碳、水前面的化学计量数分别为:、6、3,各化学计量数都乘以2,所以各物质前的计量数分别为:2、15、12、6;(4)本题可利用“定一法”进行配平,把CuSO4的化学计量数定为1,则其它三种物质前面的化学计量数分别为:1、1、1;(5)利用最小公倍数法进行配平,以氧原子作为配平的起点,氧气、水前面的化学计量数分别为:1、2,最后调整氢气前面的化学计量数为2。
【点睛】
配平时化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数,配平过程中若出现分数,必须把分数去分母转化为整数。
19.N2H2O13.8 kg
【解析】
【详解】
根据题意及反应前后元素种类不变,反应的化学方程式为:2N2H4+N2O43N2+4H2O。(2)设9.6kgN2H4完全燃烧需要助燃物N2O4的质量是x
=,解得x=13.8gkg
20略
21. CuO+H2SO4=CuSO4 +H2O CuSO4 +2KOH =Cu(OH)2 ↓ +K2SO4 ; H2SO4+Ba(NO3)2=BaSO4↓+HNO3
【解析】根据已有的知识进行分析,D是蓝色沉淀,则D是氢氧化铜,C中含有铜离子,E中含有钾离子;B和F反应生成硝酸则B是一种酸,生成的F不溶于稀硝酸,说明是硫酸钡,故B是硫酸;A和B能反应生成C和水,则C中含有硫酸根离子,据此解答即可。B+Ba(NO3)2→F↓+HNO3,说明B中含有氢离子,生成的F是不溶于稀硝酸的白色沉淀,则F是硫酸钡,说明B是硫酸;C+KOH→D↓(蓝色)+E,D是蓝色沉淀,说明D是氢氧化铜,C中含有铜离子,E中含有钾离子;A+B→C+H2O,B是硫酸,且C中含有铜离子,则C是硫酸铜,故A可能是氧化铜,E是硫酸钾,代入题干,推断合理。(1)CuO+H2SO4=CuSO4+H2O;(2)CuSO4 +2KOH=Cu(OH)2 ↓ +K2SO4;(3)H2SO4+Ba(NO3)2=BaSO4↓+HNO3。
点睛:完成此题,关键是找准解题的突破口,直接得出有关物质的化学式,然后根据物质的性质及其相互间的反应,推断得出其它物质的化学式。
22.实验一:碱;
实验二:(1)水珠;
(2)Ca(OH)2+CO2=CaCO3↓+H2O;
(3)①质量守恒定律.
②
实 验 操 作 预期现象 结 论
向固体中加入足量的稀盐酸 产生大量气泡 固体产物是Na2CO3,而不是NaOH
向固体中加入足量的稀盐酸 没有气泡产生 固体产物是NaOH,而不是Na2CO3
2NaHCO3==Na2CO3+CO2↑+H2O
(4)碳酸盐与胃酸(或HCl)反应生成二氧化碳气体,可能会加重胃溃疡病情.
【解析】实验一:用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈碱性.故填:碱.
实验二:(1)加热一段时间后,观察到烧杯内壁有水珠.故填:水珠.
(2)氢氧化钙和二氧化碳反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)①兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3的依据是质量守恒定律.故填:质量守恒定律.
②碳酸钠和稀盐酸反应能生成氯化钠、水和二氧化碳,氢氧化钠稀盐酸反应能生成氯化钠和水.
实 验 操 作 预期现象 结 论
向固体中加入足量的稀盐酸 产生大量气泡 固体产物是Na2CO3,而不是NaOH
向固体中加入足量的稀盐酸 没有气泡产生 固体产物是NaOH,而不是Na2CO3
碳酸氢钠在加热条件下反应生成碳酸钠、水和二氧化碳.
该反应的化学方程式为:2NaHCO3==Na2CO3+CO2↑+H2O.
(4)碳酸盐与酸反应能生成二氧化碳气体,生成的二氧化碳使胃中气压增大,可能引起胃穿孔,加大病情,所以本题答案为:碳酸盐与胃酸(或HCl)反应生成二氧化碳气体,可能会加重胃溃疡病情.
23.(1)打磨铝片(1分), 除去氧化膜(1分);
(2)Al;(1分)
(3)2Al + 3CuSO4 == Al2(SO4)3 + 3Cu; (2分)
(4)SO42-;(1分)
(5)铝原子变为离子,铜离子变为原子。(1分)
【解析】(1)由于铝容易在表面形成氧化铝的保护膜,所以为防止铝与硫酸铜反应受阻应在反应前除掉氧化铝的保护膜;
(2)由于原子的质量与其相对原子质量成正比,而铝的相对原子质量小于铜的相对原子质量,所以相同质量的铝和铜,哪种物质所含的原子的个数多的是铝;
(3)铝的活动性比铜强,所以铝能置换出硫酸铜中的铜并生成硫酸铝,其方程式为:2Al+3CuSO4═Al2(SO4)3+3Cu;
(4)根据反应的方程式2Al+3CuSO4═Al2(SO4)3+3Cu可知反应前溶液中含有铜离子和硫酸根离子,反应后溶液中存在铝离子和硫酸根离子,因此不变的离子是硫酸根离子;
(5)从反应前后原子与离子的变化可知该反应的实质是铝原子变为离子,铜离子变为原子.
24.154g
【解析】利用化学方程式,根据二氧化碳与碳酸钙反应的质量比即可计算出生成的二氧化碳的质量。
设生成的二氧化碳的质量为x;
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
350g x
x=154g
答:生成二氧化碳的质量为154g。
25.(1)10:3:12 (2)8.4t
【解析】(1)根据碳酸钙的化学式计算;(2)根据生成二氧化碳的质量结合反应的化学方程式求解生成氧化钙的质量。(1)碳酸钙的化学式为CaCO3。碳酸钙中Ca、C、O元素的质量比为40:12:(16×3)=10:3:12;
(2)设可制得氧化钙的质量为x。
CaCO3高温CaO+CO2↑
56 44
x 6.6t
x=8.4t
答:(1)碳酸钙中Ca、C、O元素的质量比为10:3:12;(2)可制得氧化钙的质量是8.4t。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
