苏教版必修1专题2第一单元《从海水中获得的化学物质》教学建议
文档属性
| 名称 | 苏教版必修1专题2第一单元《从海水中获得的化学物质》教学建议 |

|
|
| 格式 | rar | ||
| 文件大小 | 116.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-02-07 00:00:00 | ||
图片预览











文档简介
课件51张PPT。必修1 专题2
从海水中获得的化学物质一、教学要求
二、知识结构
三、教学建议从海水中获得的化学物质一、教学要求1.化学课程标准——内容标准
2.福建省普通高中化学新课程学习要求福建省普通高中化学新课程学习要求
认知性学习目标的教学要求由低到高分为下列四个层次。一般高层次的要求包含了低层次的要求。
A:知道、说出、识别、描述、举例、列举(即识别“是什么”)
B:了解、认识、能表示、辨认、区分、比较(即明确“是什么”)
C:理解、解释、说明、判断、预期、分类、归纳、概述(即懂得 “为什么”)
D:应用、设计、评价、优选、使用、解决、检验、证明(即能够 “综合应用”)二、知识结构
1、结构特点本专题着眼于氯、溴、碘、钠、镁这几种元素的单质及其重要化合物的主要性质,同时将两个基本反应——氧化还原反应与离子反应穿插其中;
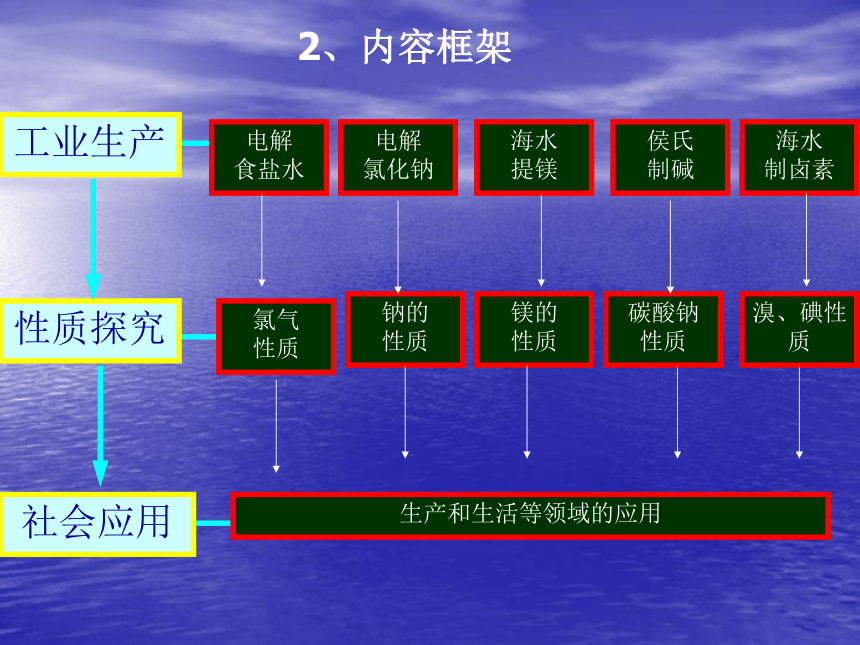
在知识安排上,注重知识和用途相结合、理论和实际相结合,使学生认识到常见元素的单质及其化合物在生活和生产中的应用以及与人类和环境的关系。 工业生产性质探究社会应用2、内容框架专题2 共9个实验
1.P40:电解饱和食盐水(观察与思考)
2.P42:氯气的性质实验(观察与思考)
3.P43:氯水的性质实验(活动与探究)
4.P46:溴和碘的性质实验(活动与探究)
5.P49:钠的性质实验(观察与思考)
6.P51:碳酸钠的性质实验(活动与探究)
7.P52:区别碳酸钠和碳酸氢钠的实验(活动与探究)
8.P53:电解质溶液的导电性实验(活动与探究)
9.P56:镁的性质实验(观察与思考)三、教学建议
本专题从大海中含有最多的盐——氯化钠入手,引出氯、溴、碘这样一个家族的元素(卤族元素),这是进入高中以来首次研究元素化合物知识。
在研究元素化合物时,一般是由点到线再到面,即先研究一些有代表性的典型的重要物质的性质,再研究其他物质。在教学中应使学生了解学习、研究物质的方法和基本思路。
教学中要充分利用化学实验在教学中的作用,不可完全用计算机模仿、代替化学实验。本专题知识目标
(1)了解氯、溴、碘、钠、镁及其重要化合物的主要性质和重要应用。
(2)根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。
(3)通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。三维目标本专题能力目标
(1)经历对化学物质及其变化进行探究的过程,进一步理解科学探究的意义,学习科学探究的基本方法,提高科学探究能力。
(2)能够发现和提出有探究价值的化学问题,敢于质疑,勤于思索,逐步形成独立思考的能力,善于与人合作,具有团队精神。
(3)在学习中,学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳、概括等方法对信息进行加工。本专题情感目标
(1)发展学习化学的兴趣,乐于探究物质变化的奥秘,感受化学世界的奇妙与和谐。
(2)有参与化学科技活动的热情,有将化学知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题做出合理的判断。
(3)树立辩证唯物主义的世界观,养成务实求真、勇于创新、积极实践的科学态度。本专题建议授课时数:9~10第一单元 氯、溴、碘及其化合物说明:
①知道电解食盐水的产物是H2、Cl2、NaOH,正确写出电解食盐水的化学方程式;知道氯气的检验方法:使湿润的淀粉碘化钾试纸变蓝(化学反应暂不作要求) 。
氯气的实验室制法暂不作要求。
②掌握氯气的化学性质:能正确写出氯气与非金属单质(H2)、金属单质(Na、Fe、Cu)、水、碱溶液[NaOH、Ca(OH)2]反应的化学方程式。
③了解氯水的成分及检验方法,了解次氯酸的主要性质(不稳定性、漂白性、弱酸性),知道漂白粉的主要成分与有效成分,了解漂白粉的漂白原理。④了解氧化还原反应与非氧化还原反应的本质区别是有无电子转移;能够用化合价升降、电子得失正确判断氧化剂和还原剂;能够用双线桥法、单线桥法正确表示反应中电子转移的方向和数目
氧化产物和还原产物、氧化性和还原性强弱判断、得失电子守恒在化学计算的应用、氧化还原反应的配平方法等内容暂不作要求。
⑤知道溴和碘的物理性质(颜色、状态、溶解性等);掌握氯、溴、碘间的置换反应(正确写出化学方程式,并能够正确描述反应现象);了解氯、溴、碘等离子检验方法(与硝酸银溶液的反应及现象);第二单元 钠、镁及其化合物说明:
①掌握钠与非金属单质(O2、Cl2)、钠与水的反应(正确写出方程式、准确描述实验现象并解释)。
②知道碳酸钠、碳酸氢钠的俗名、颜色及溶解性的差异,知道碳酸钠溶液显碱性;掌握碳酸钠与CaCl2、Ca(OH)2的反应(正确写出方程式并描述实验现象);掌握碳酸钠、碳酸氢钠与酸的反应及热稳定性(写出方程式);能够鉴别碳酸钠与碳酸氢钠固体及溶液。
碳酸氢钠与碱的反应暂不作要求;不要用水解原理解释碳酸钠溶液呈碱性的事实
③知道强电解质包括强酸、强碱、绝大多数盐;弱电解质包括弱酸、弱碱;能正确写出强电解质、弱电解质的电离方程式;了解离子反应的概念;了解离子方程式的书写步骤:写、拆、删、查;能正确写出常见的复分解反应、置换反应的离子方程式。
④了解从海水中提取镁的流程;了解镁的物理性质与用途;掌握镁与O2、N2、 CO2的反应(正确写出方程式)。第二节 氯气的性质 引入:复习初中所学过的氧气的性质,通过氧气与金属、非金属的反应,用类比的方式得出氯气的化学性质。 也可以从我们生活中发生的事实引入,如: 重庆发生有毒气体——氯气泄漏和爆炸事故 位于重庆市江北区的重庆天原化工总厂2004年4月15日晚发生氯气泄漏,并引发爆炸。事故造成人员伤亡,更有十五万人被疏散撤离。中国国务院总理温家宝17日对事故处理与善后工作作出指示,要求做好抢险救灾工作,彻底消除事故隐患。据专家初步判断,泄漏原因是氯罐及相关设备陈旧,处置时爆炸的原因是工作人员违规操作。重庆处置氯气泄漏爆炸事故引入重庆氯气泄漏爆炸事故中的3名伤员伤情明显好转 重庆天原化工总厂等18户污染企业将迁出主城区 各地专家参与 重庆氯气泄漏事故调查工作全面启动 重庆氯气警报解除 封锁区内返家市民生活如昔 重庆氯气事故工厂又见飞鸟 主城区环境指标正常 重庆氯气事故疏散群众返家侧记:回家的感觉真好 一个都不能少! 重庆氯气危机中挡不住的师生情 重庆官方披露天原化工厂引爆全过程 撤离者返家强化重点、突破难点的做法 1、通过演示实验,学生观察分析现象,了解氯气的物理性质,
完成表2-1,相互交流补充。物理性质颜色
状态
味道
毒性
气味熔点 沸点
溶解性
密度 硬度看尝闻测如何掌握黄绿色
气体有刺激性
气味易液化
能溶(1:2)
密度比空气大×①钠与氯气的反应
现象:剧烈燃烧,黄色火焰,生成大量白烟。 二. 氯气的化学性质
1.与金属反应 事实证明,氯气可与大多数金属在点燃或加热的条件下直接化合,而且生成高价态金属氯化物。②请写出Cl2与Fe在燃烧条件下的化学反应方程式 (先看实验1)棕褐色的烟实验表明:常温下干燥Cl2不与铁反应2. 氯气与非金属的反应现象:安静的燃烧,火焰呈苍白色,瓶口有白雾产生现象:释放大量的热,发生爆炸。氢气在氯气中燃烧氢气与氯气混合光照与H2反应反应条件不同,现象不同,但产物相同问题:为什么纯净的氢气能在氯气中安静燃烧,而两者的混合气体光照条件下却会发生爆炸? 点燃氢气放入氯气中,氢气只在导管口跟少量氯气分子接触而化合,产生少量的热,因此可以安静的燃烧。 当点燃氢气与氯气的混合气体时,大量的氢分子和氯分子接触,迅速化合产生大量的热,使瓶内气体体积急剧膨胀而发生爆炸。分析:2、组织学生完成活动与探究实验后,讨论:
①氯气能否与水反应?
②溶于水的氯气能否与水完全反应?
③氯水的成份?氯水中何种物质有漂白性?次氯酸为何有漂白性?其原理与活性炭漂白是否相同?次氯酸还有哪些性质?久置的氯水的成份是否会变化?
④漂白粉可应用于饮用水消毒,其原理是什么? Cl2 + H2O HCl + HClO3.氯气与水的反应实验2:取干燥的和湿润的有色布条各一条,分别放入两个集气瓶中,然后通入氯气现象:干燥的布条没有褪色,而湿润的布条却褪色了。原因:次氯酸(HClO)有漂白性。结论:干燥的氯气没有漂白性Cl2 + 2NaOH =NaCl + NaClO + H2O2Cl2 + 2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O漂白粉的主要成分4. 氯气与碱的反应氯气与NaOH反应氯气与Ca(OH)2反应1.与金属反应(变价金属,生成高价)
氯气与非金属(H2)的反应
3.氯气与水的反应(干燥氯气无漂白性)
氯气与碱的反应小结:氯气的化学性质:课堂练习
1、关于C1-和Cl2的说法正确的是( B )
A.都能与Fe反应生成FeCl3
B.与AgNO3溶液反应都生成白色沉淀
C.均有毒
D.都能与H2反应
2、检验氯化氢气体中是否混有Cl2,可采用的方法(D)
A.用干燥的蓝色石蕊试纸
B.用干燥的有色布条
C.将气体通入硝酸银溶液
D.用湿润的淀粉—碘化钾试纸3、下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( D )
A.FeCl2 B.FeCl3 C.CuCl2 D.ZnCl2
4、新制的氯水为 色,存在的分子有 ,离子有 。蓝色石蕊试纸遇到氯水后,首先颜色变 色,很快又 ,这是因为氯水中有 存在。(请用微粒符号填写)
答案:黄绿色,H2O、HClO、Cl2,H+ 、ClO-、Cl-,红,褪色,HClO 第三节 氧化还原反应 引导学生分析上述反应中各元素的化合价及其变化情况,引入电子转移的概念复习引入: Cl2 + H2O HCl + HClO2Cl2 + 2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O分析反应前后元素价态的变化和电子转移情况,从而引出氧化还原反应的相关概念。如①氧化还原反应的定义、实质、特征、判断方法;②氧化剂、还原剂的概念;③如何用“双线桥”及“单线桥”法表示氧化还原反应中电子转移的情况;例题:下列反应是不是氧化还原反应,是氧化还原反应的请用“双线桥”及“单线桥”法表示电子转移的情况;并指出氧化剂和还原剂。
1、Zn + CuSO4 = Cu + ZnSO4
2、Cl2 + 2NaOH =NaCl + NaClO + H2O
3、Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
4、MnO2 + 4HCl(浓) = MnCl2 + 2H2O + C12↑课堂练习:
1、判断下列哪些反应是氧化还原反应?理由是什么?
(1)Na2O + H2O = 2NaOH
(2)2Fe + Al2O3 = 2Al + Fe2O3
(3)IBr + H2O = HBr + HIO
(4)CH4 + Cl2 → CH3Cl + HCl
2、 用“双线桥”及“单线桥”,表示下列氧化还原反应中电子转移的情况;并判断氧化剂、还原剂。
(1)H2 + CuO = Cu + H2O
(2)MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O3、下列反应中盐酸为氧化剂的是( A )
A.Zn+2HCl = ZnCl2+H2↑
B.CaCO3+2HCl = CaCl2+H2O+CO2↑
C.KClO3+6HCl = KCl+3Cl2↑+3H2O
D.Ca(ClO)2+2HCl = CaCl2+2HClO
4、某元素在化学反应中由化合态变为游离态,则该元素( C )
A.一定被氧化了
B.一定被还原了
C.既可能被氧化也可能被还原
D.既不可能被氧化,也不可能被还原第四节 溴、碘的提取 本节教学可直接由实验引入,通过实验探究归纳总结得出溴、碘的物理性质与化学性质活动与探究实验P46:
实验1:将少量氯水滴入到盛有少量NaBr 溶液试管中,振荡,再加入少量CCl4,振荡、静置、观察、记录现象
现象:溶液由无色变为橙色,加CCl4后,下层为橙红色
原理:Cl2+2NaBr = 2NaCl+Br2
实验2:分别将少量氯水、溴水注入到盛有少量 KI 溶液试管中,振荡,再分别注入少量CCl4,振荡、观察、记录现象
现象:氯水与碘化钾:溶液由无色变为褐色,加CCl4后,下层为深紫色
溴水与碘化钾:溶液由无色变为褐色,加CCl4后,下层为深紫色
原理:Cl2 + 2Kl = 2NaCl + I2
Br2 + 2Kl = 2NaBr + I2
二、溴、碘单质的性质
物理性质:
溴单质是易挥发、深棕红色、密度大于水的液体,在水中溶解度不大。
碘单质是易升华、紫黑色、密度大于水的固体,在水中溶解度不大。溴、碘单质的化学性质
1、相互置换
Cl2 + 2NaBr = 2NaCl + Br2
Cl2 + 2Kl = 2NaCl + I2
Br2 + 2Kl = 2NaBr + I22、Br-、I-的检验—加稀HNO3+硝酸银溶液
NaBr + AgNO3 = NaNO3 + AgBr↓(淡黄色)
KI + AgNO3 = KNO3 + AgI↓ (黄色)
NaCl + AgNO3 = NaNO3 + AgCl↓(白色)
溴化银的感光性:2AgBr = 2Ag + Br2
碘化银:人工降雨剂三、工业提取Br2、 I2 :
提取粗盐后的母液→通入Cl2→鼓入热空气→挥发Br2蒸气→冷凝得液溴
工业提取I2:
海带粉碎→加水浸泡→通入Cl2→过滤→蒸发→升华→冷凝I2蒸气得晶体课堂练习:
1、能使湿润的KI-淀粉试纸变蓝的是( C )
①溴水 ②氯水 ③碘酒 ④氯化钾
A.①② B.只有① C.①②③ D.③④
2、设计实验鉴别三种白色固体NaCl、NaBr、KI固体
方法一:可用氯水鉴别。
把这三种物质各取少量制成溶液,加入新制的氯水和汽油(或四氯化碳),振荡,分层,使汽油层呈无色的是NaCl;使汽油层呈橙色的是NaBr;呈紫色的是KI。
方法二:直接加入AgNO3溶液。
分别取少量固体制成溶液,分别加入AgNO3溶液,有白色沉淀生成的是NaCl,有浅黄色沉淀生成的是NaBr,有黄色沉淀生成的是KI。3、将一定量Cl2通入250mL KBr溶液中,反应后将溶液蒸干,测知解得固体中含溴元素10g,且K+与Cl-的物质的量之比为2︰1。试求:(1)通入Cl2的体积(标准状况)。(2)原KBr溶液的物质的量浓度。[答案](1) (2) 谢 谢!
二、知识结构
三、教学建议从海水中获得的化学物质一、教学要求1.化学课程标准——内容标准
2.福建省普通高中化学新课程学习要求福建省普通高中化学新课程学习要求
认知性学习目标的教学要求由低到高分为下列四个层次。一般高层次的要求包含了低层次的要求。
A:知道、说出、识别、描述、举例、列举(即识别“是什么”)
B:了解、认识、能表示、辨认、区分、比较(即明确“是什么”)
C:理解、解释、说明、判断、预期、分类、归纳、概述(即懂得 “为什么”)
D:应用、设计、评价、优选、使用、解决、检验、证明(即能够 “综合应用”)二、知识结构
1、结构特点本专题着眼于氯、溴、碘、钠、镁这几种元素的单质及其重要化合物的主要性质,同时将两个基本反应——氧化还原反应与离子反应穿插其中;
在知识安排上,注重知识和用途相结合、理论和实际相结合,使学生认识到常见元素的单质及其化合物在生活和生产中的应用以及与人类和环境的关系。 工业生产性质探究社会应用2、内容框架专题2 共9个实验
1.P40:电解饱和食盐水(观察与思考)
2.P42:氯气的性质实验(观察与思考)
3.P43:氯水的性质实验(活动与探究)
4.P46:溴和碘的性质实验(活动与探究)
5.P49:钠的性质实验(观察与思考)
6.P51:碳酸钠的性质实验(活动与探究)
7.P52:区别碳酸钠和碳酸氢钠的实验(活动与探究)
8.P53:电解质溶液的导电性实验(活动与探究)
9.P56:镁的性质实验(观察与思考)三、教学建议
本专题从大海中含有最多的盐——氯化钠入手,引出氯、溴、碘这样一个家族的元素(卤族元素),这是进入高中以来首次研究元素化合物知识。
在研究元素化合物时,一般是由点到线再到面,即先研究一些有代表性的典型的重要物质的性质,再研究其他物质。在教学中应使学生了解学习、研究物质的方法和基本思路。
教学中要充分利用化学实验在教学中的作用,不可完全用计算机模仿、代替化学实验。本专题知识目标
(1)了解氯、溴、碘、钠、镁及其重要化合物的主要性质和重要应用。
(2)根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。
(3)通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。三维目标本专题能力目标
(1)经历对化学物质及其变化进行探究的过程,进一步理解科学探究的意义,学习科学探究的基本方法,提高科学探究能力。
(2)能够发现和提出有探究价值的化学问题,敢于质疑,勤于思索,逐步形成独立思考的能力,善于与人合作,具有团队精神。
(3)在学习中,学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳、概括等方法对信息进行加工。本专题情感目标
(1)发展学习化学的兴趣,乐于探究物质变化的奥秘,感受化学世界的奇妙与和谐。
(2)有参与化学科技活动的热情,有将化学知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题做出合理的判断。
(3)树立辩证唯物主义的世界观,养成务实求真、勇于创新、积极实践的科学态度。本专题建议授课时数:9~10第一单元 氯、溴、碘及其化合物说明:
①知道电解食盐水的产物是H2、Cl2、NaOH,正确写出电解食盐水的化学方程式;知道氯气的检验方法:使湿润的淀粉碘化钾试纸变蓝(化学反应暂不作要求) 。
氯气的实验室制法暂不作要求。
②掌握氯气的化学性质:能正确写出氯气与非金属单质(H2)、金属单质(Na、Fe、Cu)、水、碱溶液[NaOH、Ca(OH)2]反应的化学方程式。
③了解氯水的成分及检验方法,了解次氯酸的主要性质(不稳定性、漂白性、弱酸性),知道漂白粉的主要成分与有效成分,了解漂白粉的漂白原理。④了解氧化还原反应与非氧化还原反应的本质区别是有无电子转移;能够用化合价升降、电子得失正确判断氧化剂和还原剂;能够用双线桥法、单线桥法正确表示反应中电子转移的方向和数目
氧化产物和还原产物、氧化性和还原性强弱判断、得失电子守恒在化学计算的应用、氧化还原反应的配平方法等内容暂不作要求。
⑤知道溴和碘的物理性质(颜色、状态、溶解性等);掌握氯、溴、碘间的置换反应(正确写出化学方程式,并能够正确描述反应现象);了解氯、溴、碘等离子检验方法(与硝酸银溶液的反应及现象);第二单元 钠、镁及其化合物说明:
①掌握钠与非金属单质(O2、Cl2)、钠与水的反应(正确写出方程式、准确描述实验现象并解释)。
②知道碳酸钠、碳酸氢钠的俗名、颜色及溶解性的差异,知道碳酸钠溶液显碱性;掌握碳酸钠与CaCl2、Ca(OH)2的反应(正确写出方程式并描述实验现象);掌握碳酸钠、碳酸氢钠与酸的反应及热稳定性(写出方程式);能够鉴别碳酸钠与碳酸氢钠固体及溶液。
碳酸氢钠与碱的反应暂不作要求;不要用水解原理解释碳酸钠溶液呈碱性的事实
③知道强电解质包括强酸、强碱、绝大多数盐;弱电解质包括弱酸、弱碱;能正确写出强电解质、弱电解质的电离方程式;了解离子反应的概念;了解离子方程式的书写步骤:写、拆、删、查;能正确写出常见的复分解反应、置换反应的离子方程式。
④了解从海水中提取镁的流程;了解镁的物理性质与用途;掌握镁与O2、N2、 CO2的反应(正确写出方程式)。第二节 氯气的性质 引入:复习初中所学过的氧气的性质,通过氧气与金属、非金属的反应,用类比的方式得出氯气的化学性质。 也可以从我们生活中发生的事实引入,如: 重庆发生有毒气体——氯气泄漏和爆炸事故 位于重庆市江北区的重庆天原化工总厂2004年4月15日晚发生氯气泄漏,并引发爆炸。事故造成人员伤亡,更有十五万人被疏散撤离。中国国务院总理温家宝17日对事故处理与善后工作作出指示,要求做好抢险救灾工作,彻底消除事故隐患。据专家初步判断,泄漏原因是氯罐及相关设备陈旧,处置时爆炸的原因是工作人员违规操作。重庆处置氯气泄漏爆炸事故引入重庆氯气泄漏爆炸事故中的3名伤员伤情明显好转 重庆天原化工总厂等18户污染企业将迁出主城区 各地专家参与 重庆氯气泄漏事故调查工作全面启动 重庆氯气警报解除 封锁区内返家市民生活如昔 重庆氯气事故工厂又见飞鸟 主城区环境指标正常 重庆氯气事故疏散群众返家侧记:回家的感觉真好 一个都不能少! 重庆氯气危机中挡不住的师生情 重庆官方披露天原化工厂引爆全过程 撤离者返家强化重点、突破难点的做法 1、通过演示实验,学生观察分析现象,了解氯气的物理性质,
完成表2-1,相互交流补充。物理性质颜色
状态
味道
毒性
气味熔点 沸点
溶解性
密度 硬度看尝闻测如何掌握黄绿色
气体有刺激性
气味易液化
能溶(1:2)
密度比空气大×①钠与氯气的反应
现象:剧烈燃烧,黄色火焰,生成大量白烟。 二. 氯气的化学性质
1.与金属反应 事实证明,氯气可与大多数金属在点燃或加热的条件下直接化合,而且生成高价态金属氯化物。②请写出Cl2与Fe在燃烧条件下的化学反应方程式 (先看实验1)棕褐色的烟实验表明:常温下干燥Cl2不与铁反应2. 氯气与非金属的反应现象:安静的燃烧,火焰呈苍白色,瓶口有白雾产生现象:释放大量的热,发生爆炸。氢气在氯气中燃烧氢气与氯气混合光照与H2反应反应条件不同,现象不同,但产物相同问题:为什么纯净的氢气能在氯气中安静燃烧,而两者的混合气体光照条件下却会发生爆炸? 点燃氢气放入氯气中,氢气只在导管口跟少量氯气分子接触而化合,产生少量的热,因此可以安静的燃烧。 当点燃氢气与氯气的混合气体时,大量的氢分子和氯分子接触,迅速化合产生大量的热,使瓶内气体体积急剧膨胀而发生爆炸。分析:2、组织学生完成活动与探究实验后,讨论:
①氯气能否与水反应?
②溶于水的氯气能否与水完全反应?
③氯水的成份?氯水中何种物质有漂白性?次氯酸为何有漂白性?其原理与活性炭漂白是否相同?次氯酸还有哪些性质?久置的氯水的成份是否会变化?
④漂白粉可应用于饮用水消毒,其原理是什么? Cl2 + H2O HCl + HClO3.氯气与水的反应实验2:取干燥的和湿润的有色布条各一条,分别放入两个集气瓶中,然后通入氯气现象:干燥的布条没有褪色,而湿润的布条却褪色了。原因:次氯酸(HClO)有漂白性。结论:干燥的氯气没有漂白性Cl2 + 2NaOH =NaCl + NaClO + H2O2Cl2 + 2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O漂白粉的主要成分4. 氯气与碱的反应氯气与NaOH反应氯气与Ca(OH)2反应1.与金属反应(变价金属,生成高价)
氯气与非金属(H2)的反应
3.氯气与水的反应(干燥氯气无漂白性)
氯气与碱的反应小结:氯气的化学性质:课堂练习
1、关于C1-和Cl2的说法正确的是( B )
A.都能与Fe反应生成FeCl3
B.与AgNO3溶液反应都生成白色沉淀
C.均有毒
D.都能与H2反应
2、检验氯化氢气体中是否混有Cl2,可采用的方法(D)
A.用干燥的蓝色石蕊试纸
B.用干燥的有色布条
C.将气体通入硝酸银溶液
D.用湿润的淀粉—碘化钾试纸3、下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( D )
A.FeCl2 B.FeCl3 C.CuCl2 D.ZnCl2
4、新制的氯水为 色,存在的分子有 ,离子有 。蓝色石蕊试纸遇到氯水后,首先颜色变 色,很快又 ,这是因为氯水中有 存在。(请用微粒符号填写)
答案:黄绿色,H2O、HClO、Cl2,H+ 、ClO-、Cl-,红,褪色,HClO 第三节 氧化还原反应 引导学生分析上述反应中各元素的化合价及其变化情况,引入电子转移的概念复习引入: Cl2 + H2O HCl + HClO2Cl2 + 2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O分析反应前后元素价态的变化和电子转移情况,从而引出氧化还原反应的相关概念。如①氧化还原反应的定义、实质、特征、判断方法;②氧化剂、还原剂的概念;③如何用“双线桥”及“单线桥”法表示氧化还原反应中电子转移的情况;例题:下列反应是不是氧化还原反应,是氧化还原反应的请用“双线桥”及“单线桥”法表示电子转移的情况;并指出氧化剂和还原剂。
1、Zn + CuSO4 = Cu + ZnSO4
2、Cl2 + 2NaOH =NaCl + NaClO + H2O
3、Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
4、MnO2 + 4HCl(浓) = MnCl2 + 2H2O + C12↑课堂练习:
1、判断下列哪些反应是氧化还原反应?理由是什么?
(1)Na2O + H2O = 2NaOH
(2)2Fe + Al2O3 = 2Al + Fe2O3
(3)IBr + H2O = HBr + HIO
(4)CH4 + Cl2 → CH3Cl + HCl
2、 用“双线桥”及“单线桥”,表示下列氧化还原反应中电子转移的情况;并判断氧化剂、还原剂。
(1)H2 + CuO = Cu + H2O
(2)MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O3、下列反应中盐酸为氧化剂的是( A )
A.Zn+2HCl = ZnCl2+H2↑
B.CaCO3+2HCl = CaCl2+H2O+CO2↑
C.KClO3+6HCl = KCl+3Cl2↑+3H2O
D.Ca(ClO)2+2HCl = CaCl2+2HClO
4、某元素在化学反应中由化合态变为游离态,则该元素( C )
A.一定被氧化了
B.一定被还原了
C.既可能被氧化也可能被还原
D.既不可能被氧化,也不可能被还原第四节 溴、碘的提取 本节教学可直接由实验引入,通过实验探究归纳总结得出溴、碘的物理性质与化学性质活动与探究实验P46:
实验1:将少量氯水滴入到盛有少量NaBr 溶液试管中,振荡,再加入少量CCl4,振荡、静置、观察、记录现象
现象:溶液由无色变为橙色,加CCl4后,下层为橙红色
原理:Cl2+2NaBr = 2NaCl+Br2
实验2:分别将少量氯水、溴水注入到盛有少量 KI 溶液试管中,振荡,再分别注入少量CCl4,振荡、观察、记录现象
现象:氯水与碘化钾:溶液由无色变为褐色,加CCl4后,下层为深紫色
溴水与碘化钾:溶液由无色变为褐色,加CCl4后,下层为深紫色
原理:Cl2 + 2Kl = 2NaCl + I2
Br2 + 2Kl = 2NaBr + I2
二、溴、碘单质的性质
物理性质:
溴单质是易挥发、深棕红色、密度大于水的液体,在水中溶解度不大。
碘单质是易升华、紫黑色、密度大于水的固体,在水中溶解度不大。溴、碘单质的化学性质
1、相互置换
Cl2 + 2NaBr = 2NaCl + Br2
Cl2 + 2Kl = 2NaCl + I2
Br2 + 2Kl = 2NaBr + I22、Br-、I-的检验—加稀HNO3+硝酸银溶液
NaBr + AgNO3 = NaNO3 + AgBr↓(淡黄色)
KI + AgNO3 = KNO3 + AgI↓ (黄色)
NaCl + AgNO3 = NaNO3 + AgCl↓(白色)
溴化银的感光性:2AgBr = 2Ag + Br2
碘化银:人工降雨剂三、工业提取Br2、 I2 :
提取粗盐后的母液→通入Cl2→鼓入热空气→挥发Br2蒸气→冷凝得液溴
工业提取I2:
海带粉碎→加水浸泡→通入Cl2→过滤→蒸发→升华→冷凝I2蒸气得晶体课堂练习:
1、能使湿润的KI-淀粉试纸变蓝的是( C )
①溴水 ②氯水 ③碘酒 ④氯化钾
A.①② B.只有① C.①②③ D.③④
2、设计实验鉴别三种白色固体NaCl、NaBr、KI固体
方法一:可用氯水鉴别。
把这三种物质各取少量制成溶液,加入新制的氯水和汽油(或四氯化碳),振荡,分层,使汽油层呈无色的是NaCl;使汽油层呈橙色的是NaBr;呈紫色的是KI。
方法二:直接加入AgNO3溶液。
分别取少量固体制成溶液,分别加入AgNO3溶液,有白色沉淀生成的是NaCl,有浅黄色沉淀生成的是NaBr,有黄色沉淀生成的是KI。3、将一定量Cl2通入250mL KBr溶液中,反应后将溶液蒸干,测知解得固体中含溴元素10g,且K+与Cl-的物质的量之比为2︰1。试求:(1)通入Cl2的体积(标准状况)。(2)原KBr溶液的物质的量浓度。[答案](1) (2) 谢 谢!
