元素周期律
图片预览







文档简介
课件22张PPT。专题1微观结构与物质的多样性
1-2 元素周期律1、原子核外电子排布的规律性 画出原子序数为1~18的元素的原子结
构示意图。
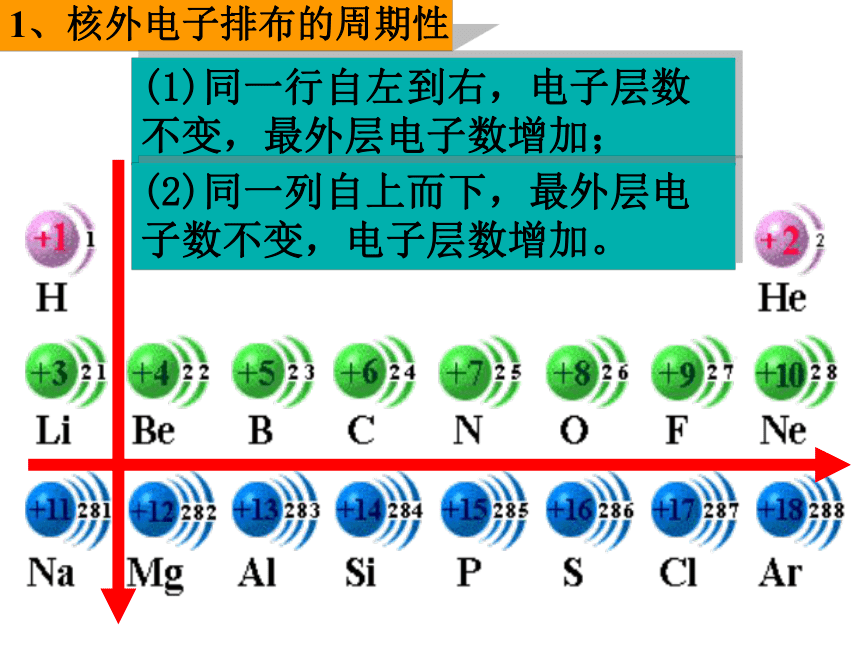
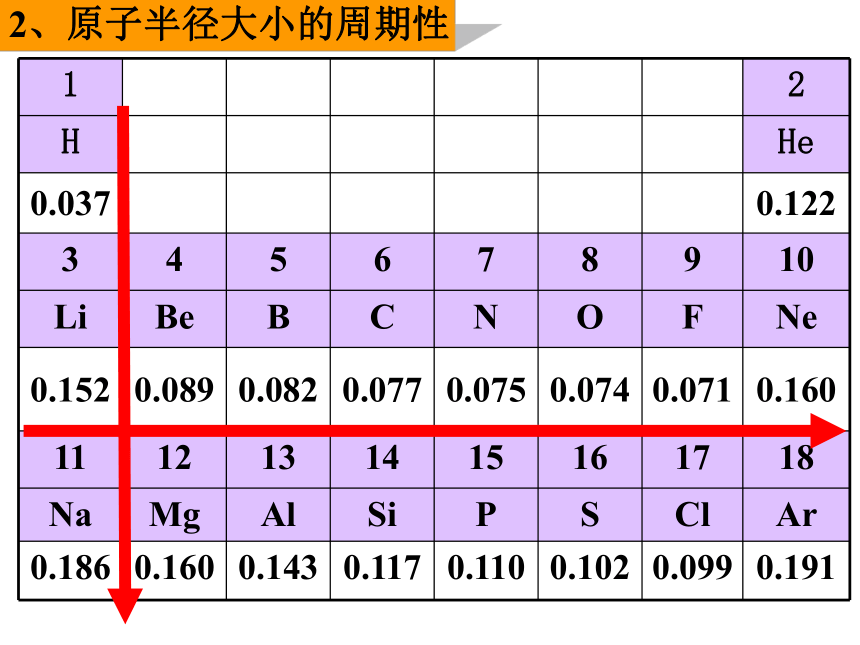
1、核外电子排布的周期性(1)同一行自左到右,电子层数不变,最外层电子数增加;(2)同一列自上而下,最外层电子数不变,电子层数增加。2、原子半径大小的周期性2、原子半径大小的周期性3~9号元素或11~17号元素随着核电荷数的递增,原子半径的变化规律是 : 逐渐减小逐渐减小周期性2、原子半径大小的周期性(1)同一行自左到右,电子层数不变,
最外层电子数增加,原子半径减小;
(2)同一列自上而下,最外层电子数不变,
电子层数增加,原子半径增大;
解释:微粒半径大小取决于①电子层数
②原子核对外层电子的引力
③外层电子之间斥力1、下列元素中,原子半径最大的是 ( )
A、锂 B、钠 C、氟 D、氯
2、下列各元素的负化合价从–1~–4依次安排的是 ( )
A、F.Cl.Br.I B、Li.Na.Mg.Al
C、C.N.O.F D、Cl.S.P.Si
BD练习:元素的主要化合价元素的主要化合价随着原子序数的变化如何?2 3结论:随着原子序数的递增,元素化合价呈现 变化。
周期性3、元素化合价变化的周期性(1)最高正价=最外层电子数
(2)负价价数= 8-最高正价
(3)O、F无正价3、元素化合价变化的周期性M2O无MO无M2O3无RO2RH4R2O5RH3RO3H2RR2O7HR(1)最高正价=最外层电子数
(2)负价价数= 8-最高正价
(3)O、F无正价例: 某元素最高价氧化物对应水化物的化学式是H2XO3,这种元素的气态氢化物的化学式为 ( )
A、HX B、H2X C、XH3 D、XH4D①比较金属与水(酸)置换出H2难易;
②比较最高价氧化物的水化物的碱性强弱;
③能否从化合物中置换出另一种金属。a.比较与氢气生成气态氢化物难易和稳定性;
b.比较最高价氧化物的水化物的酸性强弱;
c.能否从化合物中置换出加一种非金属单质。4.元素金属性变化规律的探究如何设计实验证明三者金属性强弱?如何设计实验证明四者非金属性强弱?4.元素金属性变化规律的探究1、写出化学方程式或离子方程式:
(1)钠与冷水剧烈反应:
(2)镁与沸水迅速反应;
(3)铝与沸水缓慢反应;
(4)镁与盐酸剧烈反应;
(5)铝与盐酸迅速反应;
。4.元素金属性变化规律的探究冷水,剧烈
红色沸水,迅速
浅红色沸水,缓慢
难变红剧烈,发烫迅速,发烫NaOH
强碱Mg(OH)2
中强碱Al(OH)3
弱碱强 弱5.元素非金属性变化规律的探究高温磷蒸气加热点燃或光照不稳定
自燃较不稳定
易分解不很稳定
分解很稳定SiH4
SiO2PH3
P2O5H2S
SO3HCl
Cl2O7H4SiO4
弱酸H3PO4
中强酸H2SO4
强酸HClO4
最强酸弱 强最高价氧化物对应水化物的酸碱性金属性和非金属性递变金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强结论: 元素的性质随着原子序数的递增呈周期性变化。
这个规律叫元素周期律。元素周期律是元素原子的核外电子排布的
周期性变化的必然结果 这是继原子理论后人们对化学元素概念认识的又一次深化和飞跃。它揭示了各种化学元素和化合物之间,各种不同原子间的内在联系。元素周期律统一了整个无机化学。它又作为基本定律贯穿于化学领域的各个分支,它的科学思想渗透于边缘学科和交叉学科之中,改变着人们的思维方法与认识手段。它揭示了自然界的普遍联系的思想,应用了从量变到质变的辩证法规律,这是科学史上的一个伟大勋业,具有伟大的科学意义和哲学意义。
---------恩格斯
1-2 元素周期律1、原子核外电子排布的规律性 画出原子序数为1~18的元素的原子结
构示意图。
1、核外电子排布的周期性(1)同一行自左到右,电子层数不变,最外层电子数增加;(2)同一列自上而下,最外层电子数不变,电子层数增加。2、原子半径大小的周期性2、原子半径大小的周期性3~9号元素或11~17号元素随着核电荷数的递增,原子半径的变化规律是 : 逐渐减小逐渐减小周期性2、原子半径大小的周期性(1)同一行自左到右,电子层数不变,
最外层电子数增加,原子半径减小;
(2)同一列自上而下,最外层电子数不变,
电子层数增加,原子半径增大;
解释:微粒半径大小取决于①电子层数
②原子核对外层电子的引力
③外层电子之间斥力1、下列元素中,原子半径最大的是 ( )
A、锂 B、钠 C、氟 D、氯
2、下列各元素的负化合价从–1~–4依次安排的是 ( )
A、F.Cl.Br.I B、Li.Na.Mg.Al
C、C.N.O.F D、Cl.S.P.Si
BD练习:元素的主要化合价元素的主要化合价随着原子序数的变化如何?2 3结论:随着原子序数的递增,元素化合价呈现 变化。
周期性3、元素化合价变化的周期性(1)最高正价=最外层电子数
(2)负价价数= 8-最高正价
(3)O、F无正价3、元素化合价变化的周期性M2O无MO无M2O3无RO2RH4R2O5RH3RO3H2RR2O7HR(1)最高正价=最外层电子数
(2)负价价数= 8-最高正价
(3)O、F无正价例: 某元素最高价氧化物对应水化物的化学式是H2XO3,这种元素的气态氢化物的化学式为 ( )
A、HX B、H2X C、XH3 D、XH4D①比较金属与水(酸)置换出H2难易;
②比较最高价氧化物的水化物的碱性强弱;
③能否从化合物中置换出另一种金属。a.比较与氢气生成气态氢化物难易和稳定性;
b.比较最高价氧化物的水化物的酸性强弱;
c.能否从化合物中置换出加一种非金属单质。4.元素金属性变化规律的探究如何设计实验证明三者金属性强弱?如何设计实验证明四者非金属性强弱?4.元素金属性变化规律的探究1、写出化学方程式或离子方程式:
(1)钠与冷水剧烈反应:
(2)镁与沸水迅速反应;
(3)铝与沸水缓慢反应;
(4)镁与盐酸剧烈反应;
(5)铝与盐酸迅速反应;
。4.元素金属性变化规律的探究冷水,剧烈
红色沸水,迅速
浅红色沸水,缓慢
难变红剧烈,发烫迅速,发烫NaOH
强碱Mg(OH)2
中强碱Al(OH)3
弱碱强 弱5.元素非金属性变化规律的探究高温磷蒸气加热点燃或光照不稳定
自燃较不稳定
易分解不很稳定
分解很稳定SiH4
SiO2PH3
P2O5H2S
SO3HCl
Cl2O7H4SiO4
弱酸H3PO4
中强酸H2SO4
强酸HClO4
最强酸弱 强最高价氧化物对应水化物的酸碱性金属性和非金属性递变金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强结论: 元素的性质随着原子序数的递增呈周期性变化。
这个规律叫元素周期律。元素周期律是元素原子的核外电子排布的
周期性变化的必然结果 这是继原子理论后人们对化学元素概念认识的又一次深化和飞跃。它揭示了各种化学元素和化合物之间,各种不同原子间的内在联系。元素周期律统一了整个无机化学。它又作为基本定律贯穿于化学领域的各个分支,它的科学思想渗透于边缘学科和交叉学科之中,改变着人们的思维方法与认识手段。它揭示了自然界的普遍联系的思想,应用了从量变到质变的辩证法规律,这是科学史上的一个伟大勋业,具有伟大的科学意义和哲学意义。
---------恩格斯
