共价键教学设计
图片预览

文档简介
1.2.2 共价键
【教材分析】:
本节课选自化学必修2专题1微观结构与物质的多样性第二单元微粒之间的相互作用力第二节共价键。本节课内容是本专题的一个重点内容,它是继上一节学习完离子键之后,来学习另一种化学键即共价键。从而引出下节课分子之间的作用力折翼内容,其作用可谓是承上启下。学好了本节课学生对于微观世界有了进一步的了解。
从教材的内容来看,教材当中例举了氯气、氯化氢,并讲述了成键过程及其原理。概括的介绍了什么是共价键。学生对共价键有了一定的认识和体会。为接下来的学习打下铺垫。接着学生再利用所学知识书写电子式,达到学以致用的作用。接着再介绍用结构式和球棍模型表示共价键分子丰富了学生的知识领域。再进行知识引申,引导学生考虑碳原子的成键结构和成键类型。最后与离子键比较更容易使学生形成系统的化学键的知识体系。教材的知识编排层层递进,有条理性符合学生的认知规律。
【学情分析】
兵法有云,知己知彼,百战不殆。不仅要备教材还要备学生。学生的差异性是客观存在的,只有了解了学生的一般特点才能更好的开展教学活动。本节内容针对的是一般高中的学生,长期以来的以学生为主的讲述和探究相结合的教学方式,学生已经初步的掌握了观察现象发现问题、提出问题、交流讨论、归纳反思的能力。而这为本节课的顺利开展打下了基础。而之前已经学过了离子键这一相关的内容为学习另一种化学键—共价键提供了一定的知识储备,学生更容易掌握。然而对于青春期的他们思维比较活跃,好奇心比较强,特别是对于实验现象有求知欲和探索欲。但缺乏一种科学的学习方法,逻辑思维与本节课的内容要求尚有一定的距离。而我就紧抓学生的好奇心、激发他们的学习兴趣,逐步引导他们的认识,降低难度,掌握本节课的内容。
【教学目标】
根据《普通高中新课程标准要求大纲》,《教学指导意见》我制定了一下三维目标。
一、知识与技能:掌握化学键的概念;掌握化学键的形成及其条件;并熟练运用电子式来表示化合物;了解碳原子结构的价钱类型和连接方式。
二、过程与方法:培养学生抽象思维和综合概括能力;掌握从初步到一般的方法。
三、情感、态度、价值观:培养学生对立统一的的思想;培养学生透过现象看事物发展本质的哲学思想。
【重难点】
重点:理解化学键的概念并学会正确书写共价化合物的电子式。
突出方法:小组讨论法,练习法
难点:共价键和离子键的区别。
突破方法:小组讨论法
【教法和学法】
教法:讲授法、讨论法。
学法:自学导学、实验探究、合作交流。
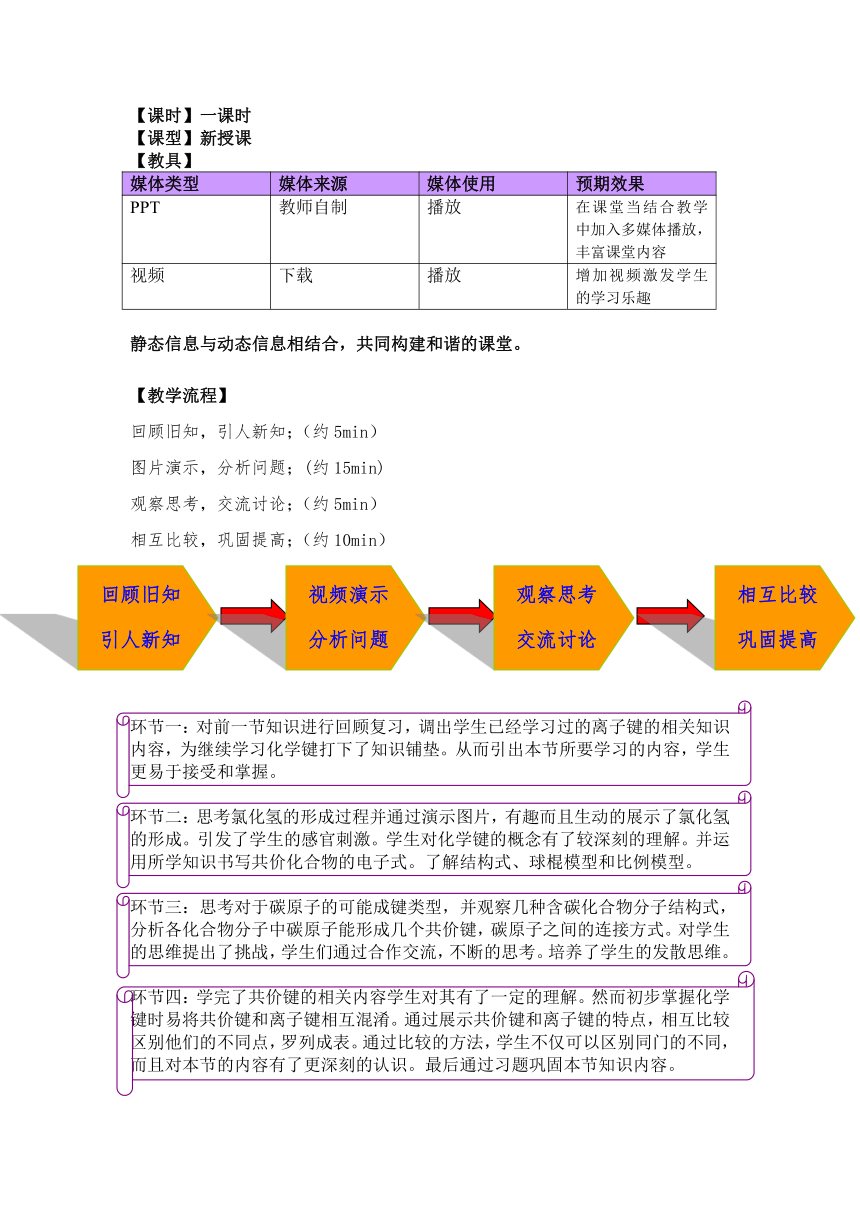
【课时】一课时
【课型】新授课
【教具】
媒体类型 媒体来源 媒体使用 预期效果
PPT 教师自制 播放 在课堂当结合教学中加入多媒体播放,丰富课堂内容
视频 下载 播放 增加视频激发学生的学习乐趣
静态信息与动态信息相结合,共同构建和谐的课堂。
【教学流程】
回顾旧知,引人新知;(约5min)
图片演示,分析问题;(约15min)
观察思考,交流讨论;(约5min)
相互比较,巩固提高;(约10min)
环节一:对前一节知识进行回顾复习,调出学生已经学习过的离子键的相关知识内容,为继续学习化学键打下了知识铺垫。从而引出本节所要学习的内容,学生更易于接受和掌握。
环节二:思考氯化氢的形成过程并通过演示图片,有趣而且生动的展示了氯化氢的形成。引发了学生的感官刺激。学生对化学键的概念有了较深刻的理解。并运用所学知识书写共价化合物的电子式。了解结构式、球棍模型和比例模型。
环节三:思考对于碳原子的可能成键类型,并观察几种含碳化合物分子结构式,分析各化合物分子中碳原子能形成几个共价键,碳原子之间的连接方式。对学生的思维提出了挑战,学生们通过合作交流,不断的思考。培养了学生的发散思维。
环节四:学完了共价键的相关内容学生对其有了一定的理解。然而初步掌握化学键时易将共价键和离子键相互混淆。通过展示共价键和离子键的特点,相互比较区别他们的不同点,罗列成表。通过比较的方法,学生不仅可以区别同门的不同,
而且对本节的内容有了更深刻的认识。最后通过习题巩固本节知识内容。
【教学过程】
【教师】:同学们你们还记得上一节课所学习的内容吗?上一节课学习中同学们都学到了那些内容呢?
【学生】:离子键。
【教师】:对!离子键是一种常见的化学键,那么现在检测一下大家所学过的知识。首先什么是化学键?
【学生】:阴、阳离子通过静电作用结合成的化学键。
【教师】:哪些元素化合物化合是可以形成离子键的呢?
【学生】:一般是活泼金属和活泼非金属离子间能形成。
【教师】:现在开火车,一人举一例离子化合物。
【学生】:(开火车举例)
【教师】:同学们掌握的很好,现在老师加大难度。请5位同学用电子式表示出K、S、K+、S2-、K2S。下面的同学自己在草稿纸上完成。
【学生】:(完成电子式,教师下去巡视并进行指导)
【教师】:最后完成ppt上的两个选择题。
【学生】:(一完成选择,教师进行引导)
【教师】:活泼的金属元素和活泼非金属元素化合时形成离子键。那么假如对于都是非金属呢?例如氢气和氯气,你认为H2 、Cl2形成的HCl和NaCl一样吗?两种非金属元素之间化合时,能形成离子键吗?为什么?
【学生】:(思考并尝试回答)
【教师】:这节课我们就来学习化学键(板书:化学键)。现在同学们带着这个问题看看PPT上展示的图片演示,看看究竟同时活泼气体的氯气和氢气如何形成氯化氢。正所谓是狭路相逢勇者胜。
(教师描述:对于只有一个电子的氢气它呢,更想得到一个电子达到最外层是2的稳定状态。而对于最外层是7的氯气只要得到一个电子同样达到最外层是8的稳定状态。两者相互挣脱,既然都要得到一个电子,那么他们是否可以达成一个共识呢?同学给他们处处主意解决这两者的矛盾。)
【学生】:共同电子对。(同学们各自发表自己的观点,教师总结。)
【教师】:真是一个不错的主意。结果是不是这样呢?(引导学生看下一张ppt)
【教师】:那么现在通过这一动画给化学键下一个定义呢?什么是化学键?
【学生】:原子间通过共有电子对所形成的相互作用成为共价键。
【教师】:(板书:定义;原子间通过共有电子对所形成的相互作用)
【教师】:那么我们以前学过了用电子式来书写离子化合物。那么我们又将如何用电子式来书写共价化合物。一般要记住三个步骤,一排、二算、三画。以HCl为例,第一步,先分别画出H、C l原子的电子式,将他们排成行。第二步,计算它们需要共用几对电子才能分别达到稳定状态。H、Cl原子需共用一对电子。所以分别各自拿出一个电子。第三步,将他们共用电子对画分子中间。要特别注意的一点是共价键没有电子得失不能用【】。
(板书:电子式表示共价键)
【教师】:现在牛刀小试,根据HCl的形成方式,写出共价分子电子式。
【学生】:(学生上讲台书写,教师从旁指导)。
【教师】:同学们会发现刚才我们学习的一共价键结合的两个原子都是一对的,假如多对的又该怎么画呢。如氮气之间是三对电子。请同学们牛刀再试。
【学生】:(学生加大了难度,可能会出现错误,教师发挥引导作用。)
【教师】:除了用电子式外,我们还可以用结构式来表示共价分子。在结构式中,原子间的一条短线表示一对共用电子。除此之外还有球棍模型,比例模型。像这些分子中相邻分子之间都是以共价键直接相连,就称为共价化合物。特别注意的是假如分子当中出现了离子键,那么这一化合物就属于离子化合物。(完成课后习题p17第4题。时间多时可当堂完成)
【教师】:刚才我们解决了什么是共价键。那么我们又该如何知道两个原子是否是共价键呢?
【学生】:两个原子相互都要得到电子达到稳定结构。
【教师】:很好!这样的判断方法非常好。那么假如对于碳原子,它的最外层是4。那么根据碳原子的结构,你们认为它与其它元素易以共价键结合还是离子键结合?
【学生】:都有可能。
【教师】:对,都有可能。但常见的多以共价键与其他原子结合。例如教材P14-15观察与思考所呈现的日常常见的含碳化合物。同学们继续观察碳原子能形成几个共价键。他们是怎么连接的。
【学生】:一个碳原子形成四个共用电子对,碳原子之间通过一对,两队,或三对共用电子相结合。分别构成碳碳单键,双键,叁键,碳环。所以自然间当中含碳元素是最多的原因之一就是连接方式的多样性。
【教师】:到现在呢?我们已经学完了本节课的内容。我们试着与上一节所学的离子键相互比较。前后桌讨论化学键和离子键的异同点。
【学生】:(学生激烈讨论,找出异同)
【教师】:请哪位小组派个代表站起来发表你们的成果。
【学生】:(尽可能讲述异同点)
【教师】:现在大家一起看看这一张表格。看看他们的不同点。
【学生】:(通过表格对化学键有了总的认识。)
【教师】:现在我们来完成接下来几个题目来巩固本节课内容。
【板书设计】
回顾旧知
引人新知
视频演示
分析问题
观察思考
交流讨论
相互比较
巩固提高
回顾旧知,引人新知
图片演示,分析问题知
观察思考,交流讨论
相互比较,巩固提高
【教材分析】:
本节课选自化学必修2专题1微观结构与物质的多样性第二单元微粒之间的相互作用力第二节共价键。本节课内容是本专题的一个重点内容,它是继上一节学习完离子键之后,来学习另一种化学键即共价键。从而引出下节课分子之间的作用力折翼内容,其作用可谓是承上启下。学好了本节课学生对于微观世界有了进一步的了解。
从教材的内容来看,教材当中例举了氯气、氯化氢,并讲述了成键过程及其原理。概括的介绍了什么是共价键。学生对共价键有了一定的认识和体会。为接下来的学习打下铺垫。接着学生再利用所学知识书写电子式,达到学以致用的作用。接着再介绍用结构式和球棍模型表示共价键分子丰富了学生的知识领域。再进行知识引申,引导学生考虑碳原子的成键结构和成键类型。最后与离子键比较更容易使学生形成系统的化学键的知识体系。教材的知识编排层层递进,有条理性符合学生的认知规律。
【学情分析】
兵法有云,知己知彼,百战不殆。不仅要备教材还要备学生。学生的差异性是客观存在的,只有了解了学生的一般特点才能更好的开展教学活动。本节内容针对的是一般高中的学生,长期以来的以学生为主的讲述和探究相结合的教学方式,学生已经初步的掌握了观察现象发现问题、提出问题、交流讨论、归纳反思的能力。而这为本节课的顺利开展打下了基础。而之前已经学过了离子键这一相关的内容为学习另一种化学键—共价键提供了一定的知识储备,学生更容易掌握。然而对于青春期的他们思维比较活跃,好奇心比较强,特别是对于实验现象有求知欲和探索欲。但缺乏一种科学的学习方法,逻辑思维与本节课的内容要求尚有一定的距离。而我就紧抓学生的好奇心、激发他们的学习兴趣,逐步引导他们的认识,降低难度,掌握本节课的内容。
【教学目标】
根据《普通高中新课程标准要求大纲》,《教学指导意见》我制定了一下三维目标。
一、知识与技能:掌握化学键的概念;掌握化学键的形成及其条件;并熟练运用电子式来表示化合物;了解碳原子结构的价钱类型和连接方式。
二、过程与方法:培养学生抽象思维和综合概括能力;掌握从初步到一般的方法。
三、情感、态度、价值观:培养学生对立统一的的思想;培养学生透过现象看事物发展本质的哲学思想。
【重难点】
重点:理解化学键的概念并学会正确书写共价化合物的电子式。
突出方法:小组讨论法,练习法
难点:共价键和离子键的区别。
突破方法:小组讨论法
【教法和学法】
教法:讲授法、讨论法。
学法:自学导学、实验探究、合作交流。
【课时】一课时
【课型】新授课
【教具】
媒体类型 媒体来源 媒体使用 预期效果
PPT 教师自制 播放 在课堂当结合教学中加入多媒体播放,丰富课堂内容
视频 下载 播放 增加视频激发学生的学习乐趣
静态信息与动态信息相结合,共同构建和谐的课堂。
【教学流程】
回顾旧知,引人新知;(约5min)
图片演示,分析问题;(约15min)
观察思考,交流讨论;(约5min)
相互比较,巩固提高;(约10min)
环节一:对前一节知识进行回顾复习,调出学生已经学习过的离子键的相关知识内容,为继续学习化学键打下了知识铺垫。从而引出本节所要学习的内容,学生更易于接受和掌握。
环节二:思考氯化氢的形成过程并通过演示图片,有趣而且生动的展示了氯化氢的形成。引发了学生的感官刺激。学生对化学键的概念有了较深刻的理解。并运用所学知识书写共价化合物的电子式。了解结构式、球棍模型和比例模型。
环节三:思考对于碳原子的可能成键类型,并观察几种含碳化合物分子结构式,分析各化合物分子中碳原子能形成几个共价键,碳原子之间的连接方式。对学生的思维提出了挑战,学生们通过合作交流,不断的思考。培养了学生的发散思维。
环节四:学完了共价键的相关内容学生对其有了一定的理解。然而初步掌握化学键时易将共价键和离子键相互混淆。通过展示共价键和离子键的特点,相互比较区别他们的不同点,罗列成表。通过比较的方法,学生不仅可以区别同门的不同,
而且对本节的内容有了更深刻的认识。最后通过习题巩固本节知识内容。
【教学过程】
【教师】:同学们你们还记得上一节课所学习的内容吗?上一节课学习中同学们都学到了那些内容呢?
【学生】:离子键。
【教师】:对!离子键是一种常见的化学键,那么现在检测一下大家所学过的知识。首先什么是化学键?
【学生】:阴、阳离子通过静电作用结合成的化学键。
【教师】:哪些元素化合物化合是可以形成离子键的呢?
【学生】:一般是活泼金属和活泼非金属离子间能形成。
【教师】:现在开火车,一人举一例离子化合物。
【学生】:(开火车举例)
【教师】:同学们掌握的很好,现在老师加大难度。请5位同学用电子式表示出K、S、K+、S2-、K2S。下面的同学自己在草稿纸上完成。
【学生】:(完成电子式,教师下去巡视并进行指导)
【教师】:最后完成ppt上的两个选择题。
【学生】:(一完成选择,教师进行引导)
【教师】:活泼的金属元素和活泼非金属元素化合时形成离子键。那么假如对于都是非金属呢?例如氢气和氯气,你认为H2 、Cl2形成的HCl和NaCl一样吗?两种非金属元素之间化合时,能形成离子键吗?为什么?
【学生】:(思考并尝试回答)
【教师】:这节课我们就来学习化学键(板书:化学键)。现在同学们带着这个问题看看PPT上展示的图片演示,看看究竟同时活泼气体的氯气和氢气如何形成氯化氢。正所谓是狭路相逢勇者胜。
(教师描述:对于只有一个电子的氢气它呢,更想得到一个电子达到最外层是2的稳定状态。而对于最外层是7的氯气只要得到一个电子同样达到最外层是8的稳定状态。两者相互挣脱,既然都要得到一个电子,那么他们是否可以达成一个共识呢?同学给他们处处主意解决这两者的矛盾。)
【学生】:共同电子对。(同学们各自发表自己的观点,教师总结。)
【教师】:真是一个不错的主意。结果是不是这样呢?(引导学生看下一张ppt)
【教师】:那么现在通过这一动画给化学键下一个定义呢?什么是化学键?
【学生】:原子间通过共有电子对所形成的相互作用成为共价键。
【教师】:(板书:定义;原子间通过共有电子对所形成的相互作用)
【教师】:那么我们以前学过了用电子式来书写离子化合物。那么我们又将如何用电子式来书写共价化合物。一般要记住三个步骤,一排、二算、三画。以HCl为例,第一步,先分别画出H、C l原子的电子式,将他们排成行。第二步,计算它们需要共用几对电子才能分别达到稳定状态。H、Cl原子需共用一对电子。所以分别各自拿出一个电子。第三步,将他们共用电子对画分子中间。要特别注意的一点是共价键没有电子得失不能用【】。
(板书:电子式表示共价键)
【教师】:现在牛刀小试,根据HCl的形成方式,写出共价分子电子式。
【学生】:(学生上讲台书写,教师从旁指导)。
【教师】:同学们会发现刚才我们学习的一共价键结合的两个原子都是一对的,假如多对的又该怎么画呢。如氮气之间是三对电子。请同学们牛刀再试。
【学生】:(学生加大了难度,可能会出现错误,教师发挥引导作用。)
【教师】:除了用电子式外,我们还可以用结构式来表示共价分子。在结构式中,原子间的一条短线表示一对共用电子。除此之外还有球棍模型,比例模型。像这些分子中相邻分子之间都是以共价键直接相连,就称为共价化合物。特别注意的是假如分子当中出现了离子键,那么这一化合物就属于离子化合物。(完成课后习题p17第4题。时间多时可当堂完成)
【教师】:刚才我们解决了什么是共价键。那么我们又该如何知道两个原子是否是共价键呢?
【学生】:两个原子相互都要得到电子达到稳定结构。
【教师】:很好!这样的判断方法非常好。那么假如对于碳原子,它的最外层是4。那么根据碳原子的结构,你们认为它与其它元素易以共价键结合还是离子键结合?
【学生】:都有可能。
【教师】:对,都有可能。但常见的多以共价键与其他原子结合。例如教材P14-15观察与思考所呈现的日常常见的含碳化合物。同学们继续观察碳原子能形成几个共价键。他们是怎么连接的。
【学生】:一个碳原子形成四个共用电子对,碳原子之间通过一对,两队,或三对共用电子相结合。分别构成碳碳单键,双键,叁键,碳环。所以自然间当中含碳元素是最多的原因之一就是连接方式的多样性。
【教师】:到现在呢?我们已经学完了本节课的内容。我们试着与上一节所学的离子键相互比较。前后桌讨论化学键和离子键的异同点。
【学生】:(学生激烈讨论,找出异同)
【教师】:请哪位小组派个代表站起来发表你们的成果。
【学生】:(尽可能讲述异同点)
【教师】:现在大家一起看看这一张表格。看看他们的不同点。
【学生】:(通过表格对化学键有了总的认识。)
【教师】:现在我们来完成接下来几个题目来巩固本节课内容。
【板书设计】
回顾旧知
引人新知
视频演示
分析问题
观察思考
交流讨论
相互比较
巩固提高
回顾旧知,引人新知
图片演示,分析问题知
观察思考,交流讨论
相互比较,巩固提高
