同分异构现象
图片预览




文档简介
1.3.2同分异构现象
【教材分析】:
本节课选自化学必修2专题1微观结构与物质的多样性第三单元微粒之间的相互作用力第二节同分异构现象。本节课内容是本专题的一个重点内容,本节课是继同分异形现象之后继续认识微观世界的复杂性。并为下一节学习不同类型的晶体,打下了坚实的基础储备。起作用可谓是承上启下。也帮助学生能够更好的了解微观世界。
从教材的内容来看,教材先开展一个有趣的活动探究,让学生通过这一类的活动。认识到相同的分子式可以组成不同的分子结构。体会同分异形体和同分异形现象这一概念。为接下来的教学活动开展埋下伏笔。接着继续比较C4H10的两种的两种异形体正丁烷和异丁烷的性质,从而让学生认识到同分异构体之间的性质不同。最后让学生自己分析C2H6O的两种同分异构体不同。并结合相应的练习训练,学生真正做到知识的掌握和提高。
【学情分析】
兵法有云,知己知彼,百战不殆。不仅要备教材还要备学生。学生的差异性是客观存在的,只有了解了学生的一般特点才能更好的开展教学活动。本节内容针对的是一般高中的学生,长期以来的以学生为主的讲述和探究相结合的教学方式,学生已经初步的掌握了观察现象发现问题、提出问题、交流讨论、归纳反思的能力。而这为本节课的顺利开展打下了基础。而之前已经学过了同素异形现象这一相关的内容为学习本节课提供了一定的知识储备,学生更容易掌握。然而对于青春期的他们思维比较活跃,好奇心比较强,特别是对于实验现象有求知欲和探索欲。但缺乏一种科学的学习方法,逻辑思维与本节课的内容要求尚有一定的距离。而我就紧抓学生的好奇心、激发他们的学习兴趣,逐步引导他们的认识,降低难度,掌握本节课的内容。
【教学目标】
根据《普通高中新课程标准要求大纲》,《教学指导意见》我制定了一下三维目标。
一、知识与技能:认识同分异构现象和同分异构体;知道有机物存在同分异构现象;了解同分异构体产生的原因,并能区分同位素、同素异形体和同分异构体。
二、过程与方法:运用活动与探索的方法,学习同分异构现象;通过三维空间结构模型,认识同分异构体的空间结构。
三、情感、态度、价值观:使学生再次体会化学物质“结构决定性质,性质体现结构”的特点认识到事物的复杂性。
【重难点】
教学重点:以正丁烷、异丁烷为例,使学生认识到由于微观结构的不同而导致同分异构现象
教学难点:各种同分异构现象
【教法和学法】
教法:讲授法、活动探究。
学法:自学导学、实验探究、合作交流。
【课时】一课时
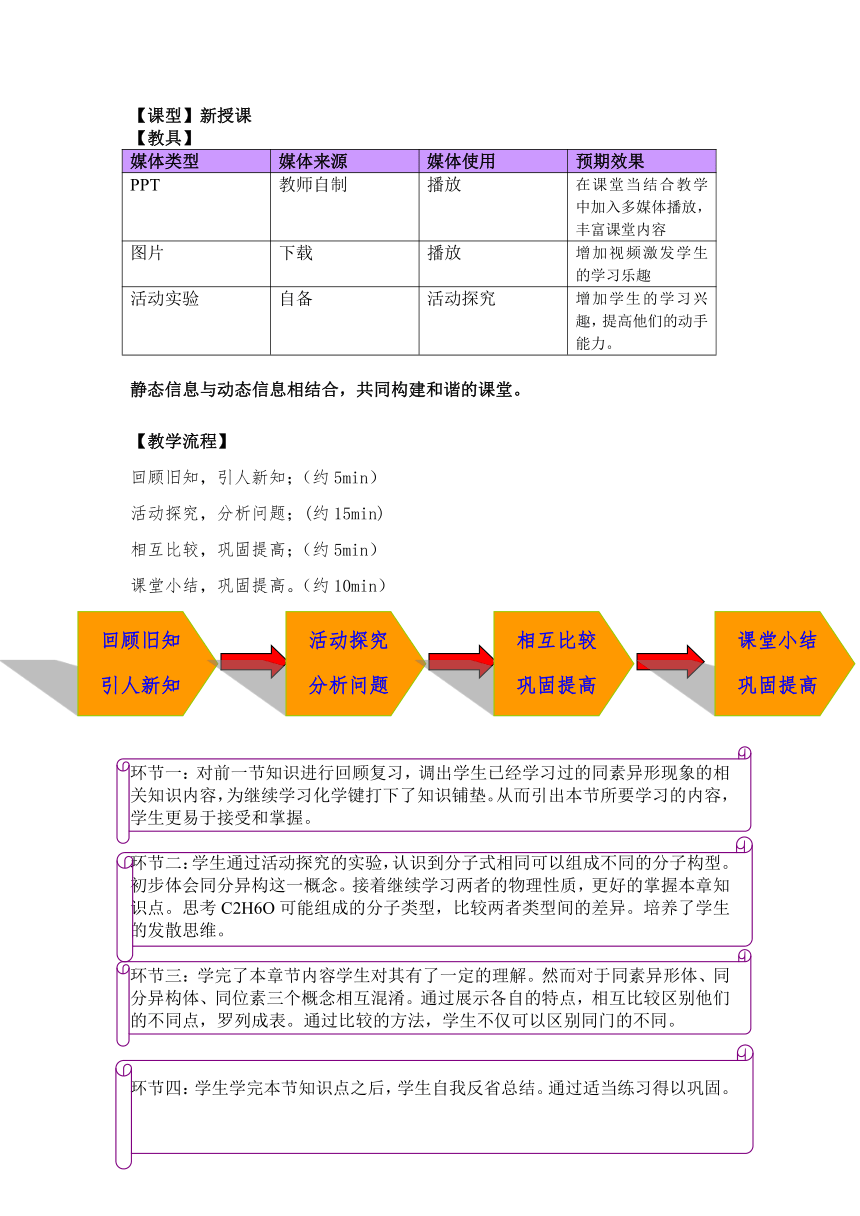
【课型】新授课
【教具】
媒体类型 媒体来源 媒体使用 预期效果
PPT 教师自制 播放 在课堂当结合教学中加入多媒体播放,丰富课堂内容
图片 下载 播放 增加视频激发学生的学习乐趣
活动实验 自备 活动探究 增加学生的学习兴趣,提高他们的动手能力。
静态信息与动态信息相结合,共同构建和谐的课堂。
【教学流程】
回顾旧知,引人新知;(约5min)
活动探究,分析问题;(约15min)
相互比较,巩固提高;(约5min)
课堂小结,巩固提高。(约10min)
环节一:对前一节知识进行回顾复习,调出学生已经学习过的同素异形现象的相关知识内容,为继续学习化学键打下了知识铺垫。从而引出本节所要学习的内容,学生更易于接受和掌握。
环节二:学生通过活动探究的实验,认识到分子式相同可以组成不同的分子构型。初步体会同分异构这一概念。接着继续学习两者的物理性质,更好的掌握本章知识点。思考C2H6O可能组成的分子类型,比较两者类型间的差异。培养了学生
的发散思维。
环节三:学完了本章节内容学生对其有了一定的理解。然而对于同素异形体、同分异构体、同位素三个概念相互混淆。通过展示各自的特点,相互比较区别他们的不同点,罗列成表。通过比较的方法,学生不仅可以区别同门的不同。
环节四:学生学完本节知识点之后,学生自我反省总结。通过适当练习得以巩固。
【教学过程】
【教师】上节课,我们学习了同素异形现象。我们知道同素异形现象是构成自然界物质种类繁多的原因之一。
下面先请大家看幻灯片。这里有几组十分相像的物质。请大家来说一说它们之间是一种怎么样的关系呢?
1 1H 和 2 1H ?
【学生】 同位素
【教师】同位素的研究对象是什么呢?
【学生】 原子
【教师】是怎么样的原子?互为同位素的原子什么相同,什么不同?
【教师】 质子数相同,中子数(或者质量数)不同
没错,同位素是指质子数相同,中子数不同的原子。那除了1 1H 和 2 1H之外,还有哪些原子也是互为同位素的呢?
【学生】 12 6C和14 6C、16 8O和18 8O还有35 Cl和37 Cl等等
【教师】好,那我们来看第二组物质
O3 和 O2 ?
【学生】 同素异形体
【教师】同素异形体的研究对象又是什么呢?
【学生】 单质
【教师】同样请大家举一些同素异形体的例子
【学生】 金刚石和石墨、红磷和白磷
【教师】很好,刚才我们研究了原子、单质那么接下来要要研究化合物了。那么对于分子相同的化合物是不是一定就是同一种物质呢?今天就来学习同分异构现象。
下面我们来了解一个化学小常识:
【幻灯片】
化学小常识:
为了达到稳定结构,H只能形成单键,而C可以形成单键、双键和三键。当C成单键时,可以连四个单键。在C4H10中,C只以单键的形式存在。在C5H12中C同样也是以单键的形式存在的。
【教师】这几句话是什么意思呢?我们一起来看一看。
C的最外层有几个电子啊?
【学生】 4个
【教师】那为了达到八电子的稳定结构,一个C需要形成几个共价键?
【学生】 4个
【教师】那么这四个共价键可以如何排列组合呢?
H
举个例子:CH4。CH4的电子式怎么写啊: H C H
H
对于CH4中的C来说,C和4个H各公用一对电子,形成一个共价键。所以对于这个C来说,它是形成了4各单键:
C
再来看CO2,CO2的结构式怎么写啊: O C O
对于CO2来说,一个C和两个O各共用两对共用电子对,各形成两个双键。这是C的另一种成键形式,形成两个双键 : C
那么C能不能和N一样形成三键呢?
假如两个C形成这样的一种形式: C C
是不是也符合要求呢?
【学生】 符合
【教师】所以说这种成键方式也是可以的
那除了这三种以外,还有C还有其他成键方式吗?
【学生】{学生回答不出来,则给以提示}
【教师】这样可以吗? C
是不是也符合要求啊!
这是C几种主要的成键形式。根据这个知识,我们来思考这么一个问题:假如我给你4个C,它们有几种成键形式呢?
先来举个例子:
C C C C
这种情况下,对于各个C来说是不是都符合了八电子的稳定结构呢?
【学生】 是的
【教师】所以这种写法是正确的,那也有些同学可能会这么问:旁边的这些键连出来怎么半?大家看化学小常识上的第一句:H可以形成单键。那我们是不是可以在这里连上H。现在,我们先不连H,只考虑C。这是都成单键的情况。那如果有双键呢?我们一起来看一下:
C C C C
那么除了这两种之外还有其他的成键方式吗?大家拿出纸和笔写写看,看看能写出几种
【写出板书】
C的成键特点:
(1)形成4个共价键
(2)可以形成单键、双键、三键}
【学生】{几分钟后,请几位学生到黑板上来写,再对他们所写出来的进行分析,再进行总结:按从简单到复杂的顺序分别列出以下的几种成键情况:全部为单键(包括成环的情况)、有双键、有三键、成空间立体结构的情况,列出来之后,再加上H,发现它们的分子式分别为:C4H10,、C4H8、C4H6、C4H4,虽然它们的分子式相同,但是它们的结构完全不同}
【教师】请大家用金橘表示C原子,用红枣表示H原子,摆出分子式为C5H12的这种物质的空间结构。在动手之前,先给大家一点小提示:在C5H12中,C原子都是以单键的形式存在的。
下面给大家五分钟时间,请大家以四个人一组,开始我们的小游戏。
{在幻灯片上放出游戏的规则和要求,并请学生帮忙发材料:每四个人一组,每组5个金橘,12颗红枣,16根牙签}
【学生】{学生动手游戏,教师巡视}
{在1到2分钟后,很多组都搭出了正戊烷的结构。拿一组同学的模型到讲台上,在黑板上写出它的结构式。}
【教师】很多组都摆出了这种结构,大家思考以下,除了这种以外,还有没有别的结构形式呢?
【学生】{学生摆出正丁烷和异丁烷的结构形式,再把这些结构式都写在黑板上,分别命名:正戊烷、新戊烷和异戊烷,再次强调这是分子式相同,结构不同的物质}
【教师】现在看这这两个模型。左边的这个叫正丁烷,右边的这个叫异丁烷。它们又是一种什么样的关系呢?
它们是不是同位素啊?
【学生】 不是
【教师】追问:为什么呢?
【学生】 不是原子
【教师】那是不是同素异形体呢?
【学生】 也不是
【教师】为什么?
【学生】不是单质
【教师】那它们到底是什么关系呢?我们先来看看它们有什么共同的地方呢?从原子的种类和个数这个角度看,正丁烷有几个C原子啊?我们一起来数一数
(和学生一起数)4个,那异丁烷有几个C原子呢?XX你来数数看
【学生】 4个
【教师】也是4个,除了C以外,还有什么原子?
【学生】 H原子
【教师】那它们各有几个H原子呢?XX、XX你们来数数看
【学生】 10个
【教师】它们还有其他原子吗?
【学生】 没有
【教师】对于只有C、H元素构成的物质来说,它们的C和H原子的数目都是相同的,那说明它们的什么是相同的啊?
【学生】 分子式
【教师】那我们再来看看它们有哪里是不同的呢?
【学生】 结构
【教师】很好。那么对于正丁烷和异丁烷这两种物质来说,我们可以发现:它们的分子式是相同的,而结构是不同的。那我们就把这种分子式相同,结构不同的化合物叫做同分异构体。
[板书]
1、同分异构体:分子式相同而结构不同的化合物互称为同分异构体。
大家特别注意,同分异构体不同于同位素和同素异形体最大的特点就在于:它的研究对象是化合物,而且是分子式相同,结构不同的这么一些化合物。所以如果给你一组物质判断它们是不是同分异构体,我们要做这么三个工作:
首先,看它们是不是化合物。如果它们都是化合物,再看它们的分子式是不是相同,如果它们的分子式也相同,再看看它们的结构是不是相同,如果它们连结构也相同就说明它们是同一种物质,结构不同的就可以把它们互称为同分异构体。
所以说正丁烷和异丁烷应该互称为同分异构体,同时我们可以把这种现象,也就是化合物具有相同的分子式,但具有不同结构的现象称为同分异构现象。
[板书]
2、同分异构现象:化合物具有相同的分子式,但具有不同结构的现象
而这种同分异构这种现象广泛存在于自然界中,是有机化合物种类繁多的原因之一。
【教师】不管是正丁烷和异丁烷还是正戊烷、异戊烷和新戊烷,它们虽然分子式是相同的,但是结构却是截然不同的。在化学中有这么一条规律:结构决定性质。既然它们的结构不同,那它们的性质会不会也有所区别呢?我们来看这两个表格:
物质 正丁烷 异丁烷
熔点/℃ -138.4 -159.6
沸点/℃ -0.5 -11.7
物质 正戊烷 异戊烷 新戊烷
熔点/℃ -129.7 -159.6 -20
沸点/℃ 36.1 27.9 9.5
从这两个表格中,大家首先得到一个怎么样的信息?
【学生】 它们之间的熔沸点不同
【教师】那么熔沸点是物质什么性质呢
【学生】 物理性质
【教师】那就可以说明:同分异构体之间的物理性质是不同的,其实除了物理性质,它们的化学性质也是不同的。这一点我们会在以后的有机化学中进一步进行学习。
所以我们就可以得出这样一个结论:同分异构体之间的性质是不同的
【板书】 同分异构体之间性质不同
那大家再看这两种物质:乙醇和甲醚:
物质 乙醇 甲醚
分子式 C2H6O C2H6O
熔点/℃ -117.3 -38.5
沸点/℃ 78 -23
它们的分子式都是C2H6O,但却具有不同的熔沸点。根据我们刚才的学习,它们两者之间应该有什么样的关系?
【学生】 同分异构体
【教师】那请大家写出分子式为C2H6O的两种结构。那首先我们要先解决O原子的成键特点。O的最外层有几个电子啊?
【学生】 6个
【教师】那它可以形成单键、双键、三键中的哪几种呢?
【学生】 单键和双键
【教师】几个单键和几个双键
【学生】 两个单键和一个双键
【教师】好,那大家动手试试看写一写C2H6O的两种结构
{几分钟后}
老师请几位同学把自己写出来的写到黑板上去。
(分析学生写出来的结构式,改正错误的地方,去掉重复的,剩下两个结构式)
乙醇 CH3-CH2-O-H
甲醚 CH3-O-CH3
【教师】:到现在呢?我们已经学完了本节课的内容。我们试着与以前所学过的同位素和同素异形体相互比较。前后桌讨论他们的异同点异同点。
【学生】:(学生激烈讨论,找出异同)
【教师】:请哪位小组派个代表站起来发表你们的成果。
【学生】:(尽可能讲述异同点)
【教师】:现在大家一起看看这一张表格。看看他们的不同点。
【学生】:(通过表格对化学键有了总的认识。)
【教师】:现在我们来完成接下来几个题目来巩固本节课内容。
【板书设计】
课堂小结
巩固提高
相互比较
巩固提高
观察思考
交流讨论
活动探究
分析问题
回顾旧知
引人新知
回顾旧知,引人新知
活动探究,分析问题知
相互比较,巩固提高
课堂小结,巩固提高
【教材分析】:
本节课选自化学必修2专题1微观结构与物质的多样性第三单元微粒之间的相互作用力第二节同分异构现象。本节课内容是本专题的一个重点内容,本节课是继同分异形现象之后继续认识微观世界的复杂性。并为下一节学习不同类型的晶体,打下了坚实的基础储备。起作用可谓是承上启下。也帮助学生能够更好的了解微观世界。
从教材的内容来看,教材先开展一个有趣的活动探究,让学生通过这一类的活动。认识到相同的分子式可以组成不同的分子结构。体会同分异形体和同分异形现象这一概念。为接下来的教学活动开展埋下伏笔。接着继续比较C4H10的两种的两种异形体正丁烷和异丁烷的性质,从而让学生认识到同分异构体之间的性质不同。最后让学生自己分析C2H6O的两种同分异构体不同。并结合相应的练习训练,学生真正做到知识的掌握和提高。
【学情分析】
兵法有云,知己知彼,百战不殆。不仅要备教材还要备学生。学生的差异性是客观存在的,只有了解了学生的一般特点才能更好的开展教学活动。本节内容针对的是一般高中的学生,长期以来的以学生为主的讲述和探究相结合的教学方式,学生已经初步的掌握了观察现象发现问题、提出问题、交流讨论、归纳反思的能力。而这为本节课的顺利开展打下了基础。而之前已经学过了同素异形现象这一相关的内容为学习本节课提供了一定的知识储备,学生更容易掌握。然而对于青春期的他们思维比较活跃,好奇心比较强,特别是对于实验现象有求知欲和探索欲。但缺乏一种科学的学习方法,逻辑思维与本节课的内容要求尚有一定的距离。而我就紧抓学生的好奇心、激发他们的学习兴趣,逐步引导他们的认识,降低难度,掌握本节课的内容。
【教学目标】
根据《普通高中新课程标准要求大纲》,《教学指导意见》我制定了一下三维目标。
一、知识与技能:认识同分异构现象和同分异构体;知道有机物存在同分异构现象;了解同分异构体产生的原因,并能区分同位素、同素异形体和同分异构体。
二、过程与方法:运用活动与探索的方法,学习同分异构现象;通过三维空间结构模型,认识同分异构体的空间结构。
三、情感、态度、价值观:使学生再次体会化学物质“结构决定性质,性质体现结构”的特点认识到事物的复杂性。
【重难点】
教学重点:以正丁烷、异丁烷为例,使学生认识到由于微观结构的不同而导致同分异构现象
教学难点:各种同分异构现象
【教法和学法】
教法:讲授法、活动探究。
学法:自学导学、实验探究、合作交流。
【课时】一课时
【课型】新授课
【教具】
媒体类型 媒体来源 媒体使用 预期效果
PPT 教师自制 播放 在课堂当结合教学中加入多媒体播放,丰富课堂内容
图片 下载 播放 增加视频激发学生的学习乐趣
活动实验 自备 活动探究 增加学生的学习兴趣,提高他们的动手能力。
静态信息与动态信息相结合,共同构建和谐的课堂。
【教学流程】
回顾旧知,引人新知;(约5min)
活动探究,分析问题;(约15min)
相互比较,巩固提高;(约5min)
课堂小结,巩固提高。(约10min)
环节一:对前一节知识进行回顾复习,调出学生已经学习过的同素异形现象的相关知识内容,为继续学习化学键打下了知识铺垫。从而引出本节所要学习的内容,学生更易于接受和掌握。
环节二:学生通过活动探究的实验,认识到分子式相同可以组成不同的分子构型。初步体会同分异构这一概念。接着继续学习两者的物理性质,更好的掌握本章知识点。思考C2H6O可能组成的分子类型,比较两者类型间的差异。培养了学生
的发散思维。
环节三:学完了本章节内容学生对其有了一定的理解。然而对于同素异形体、同分异构体、同位素三个概念相互混淆。通过展示各自的特点,相互比较区别他们的不同点,罗列成表。通过比较的方法,学生不仅可以区别同门的不同。
环节四:学生学完本节知识点之后,学生自我反省总结。通过适当练习得以巩固。
【教学过程】
【教师】上节课,我们学习了同素异形现象。我们知道同素异形现象是构成自然界物质种类繁多的原因之一。
下面先请大家看幻灯片。这里有几组十分相像的物质。请大家来说一说它们之间是一种怎么样的关系呢?
1 1H 和 2 1H ?
【学生】 同位素
【教师】同位素的研究对象是什么呢?
【学生】 原子
【教师】是怎么样的原子?互为同位素的原子什么相同,什么不同?
【教师】 质子数相同,中子数(或者质量数)不同
没错,同位素是指质子数相同,中子数不同的原子。那除了1 1H 和 2 1H之外,还有哪些原子也是互为同位素的呢?
【学生】 12 6C和14 6C、16 8O和18 8O还有35 Cl和37 Cl等等
【教师】好,那我们来看第二组物质
O3 和 O2 ?
【学生】 同素异形体
【教师】同素异形体的研究对象又是什么呢?
【学生】 单质
【教师】同样请大家举一些同素异形体的例子
【学生】 金刚石和石墨、红磷和白磷
【教师】很好,刚才我们研究了原子、单质那么接下来要要研究化合物了。那么对于分子相同的化合物是不是一定就是同一种物质呢?今天就来学习同分异构现象。
下面我们来了解一个化学小常识:
【幻灯片】
化学小常识:
为了达到稳定结构,H只能形成单键,而C可以形成单键、双键和三键。当C成单键时,可以连四个单键。在C4H10中,C只以单键的形式存在。在C5H12中C同样也是以单键的形式存在的。
【教师】这几句话是什么意思呢?我们一起来看一看。
C的最外层有几个电子啊?
【学生】 4个
【教师】那为了达到八电子的稳定结构,一个C需要形成几个共价键?
【学生】 4个
【教师】那么这四个共价键可以如何排列组合呢?
H
举个例子:CH4。CH4的电子式怎么写啊: H C H
H
对于CH4中的C来说,C和4个H各公用一对电子,形成一个共价键。所以对于这个C来说,它是形成了4各单键:
C
再来看CO2,CO2的结构式怎么写啊: O C O
对于CO2来说,一个C和两个O各共用两对共用电子对,各形成两个双键。这是C的另一种成键形式,形成两个双键 : C
那么C能不能和N一样形成三键呢?
假如两个C形成这样的一种形式: C C
是不是也符合要求呢?
【学生】 符合
【教师】所以说这种成键方式也是可以的
那除了这三种以外,还有C还有其他成键方式吗?
【学生】{学生回答不出来,则给以提示}
【教师】这样可以吗? C
是不是也符合要求啊!
这是C几种主要的成键形式。根据这个知识,我们来思考这么一个问题:假如我给你4个C,它们有几种成键形式呢?
先来举个例子:
C C C C
这种情况下,对于各个C来说是不是都符合了八电子的稳定结构呢?
【学生】 是的
【教师】所以这种写法是正确的,那也有些同学可能会这么问:旁边的这些键连出来怎么半?大家看化学小常识上的第一句:H可以形成单键。那我们是不是可以在这里连上H。现在,我们先不连H,只考虑C。这是都成单键的情况。那如果有双键呢?我们一起来看一下:
C C C C
那么除了这两种之外还有其他的成键方式吗?大家拿出纸和笔写写看,看看能写出几种
【写出板书】
C的成键特点:
(1)形成4个共价键
(2)可以形成单键、双键、三键}
【学生】{几分钟后,请几位学生到黑板上来写,再对他们所写出来的进行分析,再进行总结:按从简单到复杂的顺序分别列出以下的几种成键情况:全部为单键(包括成环的情况)、有双键、有三键、成空间立体结构的情况,列出来之后,再加上H,发现它们的分子式分别为:C4H10,、C4H8、C4H6、C4H4,虽然它们的分子式相同,但是它们的结构完全不同}
【教师】请大家用金橘表示C原子,用红枣表示H原子,摆出分子式为C5H12的这种物质的空间结构。在动手之前,先给大家一点小提示:在C5H12中,C原子都是以单键的形式存在的。
下面给大家五分钟时间,请大家以四个人一组,开始我们的小游戏。
{在幻灯片上放出游戏的规则和要求,并请学生帮忙发材料:每四个人一组,每组5个金橘,12颗红枣,16根牙签}
【学生】{学生动手游戏,教师巡视}
{在1到2分钟后,很多组都搭出了正戊烷的结构。拿一组同学的模型到讲台上,在黑板上写出它的结构式。}
【教师】很多组都摆出了这种结构,大家思考以下,除了这种以外,还有没有别的结构形式呢?
【学生】{学生摆出正丁烷和异丁烷的结构形式,再把这些结构式都写在黑板上,分别命名:正戊烷、新戊烷和异戊烷,再次强调这是分子式相同,结构不同的物质}
【教师】现在看这这两个模型。左边的这个叫正丁烷,右边的这个叫异丁烷。它们又是一种什么样的关系呢?
它们是不是同位素啊?
【学生】 不是
【教师】追问:为什么呢?
【学生】 不是原子
【教师】那是不是同素异形体呢?
【学生】 也不是
【教师】为什么?
【学生】不是单质
【教师】那它们到底是什么关系呢?我们先来看看它们有什么共同的地方呢?从原子的种类和个数这个角度看,正丁烷有几个C原子啊?我们一起来数一数
(和学生一起数)4个,那异丁烷有几个C原子呢?XX你来数数看
【学生】 4个
【教师】也是4个,除了C以外,还有什么原子?
【学生】 H原子
【教师】那它们各有几个H原子呢?XX、XX你们来数数看
【学生】 10个
【教师】它们还有其他原子吗?
【学生】 没有
【教师】对于只有C、H元素构成的物质来说,它们的C和H原子的数目都是相同的,那说明它们的什么是相同的啊?
【学生】 分子式
【教师】那我们再来看看它们有哪里是不同的呢?
【学生】 结构
【教师】很好。那么对于正丁烷和异丁烷这两种物质来说,我们可以发现:它们的分子式是相同的,而结构是不同的。那我们就把这种分子式相同,结构不同的化合物叫做同分异构体。
[板书]
1、同分异构体:分子式相同而结构不同的化合物互称为同分异构体。
大家特别注意,同分异构体不同于同位素和同素异形体最大的特点就在于:它的研究对象是化合物,而且是分子式相同,结构不同的这么一些化合物。所以如果给你一组物质判断它们是不是同分异构体,我们要做这么三个工作:
首先,看它们是不是化合物。如果它们都是化合物,再看它们的分子式是不是相同,如果它们的分子式也相同,再看看它们的结构是不是相同,如果它们连结构也相同就说明它们是同一种物质,结构不同的就可以把它们互称为同分异构体。
所以说正丁烷和异丁烷应该互称为同分异构体,同时我们可以把这种现象,也就是化合物具有相同的分子式,但具有不同结构的现象称为同分异构现象。
[板书]
2、同分异构现象:化合物具有相同的分子式,但具有不同结构的现象
而这种同分异构这种现象广泛存在于自然界中,是有机化合物种类繁多的原因之一。
【教师】不管是正丁烷和异丁烷还是正戊烷、异戊烷和新戊烷,它们虽然分子式是相同的,但是结构却是截然不同的。在化学中有这么一条规律:结构决定性质。既然它们的结构不同,那它们的性质会不会也有所区别呢?我们来看这两个表格:
物质 正丁烷 异丁烷
熔点/℃ -138.4 -159.6
沸点/℃ -0.5 -11.7
物质 正戊烷 异戊烷 新戊烷
熔点/℃ -129.7 -159.6 -20
沸点/℃ 36.1 27.9 9.5
从这两个表格中,大家首先得到一个怎么样的信息?
【学生】 它们之间的熔沸点不同
【教师】那么熔沸点是物质什么性质呢
【学生】 物理性质
【教师】那就可以说明:同分异构体之间的物理性质是不同的,其实除了物理性质,它们的化学性质也是不同的。这一点我们会在以后的有机化学中进一步进行学习。
所以我们就可以得出这样一个结论:同分异构体之间的性质是不同的
【板书】 同分异构体之间性质不同
那大家再看这两种物质:乙醇和甲醚:
物质 乙醇 甲醚
分子式 C2H6O C2H6O
熔点/℃ -117.3 -38.5
沸点/℃ 78 -23
它们的分子式都是C2H6O,但却具有不同的熔沸点。根据我们刚才的学习,它们两者之间应该有什么样的关系?
【学生】 同分异构体
【教师】那请大家写出分子式为C2H6O的两种结构。那首先我们要先解决O原子的成键特点。O的最外层有几个电子啊?
【学生】 6个
【教师】那它可以形成单键、双键、三键中的哪几种呢?
【学生】 单键和双键
【教师】几个单键和几个双键
【学生】 两个单键和一个双键
【教师】好,那大家动手试试看写一写C2H6O的两种结构
{几分钟后}
老师请几位同学把自己写出来的写到黑板上去。
(分析学生写出来的结构式,改正错误的地方,去掉重复的,剩下两个结构式)
乙醇 CH3-CH2-O-H
甲醚 CH3-O-CH3
【教师】:到现在呢?我们已经学完了本节课的内容。我们试着与以前所学过的同位素和同素异形体相互比较。前后桌讨论他们的异同点异同点。
【学生】:(学生激烈讨论,找出异同)
【教师】:请哪位小组派个代表站起来发表你们的成果。
【学生】:(尽可能讲述异同点)
【教师】:现在大家一起看看这一张表格。看看他们的不同点。
【学生】:(通过表格对化学键有了总的认识。)
【教师】:现在我们来完成接下来几个题目来巩固本节课内容。
【板书设计】
课堂小结
巩固提高
相互比较
巩固提高
观察思考
交流讨论
活动探究
分析问题
回顾旧知
引人新知
回顾旧知,引人新知
活动探究,分析问题知
相互比较,巩固提高
课堂小结,巩固提高
