江苏省盱眙中学2010-2011学年度高二上学期期末考试化学(选修)
文档属性
| 名称 | 江苏省盱眙中学2010-2011学年度高二上学期期末考试化学(选修) |

|
|
| 格式 | zip | ||
| 文件大小 | 171.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-02-28 00:00:00 | ||
图片预览

文档简介
盱眙中学2010—2011学年度高二第一学期期末考试
化学试题(选修)
试卷满分:120分 考试时间:100分钟
说明:本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共20题。
注意事项:
1、测试主要范围:苏教版选修4、选修5专题1、专题2、专题3第1单元。
2、答卷前,考生务必将密封线内各项填写清楚。
3、选择题用2B铅笔填涂在答题卡上。非选择题用钢笔或圆珠笔直接在试卷上答题。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23
选择题(共42分)
单项选择题:本题包括7小题,每小题2分,共计14分。每小题只有一个选项符合题意。
1.下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸
B.合成氨工业中使用铁触媒做催化剂
C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
D.热的纯碱溶液去油污效果好
2.下列物质的类别与所含官能团都正确的是 ( )
A.、酚类、–OH B.CH3 CH2Cl、 卤代烃、–X
C.、羧酸类、–COOH D.、羧酸类、–CHO
3.下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g) + O2(g)=2H2O(g) △H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B.已知P4(白磷,s) =4P(红磷,s) △H<0,则白磷比红磷稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq) + HCl(aq) =NaCl(aq) + H2O(l) △H=-57.4 kJ/mol
D.已知2C(s) + 2O2(g)=2CO2(g) △H1;2C(s) + O2(g)=2CO(g) △H2。则△H1>△H2
4.下列有机物的命名正确的是 ( )
A.3,3-二甲基丁烷 B.3-甲基-2-丁烯
C.2-乙基戊烷 D. 名称为1,4-二甲苯
5.在一定的温度下, 将 2mol SO2和1mol O2充入一定容密闭容器中, 在催化剂存在下进行下列反应: 2SO2(g) + O2(g) 2SO3(g) △H=―197 kJ/mol, 当达到平衡状态时, 下列说法中正确的是 ( )
A.生成 SO3 2 mol B.放出 197 kJ 的热量
C.吸收197 kJ 的热量 D. SO2 和 SO3 共有 2 mol
6.常温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.pH=1的溶液中:Fe2+、NO3-、Na+、SO42-
B.水电离出的c(H+) =10-12mol/L中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
D.无色溶液中:K+、Fe3+、SO42-、HCO3-
7.下列说法正确的是 ( )
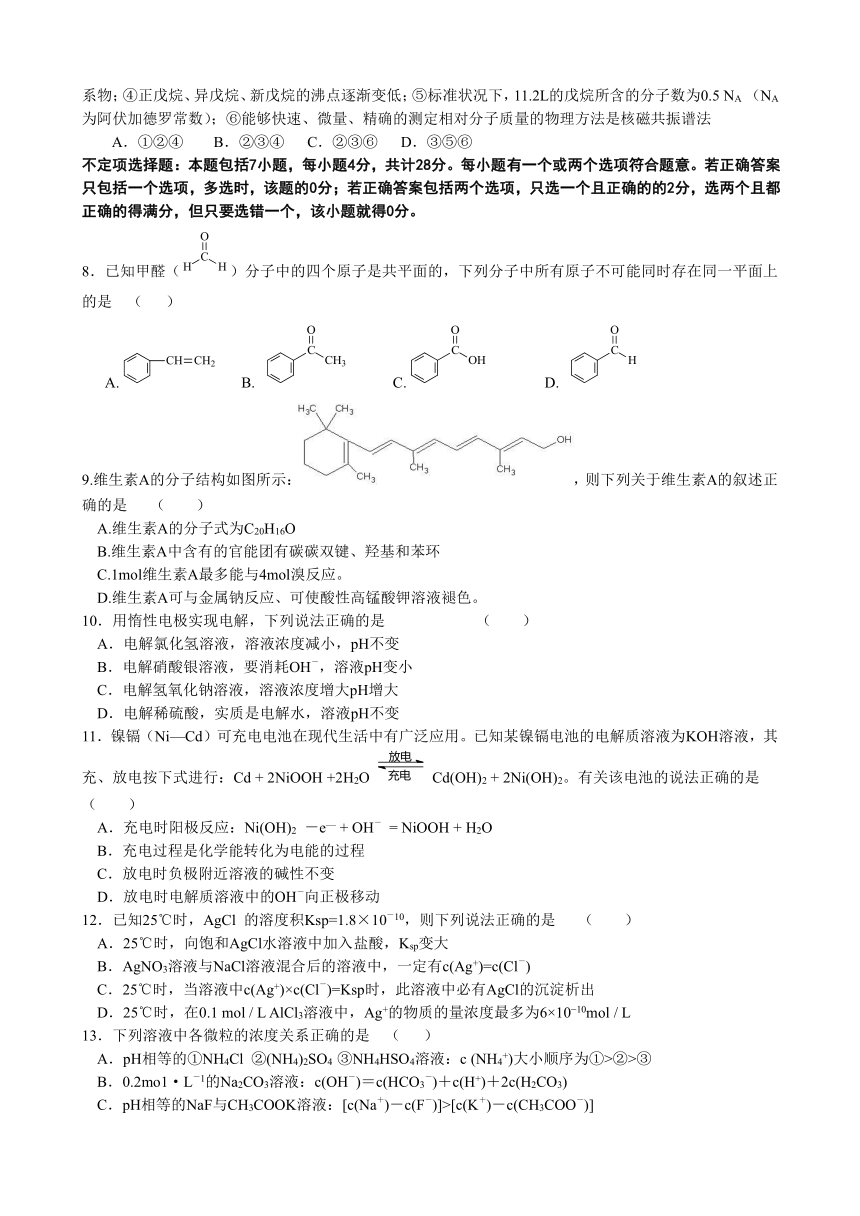
①CH3-CH=CH2和CH2=CH2的最简式相同;②CH≡CH和C6H6含碳量相同;③ C2H4和C3H6一定互为同系物;④正戊烷、异戊烷、新戊烷的沸点逐渐变低;⑤标准状况下,11.2L的戊烷所含的分子数为0.5 NA (NA为阿伏加德罗常数);⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法
A.①②④ B.②③④ C.②③⑥ D.③⑤⑥
不定项选择题:本题包括7小题,每小题4分,共计28分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题的0分;若正确答案包括两个选项,只选一个且正确的的2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
8.已知甲醛()分子中的四个原子是共平面的,下列分子中所有原子不可能同时存在同一平面上的是 ( )
A. B. C. D.
9.维生素A的分子结构如图所示:,则下列关于维生素A的叙述正确的是 ( )
A.维生素A的分子式为C20H16O
B.维生素A中含有的官能团有碳碳双键、羟基和苯环
C.1mol维生素A最多能与4mol溴反应。
D.维生素A可与金属钠反应、可使酸性高锰酸钾溶液褪色。
10.用惰性电极实现电解,下列说法正确的是 ( )
A.电解氯化氢溶液,溶液浓度减小,pH不变
B.电解硝酸银溶液,要消耗OH-,溶液pH变小
C.电解氢氧化钠溶液,溶液浓度增大pH增大
D.电解稀硫酸,实质是电解水,溶液pH不变
11.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH +2H2OCd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是 ( )
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
12.已知25℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是 ( )
A.25℃时,向饱和AgCl水溶液中加入盐酸,Ksp变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.25℃时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.25℃时,在0.1 mol / L AlCl3溶液中,Ag+的物质的量浓度最多为6×10 10mol / L
13.下列溶液中各微粒的浓度关系正确的是 ( )
A.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液:c (NH4+)大小顺序为①>②>③
B.0.2mo1·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C.pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
D.某温度下0.1mol L-1的NaHB溶液中,c(Na+)= 0.1mol L-1≥c(B2-)
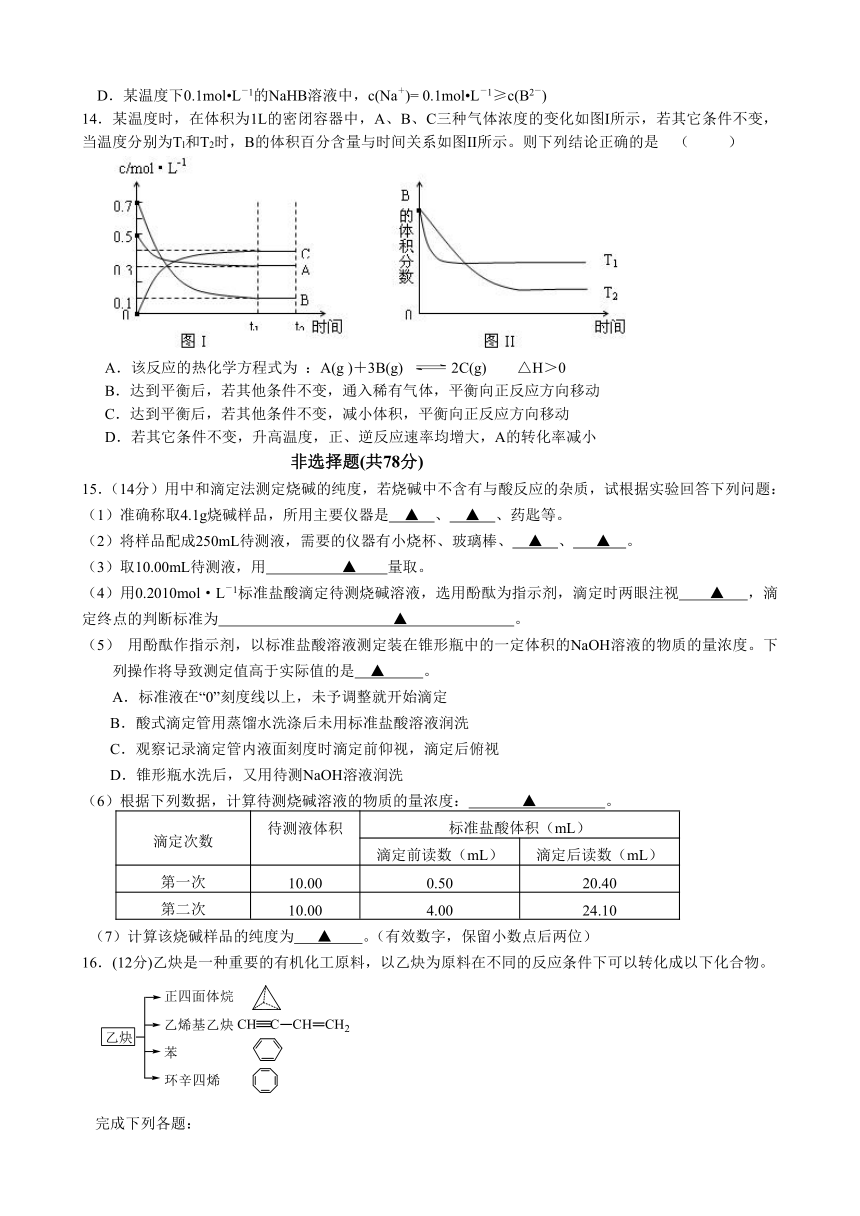
14.某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是 ( )
A.该反应的热化学方程式为 :A(g )+3B(g) 2C(g) △H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
非选择题(共78分)
15.(14分)用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答下列问题:
(1)准确称取4.1g烧碱样品,所用主要仪器是 ▲ 、 ▲ 、药匙等。
(2)将样品配成250mL待测液,需要的仪器有小烧杯、玻璃棒、 ▲ 、 ▲ 。
(3)取10.00mL待测液,用 ▲ 量取。
(4)用0.2010mol·L―1标准盐酸滴定待测烧碱溶液,选用酚酞为指示剂,滴定时两眼注视 ▲ ,滴定终点的判断标准为 ▲ 。
(5) 用酚酞作指示剂,以标准盐酸溶液测定装在锥形瓶中的一定体积的NaOH溶液的物质的量浓度。下列操作将导致测定值高于实际值的是 ▲ 。
A.标准液在“0”刻度线以上,未予调整就开始滴定
B.酸式滴定管用蒸馏水洗涤后未用标准盐酸溶液润洗
C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视
D.锥形瓶水洗后,又用待测NaOH溶液润洗
(6)根据下列数据,计算待测烧碱溶液的物质的量浓度: ▲ 。
滴定次数 待测液体积 标准盐酸体积(mL)
滴定前读数(mL) 滴定后读数(mL)
第一次 10.00 0.50 20.40
第二次 10.00 4.00 24.10
(7)计算该烧碱样品的纯度为 ▲ 。(有效数字,保留小数点后两位)
16.(12分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。
完成下列各题:
(1)写出实验室制取乙炔的化学方程式 ▲ 。
(2)正四面体烷的分子式为 ▲ ,其二氯取代产物有 ▲ 种。
(3)关于乙烯基乙炔分子的说法错误的是 ▲ 。
a.能使酸性KMnO4溶液褪色 b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(4)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式: ▲ ,其在一定条件下可生成高分子化合物,写出该反应的化学方程式 ▲ 。
(5)“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如右图所示: “立方烷”的分子式是_____▲___;该立方烷的二氯代物具有同分异构体的数目是__▲_种。
(6)写出与苯互为同系物且一氯代物只有两种(含侧链)的物质的结构简式(举两例): ▲ 、 ▲ 。
17. (12分)由碳、氢、氧3种元素组成的有机物A,能与金属钠反应放出氢气,还能新制氢氧化铜反应生成砖红色沉淀。A的相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。
(1)A中有2个不同的含氧官能团,其名称是 ▲ 、 ▲ 。
(2)A的分子式是 ▲ 。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是 ▲ 。
②A不能发生的反应是(填写序号字母) ▲ 。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
③A做核磁共振普氢时会产生 ▲ 个吸收峰。
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是:
▲ 。
18.(12分)已知某溶液中只存在OH―、H+、CH3COO―、Na+四种离子,某同学推测其离子浓度大小顺序有以下几种:①c(Na+)>c(CH3COO―) >c(OH―)>c(H+); ②c(Na+)>c(CH3COO―) >c(H+)>c(OH―); ③c(CH3COO―)>c(Na+)>c(H+)>c(OH―); ④c(Na+)> c(OH―) >c(CH3COO―)> c(H+)。试回答下列问题:
⑴上述关系一定不正确的是 ▲ (填序号)
⑵若溶液中只有一种溶质,则该溶质为 ▲ ,该溶液中离子浓度的大小关系为 ▲ (填序号);
⑶若关系③正确,则溶液中溶质为 ▲ 。
⑷若四种离子浓度关系有c(CH3COO―)=c(Na+),则该溶液显 ▲ (填“酸性”、“碱性”、“中性”)。
⑸25℃,pH=a的醋酸VamL与pH=14―a的氢氧化钠溶液VbmL混合,若溶液显中性,则Va
▲ Vb(填“>”、“<”、“=”、“无法确定”)
19.(13分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中,N2(g)+3H2(g) 2NH3(g) △H=―92 kJ/mol
①该反应的平衡常数K的表达式为:K= ▲ 。升高温度,K值 ▲ (填“增大”、“减小”或“不变”)。
②为提高氢气的转化率,宜采取的措施有 ▲ 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
③下列关于合成氨说法正确是 ▲ 。(填字母)
A.使用催化剂可以提高NH3的产率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0,△S>0,故合成氨反应一定能自发进行
D.降低温度,平衡向逆反应方向移动
④在一定温度和压强下,将H2和N2按3∶2(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为15%,此时H2的转化率为 ▲ 。
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2═2N2+6H2O。写出负极的电极反应式为 ▲ 。
(3)氨催化氧化法是工业是制取硝酸的重要方法。已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= ―1266.8kJ/mol;N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol;试写出氨高温催化氧化生成NO的热化学方程式: ▲ 。
20.(15分)近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
⑴ 混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1kJ。则该反应的热化学方程式为 ▲ 。
⑵ 混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将___▲___(填“增大”、“不变”或“减小”),该电极的电极反应式为 ▲ 。
⑶ 汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度: CO(g)+1/2O2(g) CO2(g)。
① 某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。
容器编号 c(CO)/mo1·L―1 c (O2)/mol·L―1 c (CO2)/mol·L―1 v(正)和v (逆)比较
I 2.0×10―4 4.0×10―4 4.0×10―2 v(正)=v(逆)
Ⅱ 1.0×10―4 4.0×10―4 6.0×10―2
则该温度下,反应:CO(g)+1/2O2(g) CO2(g)的平衡常数K的数值为 ▲ ,上表中容器Ⅱ中v(正) ▲ v(逆)(填“<”、“>”或“=”)。
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10 5mol·L l和1.0×10-4mol·L l。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10 4mol·L 1,最终尾气中CO的浓度明显减小,该补燃过程中CO的转化率为____▲____。
盱眙中学2012届高二第一学期期末考试
化学试题(选修)
参考答案及评分标准:
1.B 2.B 3.C 4.D 5.D 6.C 7.A
8.B 9.D 10.B、C 11.A 12.D 13.B、D 14. C、D
15.(14分)(1)托盘天平、小烧杯;(2)250mL容量瓶、胶头滴管;
(3)碱式滴定管;(4)锥形瓶中溶液的颜色的变化; 直到滴入一滴标准盐酸时溶液立即由浅红色变成无色,且半分钟内无变化,则达到滴定终点(2分);
(5)B、D(2分)
(6)0.4020mol/L(2分);(7)98.05%(2分,其余每空1分)。
16.(12分,化学方程式每个2分,其余每空1分)(1)CaC2+2H2O→CH≡CH↑+Ca(OH)2;(2)C4H4;1。 (3)d。
(4) , ;
(5)C8H8、3;
(6) ,(合理即给分)。
17.(12分官能团每个1分,其他每空2分)(1)羟基 醛基(2)C5H10O2
(3)
① ②b ③4
(4)CH3COOCH(CH3)2+H2O CH3COOH+(CH3)2CH-OH
18.(12分,每空2分) (1) ②; (2) CH3COONa、①;(3) CH3COONa和CH3COOH;(4)中性; (5) <。
19.(13分)(1)①(1分),减小(1分);②CDE(3分,其余每空2分);③B;④32.6%。
(2)2NH3+6OH--6e-=N2+6H2O;
(3)4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H= ―905.8kJ/mol。
20.(15分)⑴ C8H18(l)+25/2O2(g) = 8CO2(g)+9H2O(g) △H=―5121.9 kJ·mol 1;(2分)
⑵ 增大(2分), NiOOH + H2O + e—= Ni(OH)2 + OH—;(2分)
⑶ ① 1×104(3分)、<(3分);② 89%(3分)。
盱眙中学2010-2011学年度高二第一学期期末考试
化学答题纸
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效!
15.(14分)
(1)所用主要仪器是 、 、药匙等;
(2)需要的仪器有小烧杯、玻璃棒、 、 ;
(3)用 量取。
(4)滴定时两眼注视 ,滴定终点的判断标准为 。
(5)下列操作将导致测定值高于实际值的是 。
(6)烧碱溶液的物质的量浓度: 。
(7)纯度为 。
16.(12分)
(1)化学方程式 。
(2)正四面体烷的分子式为 ,其二氯取代产物有 种。
(3)关于乙烯基乙炔分子的说法错误的是 。
(4)结构简式: ,其在一定条件下可生成高分子化合物,写出该反应的化学方程式 。
(5)“立方烷”的分子式是___________;同分异构体的数目是____种。
(6)写出与苯互为同系物且一氯代物只有两种(含侧链)的物质的结构简式(举两例): 、 。
17.(12分)(1)A中有2个不同的含氧官能团,其名称是 、 。
(2)A的分子式是 。
(3)①A的结构简式是 。
②A不能发生的反应是(填写序号字母) 。
③A做核磁共振普氢时会产生 个吸收峰。
(4)化学方程式是: 。
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效!
18.(12分)
⑴上述关系一定不正确的是 (填序号)
⑵该溶质为 ,该溶液中离子浓度的大小关系为 (填序号);
⑶若关系③正确,则溶液中溶质为 。
⑷则该溶液显 (填“酸性”、“碱性”、“中性”)。
⑸则Va Vb(填“>”、“<”、“=”、“无法确定”)
19.(13分)
(1)①表达式为:K= 。K值 (填“增大”、“减小”或“不变”)。
②宜采取的措施有 。(填字母)
③下列关于合成氨说法正确是 。(填字母)
④此时H2的转化率为 。
(2)写出负极电极反应式 。
(3)热化学方程式: 。
20.(15分)
(1)热化学方程式为_______________________ 。
(2)乙电极周围溶液的pH将_______(填“增大”、“不变”或“减小”),该电极的电极反应式为 。
(3)①平衡常数K的值为 ,上表中容器Ⅱ中v(正) v(逆)(填“<”、“>”或“=”)。
②该补燃过程中CO的转化率为_________ 。
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效!
化学试题(选修)
试卷满分:120分 考试时间:100分钟
说明:本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共20题。
注意事项:
1、测试主要范围:苏教版选修4、选修5专题1、专题2、专题3第1单元。
2、答卷前,考生务必将密封线内各项填写清楚。
3、选择题用2B铅笔填涂在答题卡上。非选择题用钢笔或圆珠笔直接在试卷上答题。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23
选择题(共42分)
单项选择题:本题包括7小题,每小题2分,共计14分。每小题只有一个选项符合题意。
1.下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸
B.合成氨工业中使用铁触媒做催化剂
C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体
D.热的纯碱溶液去油污效果好
2.下列物质的类别与所含官能团都正确的是 ( )
A.、酚类、–OH B.CH3 CH2Cl、 卤代烃、–X
C.、羧酸类、–COOH D.、羧酸类、–CHO
3.下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g) + O2(g)=2H2O(g) △H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B.已知P4(白磷,s) =4P(红磷,s) △H<0,则白磷比红磷稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq) + HCl(aq) =NaCl(aq) + H2O(l) △H=-57.4 kJ/mol
D.已知2C(s) + 2O2(g)=2CO2(g) △H1;2C(s) + O2(g)=2CO(g) △H2。则△H1>△H2
4.下列有机物的命名正确的是 ( )
A.3,3-二甲基丁烷 B.3-甲基-2-丁烯
C.2-乙基戊烷 D. 名称为1,4-二甲苯
5.在一定的温度下, 将 2mol SO2和1mol O2充入一定容密闭容器中, 在催化剂存在下进行下列反应: 2SO2(g) + O2(g) 2SO3(g) △H=―197 kJ/mol, 当达到平衡状态时, 下列说法中正确的是 ( )
A.生成 SO3 2 mol B.放出 197 kJ 的热量
C.吸收197 kJ 的热量 D. SO2 和 SO3 共有 2 mol
6.常温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.pH=1的溶液中:Fe2+、NO3-、Na+、SO42-
B.水电离出的c(H+) =10-12mol/L中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
D.无色溶液中:K+、Fe3+、SO42-、HCO3-
7.下列说法正确的是 ( )
①CH3-CH=CH2和CH2=CH2的最简式相同;②CH≡CH和C6H6含碳量相同;③ C2H4和C3H6一定互为同系物;④正戊烷、异戊烷、新戊烷的沸点逐渐变低;⑤标准状况下,11.2L的戊烷所含的分子数为0.5 NA (NA为阿伏加德罗常数);⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法
A.①②④ B.②③④ C.②③⑥ D.③⑤⑥
不定项选择题:本题包括7小题,每小题4分,共计28分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题的0分;若正确答案包括两个选项,只选一个且正确的的2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
8.已知甲醛()分子中的四个原子是共平面的,下列分子中所有原子不可能同时存在同一平面上的是 ( )
A. B. C. D.
9.维生素A的分子结构如图所示:,则下列关于维生素A的叙述正确的是 ( )
A.维生素A的分子式为C20H16O
B.维生素A中含有的官能团有碳碳双键、羟基和苯环
C.1mol维生素A最多能与4mol溴反应。
D.维生素A可与金属钠反应、可使酸性高锰酸钾溶液褪色。
10.用惰性电极实现电解,下列说法正确的是 ( )
A.电解氯化氢溶液,溶液浓度减小,pH不变
B.电解硝酸银溶液,要消耗OH-,溶液pH变小
C.电解氢氧化钠溶液,溶液浓度增大pH增大
D.电解稀硫酸,实质是电解水,溶液pH不变
11.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH +2H2OCd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是 ( )
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
12.已知25℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是 ( )
A.25℃时,向饱和AgCl水溶液中加入盐酸,Ksp变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.25℃时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.25℃时,在0.1 mol / L AlCl3溶液中,Ag+的物质的量浓度最多为6×10 10mol / L
13.下列溶液中各微粒的浓度关系正确的是 ( )
A.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液:c (NH4+)大小顺序为①>②>③
B.0.2mo1·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C.pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
D.某温度下0.1mol L-1的NaHB溶液中,c(Na+)= 0.1mol L-1≥c(B2-)
14.某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是 ( )
A.该反应的热化学方程式为 :A(g )+3B(g) 2C(g) △H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
非选择题(共78分)
15.(14分)用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答下列问题:
(1)准确称取4.1g烧碱样品,所用主要仪器是 ▲ 、 ▲ 、药匙等。
(2)将样品配成250mL待测液,需要的仪器有小烧杯、玻璃棒、 ▲ 、 ▲ 。
(3)取10.00mL待测液,用 ▲ 量取。
(4)用0.2010mol·L―1标准盐酸滴定待测烧碱溶液,选用酚酞为指示剂,滴定时两眼注视 ▲ ,滴定终点的判断标准为 ▲ 。
(5) 用酚酞作指示剂,以标准盐酸溶液测定装在锥形瓶中的一定体积的NaOH溶液的物质的量浓度。下列操作将导致测定值高于实际值的是 ▲ 。
A.标准液在“0”刻度线以上,未予调整就开始滴定
B.酸式滴定管用蒸馏水洗涤后未用标准盐酸溶液润洗
C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视
D.锥形瓶水洗后,又用待测NaOH溶液润洗
(6)根据下列数据,计算待测烧碱溶液的物质的量浓度: ▲ 。
滴定次数 待测液体积 标准盐酸体积(mL)
滴定前读数(mL) 滴定后读数(mL)
第一次 10.00 0.50 20.40
第二次 10.00 4.00 24.10
(7)计算该烧碱样品的纯度为 ▲ 。(有效数字,保留小数点后两位)
16.(12分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。
完成下列各题:
(1)写出实验室制取乙炔的化学方程式 ▲ 。
(2)正四面体烷的分子式为 ▲ ,其二氯取代产物有 ▲ 种。
(3)关于乙烯基乙炔分子的说法错误的是 ▲ 。
a.能使酸性KMnO4溶液褪色 b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(4)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式: ▲ ,其在一定条件下可生成高分子化合物,写出该反应的化学方程式 ▲ 。
(5)“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如右图所示: “立方烷”的分子式是_____▲___;该立方烷的二氯代物具有同分异构体的数目是__▲_种。
(6)写出与苯互为同系物且一氯代物只有两种(含侧链)的物质的结构简式(举两例): ▲ 、 ▲ 。
17. (12分)由碳、氢、氧3种元素组成的有机物A,能与金属钠反应放出氢气,还能新制氢氧化铜反应生成砖红色沉淀。A的相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。
(1)A中有2个不同的含氧官能团,其名称是 ▲ 、 ▲ 。
(2)A的分子式是 ▲ 。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是 ▲ 。
②A不能发生的反应是(填写序号字母) ▲ 。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
③A做核磁共振普氢时会产生 ▲ 个吸收峰。
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是:
▲ 。
18.(12分)已知某溶液中只存在OH―、H+、CH3COO―、Na+四种离子,某同学推测其离子浓度大小顺序有以下几种:①c(Na+)>c(CH3COO―) >c(OH―)>c(H+); ②c(Na+)>c(CH3COO―) >c(H+)>c(OH―); ③c(CH3COO―)>c(Na+)>c(H+)>c(OH―); ④c(Na+)> c(OH―) >c(CH3COO―)> c(H+)。试回答下列问题:
⑴上述关系一定不正确的是 ▲ (填序号)
⑵若溶液中只有一种溶质,则该溶质为 ▲ ,该溶液中离子浓度的大小关系为 ▲ (填序号);
⑶若关系③正确,则溶液中溶质为 ▲ 。
⑷若四种离子浓度关系有c(CH3COO―)=c(Na+),则该溶液显 ▲ (填“酸性”、“碱性”、“中性”)。
⑸25℃,pH=a的醋酸VamL与pH=14―a的氢氧化钠溶液VbmL混合,若溶液显中性,则Va
▲ Vb(填“>”、“<”、“=”、“无法确定”)
19.(13分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中,N2(g)+3H2(g) 2NH3(g) △H=―92 kJ/mol
①该反应的平衡常数K的表达式为:K= ▲ 。升高温度,K值 ▲ (填“增大”、“减小”或“不变”)。
②为提高氢气的转化率,宜采取的措施有 ▲ 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
③下列关于合成氨说法正确是 ▲ 。(填字母)
A.使用催化剂可以提高NH3的产率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0,△S>0,故合成氨反应一定能自发进行
D.降低温度,平衡向逆反应方向移动
④在一定温度和压强下,将H2和N2按3∶2(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为15%,此时H2的转化率为 ▲ 。
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2═2N2+6H2O。写出负极的电极反应式为 ▲ 。
(3)氨催化氧化法是工业是制取硝酸的重要方法。已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= ―1266.8kJ/mol;N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol;试写出氨高温催化氧化生成NO的热化学方程式: ▲ 。
20.(15分)近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
⑴ 混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1kJ。则该反应的热化学方程式为 ▲ 。
⑵ 混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将___▲___(填“增大”、“不变”或“减小”),该电极的电极反应式为 ▲ 。
⑶ 汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度: CO(g)+1/2O2(g) CO2(g)。
① 某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。
容器编号 c(CO)/mo1·L―1 c (O2)/mol·L―1 c (CO2)/mol·L―1 v(正)和v (逆)比较
I 2.0×10―4 4.0×10―4 4.0×10―2 v(正)=v(逆)
Ⅱ 1.0×10―4 4.0×10―4 6.0×10―2
则该温度下,反应:CO(g)+1/2O2(g) CO2(g)的平衡常数K的数值为 ▲ ,上表中容器Ⅱ中v(正) ▲ v(逆)(填“<”、“>”或“=”)。
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10 5mol·L l和1.0×10-4mol·L l。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10 4mol·L 1,最终尾气中CO的浓度明显减小,该补燃过程中CO的转化率为____▲____。
盱眙中学2012届高二第一学期期末考试
化学试题(选修)
参考答案及评分标准:
1.B 2.B 3.C 4.D 5.D 6.C 7.A
8.B 9.D 10.B、C 11.A 12.D 13.B、D 14. C、D
15.(14分)(1)托盘天平、小烧杯;(2)250mL容量瓶、胶头滴管;
(3)碱式滴定管;(4)锥形瓶中溶液的颜色的变化; 直到滴入一滴标准盐酸时溶液立即由浅红色变成无色,且半分钟内无变化,则达到滴定终点(2分);
(5)B、D(2分)
(6)0.4020mol/L(2分);(7)98.05%(2分,其余每空1分)。
16.(12分,化学方程式每个2分,其余每空1分)(1)CaC2+2H2O→CH≡CH↑+Ca(OH)2;(2)C4H4;1。 (3)d。
(4) , ;
(5)C8H8、3;
(6) ,(合理即给分)。
17.(12分官能团每个1分,其他每空2分)(1)羟基 醛基(2)C5H10O2
(3)
① ②b ③4
(4)CH3COOCH(CH3)2+H2O CH3COOH+(CH3)2CH-OH
18.(12分,每空2分) (1) ②; (2) CH3COONa、①;(3) CH3COONa和CH3COOH;(4)中性; (5) <。
19.(13分)(1)①(1分),减小(1分);②CDE(3分,其余每空2分);③B;④32.6%。
(2)2NH3+6OH--6e-=N2+6H2O;
(3)4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H= ―905.8kJ/mol。
20.(15分)⑴ C8H18(l)+25/2O2(g) = 8CO2(g)+9H2O(g) △H=―5121.9 kJ·mol 1;(2分)
⑵ 增大(2分), NiOOH + H2O + e—= Ni(OH)2 + OH—;(2分)
⑶ ① 1×104(3分)、<(3分);② 89%(3分)。
盱眙中学2010-2011学年度高二第一学期期末考试
化学答题纸
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效!
15.(14分)
(1)所用主要仪器是 、 、药匙等;
(2)需要的仪器有小烧杯、玻璃棒、 、 ;
(3)用 量取。
(4)滴定时两眼注视 ,滴定终点的判断标准为 。
(5)下列操作将导致测定值高于实际值的是 。
(6)烧碱溶液的物质的量浓度: 。
(7)纯度为 。
16.(12分)
(1)化学方程式 。
(2)正四面体烷的分子式为 ,其二氯取代产物有 种。
(3)关于乙烯基乙炔分子的说法错误的是 。
(4)结构简式: ,其在一定条件下可生成高分子化合物,写出该反应的化学方程式 。
(5)“立方烷”的分子式是___________;同分异构体的数目是____种。
(6)写出与苯互为同系物且一氯代物只有两种(含侧链)的物质的结构简式(举两例): 、 。
17.(12分)(1)A中有2个不同的含氧官能团,其名称是 、 。
(2)A的分子式是 。
(3)①A的结构简式是 。
②A不能发生的反应是(填写序号字母) 。
③A做核磁共振普氢时会产生 个吸收峰。
(4)化学方程式是: 。
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效!
18.(12分)
⑴上述关系一定不正确的是 (填序号)
⑵该溶质为 ,该溶液中离子浓度的大小关系为 (填序号);
⑶若关系③正确,则溶液中溶质为 。
⑷则该溶液显 (填“酸性”、“碱性”、“中性”)。
⑸则Va Vb(填“>”、“<”、“=”、“无法确定”)
19.(13分)
(1)①表达式为:K= 。K值 (填“增大”、“减小”或“不变”)。
②宜采取的措施有 。(填字母)
③下列关于合成氨说法正确是 。(填字母)
④此时H2的转化率为 。
(2)写出负极电极反应式 。
(3)热化学方程式: 。
20.(15分)
(1)热化学方程式为_______________________ 。
(2)乙电极周围溶液的pH将_______(填“增大”、“不变”或“减小”),该电极的电极反应式为 。
(3)①平衡常数K的值为 ,上表中容器Ⅱ中v(正) v(逆)(填“<”、“>”或“=”)。
②该补燃过程中CO的转化率为_________ 。
请在各题规定的黑色矩形区域内答题,超出该区域的答案无效!
同课章节目录
