化学:第一章第二节《化学计量在实验中的应用》课件ppt(人教版必修1)
文档属性
| 名称 | 化学:第一章第二节《化学计量在实验中的应用》课件ppt(人教版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 222.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-02-28 21:10:00 | ||
图片预览






文档简介
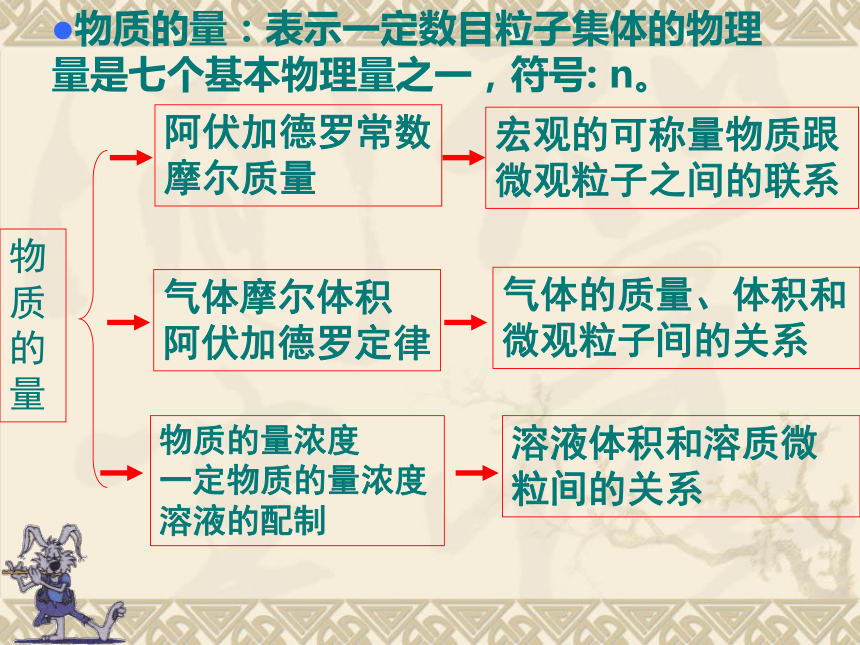
课件15张PPT。化学:第一章第二节《化学计量在实验中的应用》课件PPT(人教版必修1)第二讲 化学计量在实验中的应用 知识点1、物质的量及其单位——摩尔 物质的量阿伏加德罗常数
摩尔质量宏观的可称量物质跟微观粒子之间的联系气体摩尔体积
阿伏加德罗定律气体的质量、体积和微观粒子间的关系物质的量浓度
一定物质的量浓度溶液的配制溶液体积和溶质微粒间的关系物质的量:表示一定数目粒子集体的物理量是七个基本物理量之一,符号: n。 1.物质的量: (1)物质的量是国际单位制中 个基本物理量之一,科学上采用“物质的量”这个物理量把一定数目的原子、分子或离子等微观粒子与可称量的物质联系起来。它是一个口头上或书面表达都不可分割的专用名词,不可任意添减字,既是物质的质量,也是物质的数量。它是描述 的物理量。它的单位是 ,符号为 ,在希腊语中它是“堆量”的意思。 (2)物质的量只能用来描述 、 、 、 、 、 等微观粒子或微粒的特定组合,不能指宏观物质。 (3)物质的量的计量标准——阿伏加德罗常数 ,称阿伏加德罗常数,符号为 ,单位 。 当某物质中指定的粒子集体所含的指定粒子数与 相同时,则该粒子物质的量为1mol。如:1 mol H2O中含有H2O 数是 个,含氢原子 个 知识梳理课堂练习 1、含有1.5X1022个分子的物质,其质量为0.7g,求该物质的相对分子质量。
2、0.2gKClO3中所含的Cl原子数与多少克CaCl2中所含的Cl-离子个数相等? 思考:在实验室或 在生产中,对于气态物质常使用它的体积而不是质量。那么物质的量与气体体积之间有什么关系?1mol气态物质占据的体积有多大?2.摩尔(1)摩尔是物质的量的单位,它们的关系正如长度与米,质量与克一样。 (2)使用摩尔作单位时,应该用化学式符号指明粒子种类,而不能用名称。否则,概念模糊,意义不清。 知识点2、摩尔质量 1 mol 任何物质均含有阿伏加德罗个粒子,但由于不同的粒子质量不同,故1 mol 不同物质的质量一般也不同。C-12 的相对原子质量为 12 ,而 0.012kgC-12 所含的碳原子数为阿伏加德罗常数,即1 mol C-12 的质量为 12 g ,由此根据氧元素的相对原子质量可推出 1 mol O的质量。
2.摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量。摩尔质量在数值上等于1摩尔物质的质量。 阿伏加德罗常数:
符号:NA 单位:mol-1
每摩尔粒子集体所含粒子数目
计算时使用近似值6.02×1023
知识点3.物质的质量、物质的量、粒子数三者之间的关系 2、气体摩尔体积: ①定义:在一定的温度和压强下,单位物质的量的物质所占有的体积。表达式:Vm=V/n,常用单位:L/mol。 标况下,气体的摩尔体积约为22.4L/mol,这是在特定条件下的气体摩尔体积。 ②使用标况下气体摩尔体积应注意:a、条件:标准状况;b、单位:L/mol;c、适用范围:气体;d、数值约为22.4L/mol ③应用气体摩尔体积(标况)计算的几种情况: 气体体积V 物质的量n 质量m 摩尔质量M 密度ρ 式量Mr Ⅰ、据气体体积求其物质的量:n=V/22.4L/mol Ⅱ、据气体质量求其标况下体积:V=m (22.4L/mol)/M Ⅲ、据气体摩尔质量求其标况下密度:ρ=M/22.4L/mol Ⅳ、据气体标况下的体积求质量:m= VM/22.4L/mol Ⅴ、据标况下气体密度求式量:M=ρ22.4L/mol Ⅵ、据气体标况下的溶解度,求饱和溶液的质量分数、物质的量浓度(略) ④标准状况是指温度为0℃,压强为101KPa。 知识点5、物质的量浓度 (一)物质的量浓度 1.定义:单位体积的溶液中所含溶质的物质的量。 2.符号:CB常用单位:mol/L数学表达式 CB=nB/V
思考:(1)1.0L 1mol/LH2SO4中溶质以 存在,物质的量各是 。从其中取出100mL,溶液的物质的量浓度是 ,以上微粒物质的量浓度各是 。 (2)1.0L 1mol/L葡萄糖(C6H12O6)溶液中,溶质以 存在,质量是 g 。 (二)配制一定物质的量浓度的溶液。
配制 0.1L0.4mol/L的NaCl 溶液 1. 常用实验仪器:认识仪器——容量瓶;规格:100ml标识:200C 100ml;使用注意事项: ①每一容量瓶只能配置相应规定体积的溶液, ②使用前要检验是否漏水 ③容量瓶不能加热,不能久贮溶液,不能在瓶内溶解固体或稀释液体 2. 实验步骤: ①计算溶质的质量(或体积)。②称量。(固体一般用托盘天平,液体用量筒或滴定管)③溶解(或稀释)在烧杯中进行,并且恢复到室温。④移液,用玻璃棒引流,转移到容量瓶中。⑤洗涤,用蒸馏水洗烧杯与玻璃棒约2—3次,并将洗涤液注入容量瓶中,轻轻摇动容量瓶使溶液混和均匀。⑥定容:继续加水到液面在刻度线以下2-3cm时,改用胶头滴管逐滴加水,使溶液凹面恰好与刻度线相切。⑦摇匀:反复颠倒摇匀。 将配制好的溶液倒入试剂瓶中,贴好标签备用。 选择哪种规格的量筒?哪种规格的容量瓶?3. 误差分析:
知识网络:粒子个数N 物质的量n 质量m
→ ← → ← ↑ ↓ ↓ ↑气体体积V 物质的量浓度CB ×Vm ÷Vm ×NA ÷NA ×M ÷M ×V液 ÷V液 摩尔质量的计算:1. 由定义 M=2. 标准状况下的气体3. 同温同压下的气体 4. =m混÷n总物质的量浓度的有关计算公式:3.溶液稀释和混合:稀释 C浓V浓=C稀V稀混合 C总V总=C1V1+ C2V2
摩尔质量宏观的可称量物质跟微观粒子之间的联系气体摩尔体积
阿伏加德罗定律气体的质量、体积和微观粒子间的关系物质的量浓度
一定物质的量浓度溶液的配制溶液体积和溶质微粒间的关系物质的量:表示一定数目粒子集体的物理量是七个基本物理量之一,符号: n。 1.物质的量: (1)物质的量是国际单位制中 个基本物理量之一,科学上采用“物质的量”这个物理量把一定数目的原子、分子或离子等微观粒子与可称量的物质联系起来。它是一个口头上或书面表达都不可分割的专用名词,不可任意添减字,既是物质的质量,也是物质的数量。它是描述 的物理量。它的单位是 ,符号为 ,在希腊语中它是“堆量”的意思。 (2)物质的量只能用来描述 、 、 、 、 、 等微观粒子或微粒的特定组合,不能指宏观物质。 (3)物质的量的计量标准——阿伏加德罗常数 ,称阿伏加德罗常数,符号为 ,单位 。 当某物质中指定的粒子集体所含的指定粒子数与 相同时,则该粒子物质的量为1mol。如:1 mol H2O中含有H2O 数是 个,含氢原子 个 知识梳理课堂练习 1、含有1.5X1022个分子的物质,其质量为0.7g,求该物质的相对分子质量。
2、0.2gKClO3中所含的Cl原子数与多少克CaCl2中所含的Cl-离子个数相等? 思考:在实验室或 在生产中,对于气态物质常使用它的体积而不是质量。那么物质的量与气体体积之间有什么关系?1mol气态物质占据的体积有多大?2.摩尔(1)摩尔是物质的量的单位,它们的关系正如长度与米,质量与克一样。 (2)使用摩尔作单位时,应该用化学式符号指明粒子种类,而不能用名称。否则,概念模糊,意义不清。 知识点2、摩尔质量 1 mol 任何物质均含有阿伏加德罗个粒子,但由于不同的粒子质量不同,故1 mol 不同物质的质量一般也不同。C-12 的相对原子质量为 12 ,而 0.012kgC-12 所含的碳原子数为阿伏加德罗常数,即1 mol C-12 的质量为 12 g ,由此根据氧元素的相对原子质量可推出 1 mol O的质量。
2.摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量。摩尔质量在数值上等于1摩尔物质的质量。 阿伏加德罗常数:
符号:NA 单位:mol-1
每摩尔粒子集体所含粒子数目
计算时使用近似值6.02×1023
知识点3.物质的质量、物质的量、粒子数三者之间的关系 2、气体摩尔体积: ①定义:在一定的温度和压强下,单位物质的量的物质所占有的体积。表达式:Vm=V/n,常用单位:L/mol。 标况下,气体的摩尔体积约为22.4L/mol,这是在特定条件下的气体摩尔体积。 ②使用标况下气体摩尔体积应注意:a、条件:标准状况;b、单位:L/mol;c、适用范围:气体;d、数值约为22.4L/mol ③应用气体摩尔体积(标况)计算的几种情况: 气体体积V 物质的量n 质量m 摩尔质量M 密度ρ 式量Mr Ⅰ、据气体体积求其物质的量:n=V/22.4L/mol Ⅱ、据气体质量求其标况下体积:V=m (22.4L/mol)/M Ⅲ、据气体摩尔质量求其标况下密度:ρ=M/22.4L/mol Ⅳ、据气体标况下的体积求质量:m= VM/22.4L/mol Ⅴ、据标况下气体密度求式量:M=ρ22.4L/mol Ⅵ、据气体标况下的溶解度,求饱和溶液的质量分数、物质的量浓度(略) ④标准状况是指温度为0℃,压强为101KPa。 知识点5、物质的量浓度 (一)物质的量浓度 1.定义:单位体积的溶液中所含溶质的物质的量。 2.符号:CB常用单位:mol/L数学表达式 CB=nB/V
思考:(1)1.0L 1mol/LH2SO4中溶质以 存在,物质的量各是 。从其中取出100mL,溶液的物质的量浓度是 ,以上微粒物质的量浓度各是 。 (2)1.0L 1mol/L葡萄糖(C6H12O6)溶液中,溶质以 存在,质量是 g 。 (二)配制一定物质的量浓度的溶液。
配制 0.1L0.4mol/L的NaCl 溶液 1. 常用实验仪器:认识仪器——容量瓶;规格:100ml标识:200C 100ml;使用注意事项: ①每一容量瓶只能配置相应规定体积的溶液, ②使用前要检验是否漏水 ③容量瓶不能加热,不能久贮溶液,不能在瓶内溶解固体或稀释液体 2. 实验步骤: ①计算溶质的质量(或体积)。②称量。(固体一般用托盘天平,液体用量筒或滴定管)③溶解(或稀释)在烧杯中进行,并且恢复到室温。④移液,用玻璃棒引流,转移到容量瓶中。⑤洗涤,用蒸馏水洗烧杯与玻璃棒约2—3次,并将洗涤液注入容量瓶中,轻轻摇动容量瓶使溶液混和均匀。⑥定容:继续加水到液面在刻度线以下2-3cm时,改用胶头滴管逐滴加水,使溶液凹面恰好与刻度线相切。⑦摇匀:反复颠倒摇匀。 将配制好的溶液倒入试剂瓶中,贴好标签备用。 选择哪种规格的量筒?哪种规格的容量瓶?3. 误差分析:
知识网络:粒子个数N 物质的量n 质量m
→ ← → ← ↑ ↓ ↓ ↑气体体积V 物质的量浓度CB ×Vm ÷Vm ×NA ÷NA ×M ÷M ×V液 ÷V液 摩尔质量的计算:1. 由定义 M=2. 标准状况下的气体3. 同温同压下的气体 4. =m混÷n总物质的量浓度的有关计算公式:3.溶液稀释和混合:稀释 C浓V浓=C稀V稀混合 C总V总=C1V1+ C2V2
