盐类的水解
图片预览





文档简介
课件14张PPT。盐类的水解说课 教材的地位及作用:(1)本节内容涉及的知识面较宽,综合性较强,它是前面已学过的平衡移动原理、弱电解质的电离,水的电离平衡等知识的综合利用
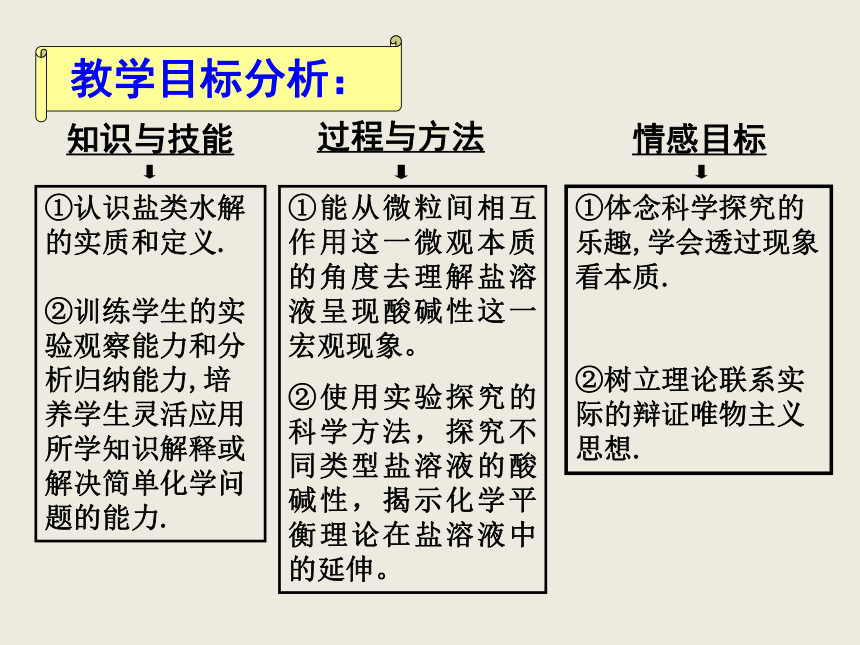
(2)从知识结构上讲,盐类水解平衡是继弱酸、弱碱及水的电离平衡体系之后的又一个电解质溶液的平衡体系,利于学生形成完整的电解质溶液的平衡体系。重点难点分析:重点:盐类水解的本质。 难点:盐类水解的本质。知识与技能过程与方法 情感目标①认识盐类水解的实质和定义.
②训练学生的实验观察能力和分析归纳能力,培养学生灵活应用所学知识解释或解决简单化学问题的能力.①能从微粒间相互作用这一微观本质的角度去理解盐溶液呈现酸碱性这一宏观现象。
②使用实验探究的科学方法,探究不同类型盐溶液的酸碱性,揭示化学平衡理论在盐溶液中的延伸。 教学目标分析:①体念科学探究的乐趣,学会透过现象看本质.
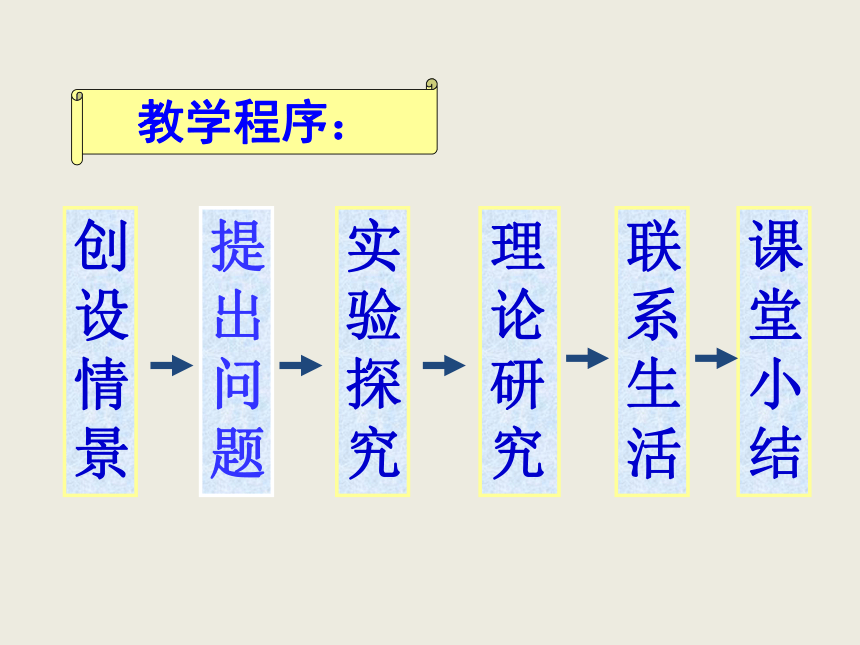
②树立理论联系实际的辩证唯物主义思想. 教学程序:清水白纸写红字提出问题Na2CO3溶液怎么能使酚酞变红呢?
难道Na2CO3溶液显碱性吗?
盐类溶液有没有可能还会显酸性呢?它们的酸碱性会如何呢盐溶液?实验探究检测下列溶液的酸碱性 , 填写下表:中性碱性酸性H2O?酸性碱性中性CH3COONa = CH3COO- + Na+探讨与分析 (以CH3COONa溶液例):C(H+) < C(OH-)NH4Cl = NH4+ + Cl-探讨与分析(以NH4Cl溶液为例):C(OH-) < C(H+) 1.定义:在溶液中盐电离出来的离子跟水
所电离出来的H+ 或OH-结合生成
弱电解质的反应,叫做盐类的水解。一、 盐类的水解 2.条件: 生成弱电解质3.本质: 破坏了水的电离平衡,促进了水的电离.哪些盐能发生水解?
哪些盐不能发生水解?
盐水解后显酸性或碱性,有什么规律?
我们下次课
再见
(2)从知识结构上讲,盐类水解平衡是继弱酸、弱碱及水的电离平衡体系之后的又一个电解质溶液的平衡体系,利于学生形成完整的电解质溶液的平衡体系。重点难点分析:重点:盐类水解的本质。 难点:盐类水解的本质。知识与技能过程与方法 情感目标①认识盐类水解的实质和定义.
②训练学生的实验观察能力和分析归纳能力,培养学生灵活应用所学知识解释或解决简单化学问题的能力.①能从微粒间相互作用这一微观本质的角度去理解盐溶液呈现酸碱性这一宏观现象。
②使用实验探究的科学方法,探究不同类型盐溶液的酸碱性,揭示化学平衡理论在盐溶液中的延伸。 教学目标分析:①体念科学探究的乐趣,学会透过现象看本质.
②树立理论联系实际的辩证唯物主义思想. 教学程序:清水白纸写红字提出问题Na2CO3溶液怎么能使酚酞变红呢?
难道Na2CO3溶液显碱性吗?
盐类溶液有没有可能还会显酸性呢?它们的酸碱性会如何呢盐溶液?实验探究检测下列溶液的酸碱性 , 填写下表:中性碱性酸性H2O?酸性碱性中性CH3COONa = CH3COO- + Na+探讨与分析 (以CH3COONa溶液例):C(H+) < C(OH-)NH4Cl = NH4+ + Cl-探讨与分析(以NH4Cl溶液为例):C(OH-) < C(H+) 1.定义:在溶液中盐电离出来的离子跟水
所电离出来的H+ 或OH-结合生成
弱电解质的反应,叫做盐类的水解。一、 盐类的水解 2.条件: 生成弱电解质3.本质: 破坏了水的电离平衡,促进了水的电离.哪些盐能发生水解?
哪些盐不能发生水解?
盐水解后显酸性或碱性,有什么规律?
我们下次课
再见
