化学同步精练精析:410 化学是认识和创造物质的科学(苏教版必修2)
文档属性
| 名称 | 化学同步精练精析:410 化学是认识和创造物质的科学(苏教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 615.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-03-08 00:00:00 | ||
图片预览




文档简介
4.1 化学是认识和创造物质的科学(苏教版必修2)
【典例导悟】
【典例1】(多选)下列说法正确的是
A.有些活泼金属,如铝可作热还原法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收旧金属可以重新制成金属或它们的化合物
【思路点拨】解答本题要注意以下两点:
(1)根据金属的活泼性选择冶炼方法。
(2)回收废旧金属进行再利用的意义。
【自主解答】选A、D。本题主要考查金属的冶炼方法。铝可以作还原剂冶炼一些高熔点的金属,如
2Al+Cr2O32Cr+Al2O3,A项正确;电解NaCl溶液不能得到金属钠,金属钠应该用电解熔融NaCl的方法制取,B项错;铝是活泼金属,很难用还原剂把它还原出来,应该用电解熔融Al2O3的方法制备,C项错;D项正确。
【解析】选B。在金属活动性顺序表中,H排在Mg的后面,所以H2不能把MgO中的Mg置换出来。
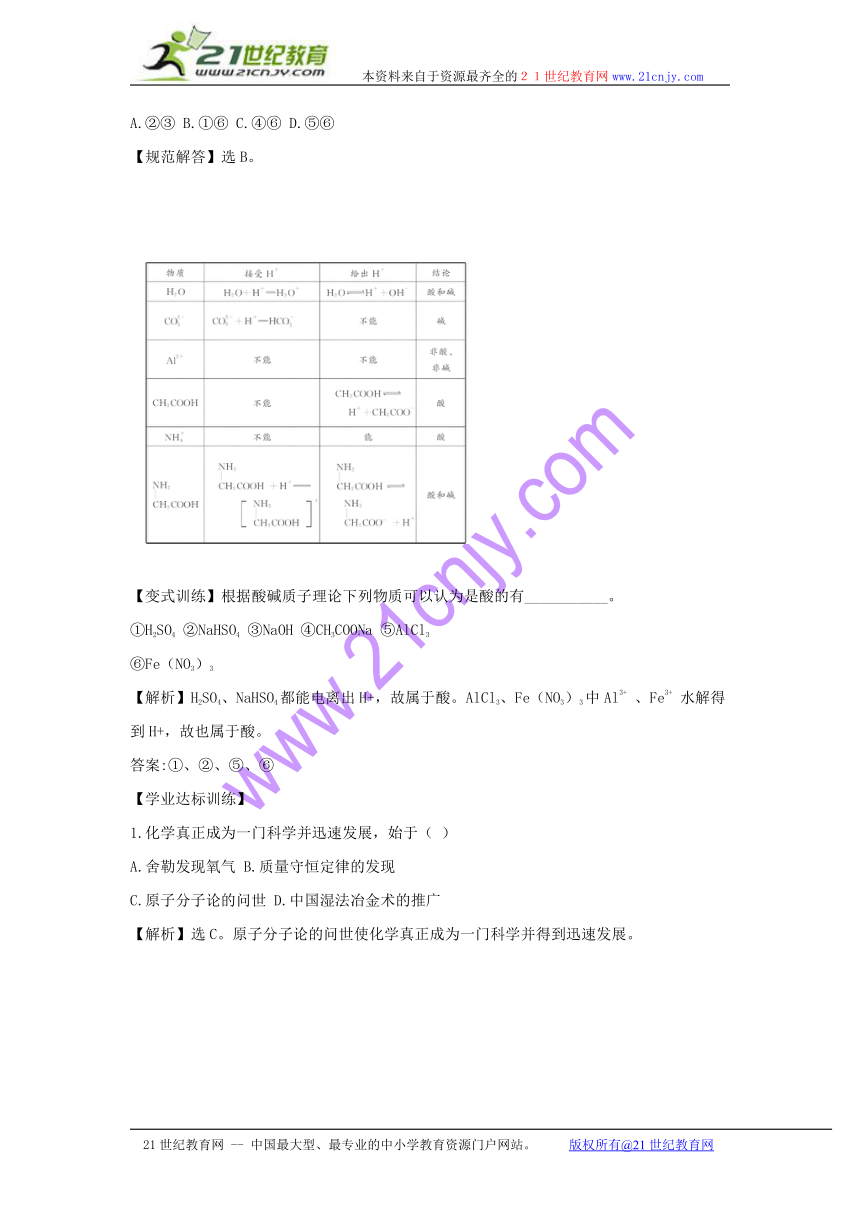
【典例2】20世纪20年代,化学家创造了酸碱质子理论。其要点是:凡能给出质子(H+)的分子或离子都是酸,凡能接受质子(H+)的物质都是碱,按此观点,下列微粒既属于酸又属于碱的是
A.②③ B.①⑥ C.④⑥ D.⑤⑥
【规范解答】选B。
【变式训练】根据酸碱质子理论下列物质可以认为是酸的有___________。
①H2SO4 ②NaHSO4 ③NaOH ④CH3COONa ⑤AlCl3
⑥Fe(NO3)3
【解析】H2SO4、NaHSO4都能电离出H+,故属于酸。AlCl3、Fe(NO3)3中Al3+ 、Fe3+ 水解得到H+,故也属于酸。
答案:①、②、⑤、⑥
【学业达标训练】
1.化学真正成为一门科学并迅速发展,始于( )
A.舍勒发现氧气 B.质量守恒定律的发现
C.原子分子论的问世 D.中国湿法冶金术的推广
【解析】选C。原子分子论的问世使化学真正成为一门科学并得到迅速发展。
3.下列不符合当今化学研究方向的是( )
A.发现新物质
B.合成新材料
C.研究化学反应的微观过程
D.研究化学反应中原子守恒关系
【解析】选D。研究化学反应的微观过程、探索化学反应机理、合成新材料、发现新物质都是当今化学研究的方向,而化学反应中的原子守恒关系是早已发现的质量守恒定律,不符合当今化学研究的方向。
4.金属冶炼的目的是( )
A.把金属化合物还原为金属单质
B.把金属单质变为氧化物
C.除去金属中的杂质
D.把电能转变为化学能
【解析】选A。绝大多数金属元素在自然界中是以化合态存在的,金属冶炼即把化合态的金属元素还原成金属单质。
5.下列化学反应在金属冶炼工业中还没有得到应用的是( )
【解析】选B。该反应发生的温度为2 125 ℃,必定消耗大量的能量,经济效益不高,故不采用,工业上一般采用电解Al2O3来冶炼铝。
6.诺贝尔化学奖曾授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子系的性质,引起整个化学领域经历一场革命性的变化。下列说法正确的是( )
A.化学不再是纯实验科学
B.化学不再需要实验
C.化学不做实验,就什么都不知道
D.未来化学的方向还是经验化
【解析】选A。理论与实验是互相促进的,有了理论的引导,化学的发展更加快速,故化学不再是纯实验科学。
7.下列有关金属的成语中,不符合科学原理的是( )
A.百炼成钢 B.火树银花
C.点石成金 D.沙里淘金
【解析】选C。百炼成钢主要介绍生铁炼钢的过程。把铁加热到一定温度并反复锻打,就可把其中夹杂的氧化物分离出来,此时铁的机械性能就得到了改善。为提高钢的质量,人们将锻打次数增加到近百次,从而得到所谓的“百炼钢”。
火树银花中火树就是指焰火,俗称烟花。古人在发明火药的基础上,制造出了烟花,它由上下两部分组成,下部装有类似火药的发射药剂,上部装填燃烧剂、助燃剂及发色剂,发色剂内含各种金属元素的无机化合物,它们在燃烧时显示各种各样的颜色,化学上称之为焰色反应。
发生化学反应时元素的种类是不发生变化的,在化学反应中不可能有新的元素生成,所以“点石成金”不符合科学原理。
金是一种稀有金属元素,在地壳中的含量很少,主要来源为山金及沙金。人类都是采用“沙里淘金”的方法开采黄金,即用重力选矿法,利用黄金与沙子的密度差异,用水反复淘洗得到。故选C。
8.化学的发展对改善人们的生活环境和促进社会发展有着积极的作用,下列各项利用的化学原理与其所要达到的目的不相符的是( )
A.合成药物抑制细菌和病毒
B.生产化肥、农药,增加粮食产量
C.开发新材料,改善生存条件,提高生活质量
D.合成食品添加剂,增进人体健康
【解析】选D。食品添加剂对人体没有益处,有些甚至是有害的,故不会增进人体健康。
9.氯气是一种重要的化工原料,历史上曾采用如下方法制备氯气,请回答相应的问题:
(1)1774年瑞典化学家舍勒用软锰矿(主要成分是MnO2)和浓盐酸作用最先制得了氯气,该反应的离子方程式为______________________________________。
(2)历史上曾用“地康法”制氯气。这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧气与氯化氢反应制氯气。这一反应的化学方程式为___________________。
(3)现代氯碱工业是化学工业的基础之一,是制氯气的重要方法。该反应的化学方程式为__________________。
【解析】本题以氯气的制备为载体,考查学生根据条件书写化学方程式的能力。书写化学方程式时一定要注意反应发生需要的条件。
10.工业上常用电解熔融氯化钠的方法制取金属钠和氯气,试回答下列问题:
(1)金属钠在______极上产生。
(2)写出产生Cl2的电极反应方程式:_____________。
(3)该反应______(填“是”或“不是”)离子反应,如果是,请写出该反应的离子方程式________________
(如不是,则此空不填)。
(4)为何不采用电解食盐水来制取钠_______________
_________________________。
【素能综合检测】
一、选择题(本题包括5个小题,每小题4分,共20分)
1.二十世纪化学合成技术的发展对人类健康水平和生活质量的提高做出了巨大贡献。下列各组物质全部由化学合成得到的是( )
A.玻璃纤维素青霉素 B.尿素食盐聚乙烯
C.涤纶洗衣粉阿司匹林 D.石英橡胶磷化铟
【解析】选C。A项纤维素是天然高分子化合物;B项中的食盐,可以从自然界的海水中提取,不必合成;D项中的石英其主要成分是SiO2,自然界中存在大量的SiO2,也不必合成;故选C。
2.(2010·六安高一检测)不同金属的冶炼方法可能不同,主要原因是( )
A.金属在自然界中的分布不同
B.金属在自然界中的含量不同
C.金属在自然界中存在形式不同
D.金属的活泼性不同
【解析】选D。金属采用不同的冶炼方法主要是由金属的活泼性所决定的。
3.下列说法正确的是( )
A.所有的酸性氧化物都能与水反应形成相应的酸
B.所有的酸性氧化物都是非金属氧化物
C.根据电离学说,能电离出H+ 的化合物属于酸
D.Zn+2HCl====ZnCl2+H2↑,体现了HCl的酸性和氧化性
【解析】选D。SiO2不能与水反应形成相应的酸,但SiO2为酸性氧化物,A错误;Mn2O7为金属氧化物,但属于酸性氧化物,B错误;NaHSO4电离出的阳离子为Na+ 和H+,属于酸式盐,C错误;Zn+2HCl====ZnCl2+H2↑,体现了HCl的酸性和氧化性,D正确。
4.诺贝尔化学奖获得者艾哈迈德·泽维尔,开创了“飞秒(10-15s)化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能。你认为该技术不能观察到的是( )
A.化学变化中反应物分子的分解
B.化学反应中原子的运动
C.化学变化中生成物分子的形成
D.原子核的内部结构
【解析】选D。“飞秒化学”运用激光光谱技术能观测化学反应时分子中原子的运动。化学变化中反应物分子的分解和生成物分子的形成,都是原子运动的结果,而原子核的内部结构则不能观测到,选D。
5.正电子、反质子等都属于反粒子,它们跟普通电子、质子的质量、电量相等,但电性相反。科学家设想在宇宙的某些部分可能存在完全由反粒子构成的物质——反物质。欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。试推测反氢原子的结构是( )
A.由1个带正电荷的质子与1个带负电荷的电子构成
B.由1个带负电荷的质子与1个带正电荷的电子构成
C.由1个不带电的中子与1个带负电荷的电子构成
D.由1个带负电荷的质子与1个带负电荷的电子构成
【解析】选B。正电子、反质子与电子、质子的区别只是电性相反,则反氢原子与氢原子的区别也只是电性相反,故选B。
二、非选择题(本题包括3个小题,共30分)
6.(10分)随着人类对水的研究不断深入,水的应用也越来越广泛。研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20 ℃、1个大气压下,水可以结成冰,称为“热冰”。
(1)“热冰”有许多实用价值,如开发新药、用于纳米打印机等,还有可能用来______。
①代替干冰 ②建室温溜冰场
③在室温下制作冰雕 ④防止冰川融化
A.①② B.②③ C.③④ D.①④
(2)电解水可以制氢气,化学反应方程式是__________
___________。但由于这种方法耗电量大,人们正在研究植物光合作用中光解水的有关机理,以期低成本、高效率地获得氢气,为此需要重点研究的细胞器是______。
(3)氢能将成为绿色可再生能源。首座燃料电池汽车高压加氢站将于年底现身上海,燃料电池是利用原电池的原理将______能转化为______能。
【解析】“热冰”的特点是在较高温度下使水呈固态,因而可以用于在室温下制作冰制品,建立室温溜冰场,但不具有干冰在室温下汽化的性能,所以不能代替干冰。将冰川变为“热冰”不现实。电解水可生成H2和O2。原电池是将化学能转化为电能的装置。
答案:(1)B (2)2H2O 2H2↑+O2↑ 叶绿体
(3)化学 电
7.(7分)(思维拓展题)我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,我国发行了面值为10分的丹砂邮票。丹砂炼汞包括以下两个反应过程:
请完成下列问题:
(1)HgS与氧气反应时,氧化剂是_________。
(2)请标出反应Ⅱ中电子转移的方向和数目。
(3)得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式___________
________________________。
【解析】(1)在反应HgS+O2Hg+SO2中,Hg元素的化合价由+2价变成0价,氧元素的化合价由0价变成-2价,化合价降低被还原,所以氧化剂是HgS和O2,还原剂是HgS。(4)要提高 的浓度,可以使平衡正向移动,所以可以增大反应物Hg2+ 的浓度。
答案:(1)HgS和O2
[实验·探究]
8.(13分)内地某大型铁矿附
近有炼焦煤、石灰石、黏土矿
和丰富的地下水资源。该地区
接近水资源(河流)和铁路干
线,周围是盛产小麦、棉花的
农业地区。根据上述信息,完
成下列填空:
(1)随着大型铁矿的开发,该地将建立焦化厂、钢铁厂、发电厂和水泥厂。请把这4个工厂的名称填入如图的工业联系图空白框内。
(2)为了充分利用当地资源,该地还可能建立的轻工业厂有(写出2个):_____________、_____________等。
(3)写出以焦炭、磁铁矿为主要原料冶炼生铁的化学方程式:① ______________ ,② ______________ ,
③ ______________ 。
【解析】焦化厂、钢铁厂、水泥厂都需要使用电能,根据图中箭头流向,可以判断第一空白框为发电厂。根据钢铁厂需要的主要燃料是焦炭,原料是铁矿石,添加剂是石灰石,所以第三空白框必定为钢铁厂。水泥的原料主要是石灰石、黏土和钢铁厂的废渣,所以第四空白框为水泥厂,则剩下的第二空白框为焦化厂。由于周围盛产小麦,所以可以建立面粉厂、食品厂;由于周围盛产棉花,所以可以建立棉纺织厂;另外该地区有丰富的地下水资源,还可以建立饮料厂等。这些轻工业部门既可满足市场需求,又可以平衡当地职工的社会需要。
【典例导悟】
【典例1】(多选)下列说法正确的是
A.有些活泼金属,如铝可作热还原法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收旧金属可以重新制成金属或它们的化合物
【思路点拨】解答本题要注意以下两点:
(1)根据金属的活泼性选择冶炼方法。
(2)回收废旧金属进行再利用的意义。
【自主解答】选A、D。本题主要考查金属的冶炼方法。铝可以作还原剂冶炼一些高熔点的金属,如
2Al+Cr2O32Cr+Al2O3,A项正确;电解NaCl溶液不能得到金属钠,金属钠应该用电解熔融NaCl的方法制取,B项错;铝是活泼金属,很难用还原剂把它还原出来,应该用电解熔融Al2O3的方法制备,C项错;D项正确。
【解析】选B。在金属活动性顺序表中,H排在Mg的后面,所以H2不能把MgO中的Mg置换出来。
【典例2】20世纪20年代,化学家创造了酸碱质子理论。其要点是:凡能给出质子(H+)的分子或离子都是酸,凡能接受质子(H+)的物质都是碱,按此观点,下列微粒既属于酸又属于碱的是
A.②③ B.①⑥ C.④⑥ D.⑤⑥
【规范解答】选B。
【变式训练】根据酸碱质子理论下列物质可以认为是酸的有___________。
①H2SO4 ②NaHSO4 ③NaOH ④CH3COONa ⑤AlCl3
⑥Fe(NO3)3
【解析】H2SO4、NaHSO4都能电离出H+,故属于酸。AlCl3、Fe(NO3)3中Al3+ 、Fe3+ 水解得到H+,故也属于酸。
答案:①、②、⑤、⑥
【学业达标训练】
1.化学真正成为一门科学并迅速发展,始于( )
A.舍勒发现氧气 B.质量守恒定律的发现
C.原子分子论的问世 D.中国湿法冶金术的推广
【解析】选C。原子分子论的问世使化学真正成为一门科学并得到迅速发展。
3.下列不符合当今化学研究方向的是( )
A.发现新物质
B.合成新材料
C.研究化学反应的微观过程
D.研究化学反应中原子守恒关系
【解析】选D。研究化学反应的微观过程、探索化学反应机理、合成新材料、发现新物质都是当今化学研究的方向,而化学反应中的原子守恒关系是早已发现的质量守恒定律,不符合当今化学研究的方向。
4.金属冶炼的目的是( )
A.把金属化合物还原为金属单质
B.把金属单质变为氧化物
C.除去金属中的杂质
D.把电能转变为化学能
【解析】选A。绝大多数金属元素在自然界中是以化合态存在的,金属冶炼即把化合态的金属元素还原成金属单质。
5.下列化学反应在金属冶炼工业中还没有得到应用的是( )
【解析】选B。该反应发生的温度为2 125 ℃,必定消耗大量的能量,经济效益不高,故不采用,工业上一般采用电解Al2O3来冶炼铝。
6.诺贝尔化学奖曾授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子系的性质,引起整个化学领域经历一场革命性的变化。下列说法正确的是( )
A.化学不再是纯实验科学
B.化学不再需要实验
C.化学不做实验,就什么都不知道
D.未来化学的方向还是经验化
【解析】选A。理论与实验是互相促进的,有了理论的引导,化学的发展更加快速,故化学不再是纯实验科学。
7.下列有关金属的成语中,不符合科学原理的是( )
A.百炼成钢 B.火树银花
C.点石成金 D.沙里淘金
【解析】选C。百炼成钢主要介绍生铁炼钢的过程。把铁加热到一定温度并反复锻打,就可把其中夹杂的氧化物分离出来,此时铁的机械性能就得到了改善。为提高钢的质量,人们将锻打次数增加到近百次,从而得到所谓的“百炼钢”。
火树银花中火树就是指焰火,俗称烟花。古人在发明火药的基础上,制造出了烟花,它由上下两部分组成,下部装有类似火药的发射药剂,上部装填燃烧剂、助燃剂及发色剂,发色剂内含各种金属元素的无机化合物,它们在燃烧时显示各种各样的颜色,化学上称之为焰色反应。
发生化学反应时元素的种类是不发生变化的,在化学反应中不可能有新的元素生成,所以“点石成金”不符合科学原理。
金是一种稀有金属元素,在地壳中的含量很少,主要来源为山金及沙金。人类都是采用“沙里淘金”的方法开采黄金,即用重力选矿法,利用黄金与沙子的密度差异,用水反复淘洗得到。故选C。
8.化学的发展对改善人们的生活环境和促进社会发展有着积极的作用,下列各项利用的化学原理与其所要达到的目的不相符的是( )
A.合成药物抑制细菌和病毒
B.生产化肥、农药,增加粮食产量
C.开发新材料,改善生存条件,提高生活质量
D.合成食品添加剂,增进人体健康
【解析】选D。食品添加剂对人体没有益处,有些甚至是有害的,故不会增进人体健康。
9.氯气是一种重要的化工原料,历史上曾采用如下方法制备氯气,请回答相应的问题:
(1)1774年瑞典化学家舍勒用软锰矿(主要成分是MnO2)和浓盐酸作用最先制得了氯气,该反应的离子方程式为______________________________________。
(2)历史上曾用“地康法”制氯气。这一方法是用CuCl2作催化剂,在450 ℃利用空气中的氧气与氯化氢反应制氯气。这一反应的化学方程式为___________________。
(3)现代氯碱工业是化学工业的基础之一,是制氯气的重要方法。该反应的化学方程式为__________________。
【解析】本题以氯气的制备为载体,考查学生根据条件书写化学方程式的能力。书写化学方程式时一定要注意反应发生需要的条件。
10.工业上常用电解熔融氯化钠的方法制取金属钠和氯气,试回答下列问题:
(1)金属钠在______极上产生。
(2)写出产生Cl2的电极反应方程式:_____________。
(3)该反应______(填“是”或“不是”)离子反应,如果是,请写出该反应的离子方程式________________
(如不是,则此空不填)。
(4)为何不采用电解食盐水来制取钠_______________
_________________________。
【素能综合检测】
一、选择题(本题包括5个小题,每小题4分,共20分)
1.二十世纪化学合成技术的发展对人类健康水平和生活质量的提高做出了巨大贡献。下列各组物质全部由化学合成得到的是( )
A.玻璃纤维素青霉素 B.尿素食盐聚乙烯
C.涤纶洗衣粉阿司匹林 D.石英橡胶磷化铟
【解析】选C。A项纤维素是天然高分子化合物;B项中的食盐,可以从自然界的海水中提取,不必合成;D项中的石英其主要成分是SiO2,自然界中存在大量的SiO2,也不必合成;故选C。
2.(2010·六安高一检测)不同金属的冶炼方法可能不同,主要原因是( )
A.金属在自然界中的分布不同
B.金属在自然界中的含量不同
C.金属在自然界中存在形式不同
D.金属的活泼性不同
【解析】选D。金属采用不同的冶炼方法主要是由金属的活泼性所决定的。
3.下列说法正确的是( )
A.所有的酸性氧化物都能与水反应形成相应的酸
B.所有的酸性氧化物都是非金属氧化物
C.根据电离学说,能电离出H+ 的化合物属于酸
D.Zn+2HCl====ZnCl2+H2↑,体现了HCl的酸性和氧化性
【解析】选D。SiO2不能与水反应形成相应的酸,但SiO2为酸性氧化物,A错误;Mn2O7为金属氧化物,但属于酸性氧化物,B错误;NaHSO4电离出的阳离子为Na+ 和H+,属于酸式盐,C错误;Zn+2HCl====ZnCl2+H2↑,体现了HCl的酸性和氧化性,D正确。
4.诺贝尔化学奖获得者艾哈迈德·泽维尔,开创了“飞秒(10-15s)化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能。你认为该技术不能观察到的是( )
A.化学变化中反应物分子的分解
B.化学反应中原子的运动
C.化学变化中生成物分子的形成
D.原子核的内部结构
【解析】选D。“飞秒化学”运用激光光谱技术能观测化学反应时分子中原子的运动。化学变化中反应物分子的分解和生成物分子的形成,都是原子运动的结果,而原子核的内部结构则不能观测到,选D。
5.正电子、反质子等都属于反粒子,它们跟普通电子、质子的质量、电量相等,但电性相反。科学家设想在宇宙的某些部分可能存在完全由反粒子构成的物质——反物质。欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。试推测反氢原子的结构是( )
A.由1个带正电荷的质子与1个带负电荷的电子构成
B.由1个带负电荷的质子与1个带正电荷的电子构成
C.由1个不带电的中子与1个带负电荷的电子构成
D.由1个带负电荷的质子与1个带负电荷的电子构成
【解析】选B。正电子、反质子与电子、质子的区别只是电性相反,则反氢原子与氢原子的区别也只是电性相反,故选B。
二、非选择题(本题包括3个小题,共30分)
6.(10分)随着人类对水的研究不断深入,水的应用也越来越广泛。研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20 ℃、1个大气压下,水可以结成冰,称为“热冰”。
(1)“热冰”有许多实用价值,如开发新药、用于纳米打印机等,还有可能用来______。
①代替干冰 ②建室温溜冰场
③在室温下制作冰雕 ④防止冰川融化
A.①② B.②③ C.③④ D.①④
(2)电解水可以制氢气,化学反应方程式是__________
___________。但由于这种方法耗电量大,人们正在研究植物光合作用中光解水的有关机理,以期低成本、高效率地获得氢气,为此需要重点研究的细胞器是______。
(3)氢能将成为绿色可再生能源。首座燃料电池汽车高压加氢站将于年底现身上海,燃料电池是利用原电池的原理将______能转化为______能。
【解析】“热冰”的特点是在较高温度下使水呈固态,因而可以用于在室温下制作冰制品,建立室温溜冰场,但不具有干冰在室温下汽化的性能,所以不能代替干冰。将冰川变为“热冰”不现实。电解水可生成H2和O2。原电池是将化学能转化为电能的装置。
答案:(1)B (2)2H2O 2H2↑+O2↑ 叶绿体
(3)化学 电
7.(7分)(思维拓展题)我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,我国发行了面值为10分的丹砂邮票。丹砂炼汞包括以下两个反应过程:
请完成下列问题:
(1)HgS与氧气反应时,氧化剂是_________。
(2)请标出反应Ⅱ中电子转移的方向和数目。
(3)得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式___________
________________________。
【解析】(1)在反应HgS+O2Hg+SO2中,Hg元素的化合价由+2价变成0价,氧元素的化合价由0价变成-2价,化合价降低被还原,所以氧化剂是HgS和O2,还原剂是HgS。(4)要提高 的浓度,可以使平衡正向移动,所以可以增大反应物Hg2+ 的浓度。
答案:(1)HgS和O2
[实验·探究]
8.(13分)内地某大型铁矿附
近有炼焦煤、石灰石、黏土矿
和丰富的地下水资源。该地区
接近水资源(河流)和铁路干
线,周围是盛产小麦、棉花的
农业地区。根据上述信息,完
成下列填空:
(1)随着大型铁矿的开发,该地将建立焦化厂、钢铁厂、发电厂和水泥厂。请把这4个工厂的名称填入如图的工业联系图空白框内。
(2)为了充分利用当地资源,该地还可能建立的轻工业厂有(写出2个):_____________、_____________等。
(3)写出以焦炭、磁铁矿为主要原料冶炼生铁的化学方程式:① ______________ ,② ______________ ,
③ ______________ 。
【解析】焦化厂、钢铁厂、水泥厂都需要使用电能,根据图中箭头流向,可以判断第一空白框为发电厂。根据钢铁厂需要的主要燃料是焦炭,原料是铁矿石,添加剂是石灰石,所以第三空白框必定为钢铁厂。水泥的原料主要是石灰石、黏土和钢铁厂的废渣,所以第四空白框为水泥厂,则剩下的第二空白框为焦化厂。由于周围盛产小麦,所以可以建立面粉厂、食品厂;由于周围盛产棉花,所以可以建立棉纺织厂;另外该地区有丰富的地下水资源,还可以建立饮料厂等。这些轻工业部门既可满足市场需求,又可以平衡当地职工的社会需要。
