2012届江苏省扬州市普通高中学业水平测试摸拟试卷(一)化学卷
文档属性
| 名称 | 2012届江苏省扬州市普通高中学业水平测试摸拟试卷(一)化学卷 |  | |
| 格式 | rar | ||
| 文件大小 | 198.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-03-10 05:13:00 | ||
图片预览



文档简介
江苏省2011年高中学业水平测试(必修)模拟卷
化 学
可能用到的相对原子质量:Ca 40 Mn55 Ba 137 H 1 C12 O16 S32 Cl 35.5
一、单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)。
1.在抗震救灾中要用大量漂白粉和漂白液杀菌消毒。下列说法正确的是 ( )
A.漂白粉的有效成分是Ca(ClO)2
B.漂白粉是纯净物,漂白液是混合物
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成份是Na2O2
2.下列表示物质结构的化学用语或模型中,正确的是 ( )
A.8个中子的碳原子的核素符号:12C
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:
3.试管中充满某气体后倒立于盛水的水槽中,结果如右图所示,该试管中原来所装的气体可能是 ( )
A.NO2 B.NO
C.NH3 D.N2
4.下列各组物质相互反应时,不会生成有气味气体的是 ( )
A.Na2SO3 与H2SO4 B.Na2O2与H2O
C.NH4Cl与浓NaOH溶液 D.Cu与浓硝酸
5.下列物质的变化中,不能通过一步化学反应完成的是 ( )
A.SiO2 → H2SiO3 B.Cl2 → HClO
C.NO2 → HNO3 D.H2SO4(浓) → SO2
6.现有三组溶液,①汽油和氯化钠溶液,②乙醇和CCl4的混合物,③氯化钠和单质碘的水溶液。分离以上各混合物的正确方法依次是 ( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
7.用NA表示阿伏加德罗常数的值。下列判断中,错误的是 ( )
A. NA个H+的质量为1 g
B. 2L 0.5 mol /L Na2SO4溶液中含NA个Na+
C. 32 g O2中含有2NA个O原子
D.标准状况下, 1 mol H2O中含有NA个分子
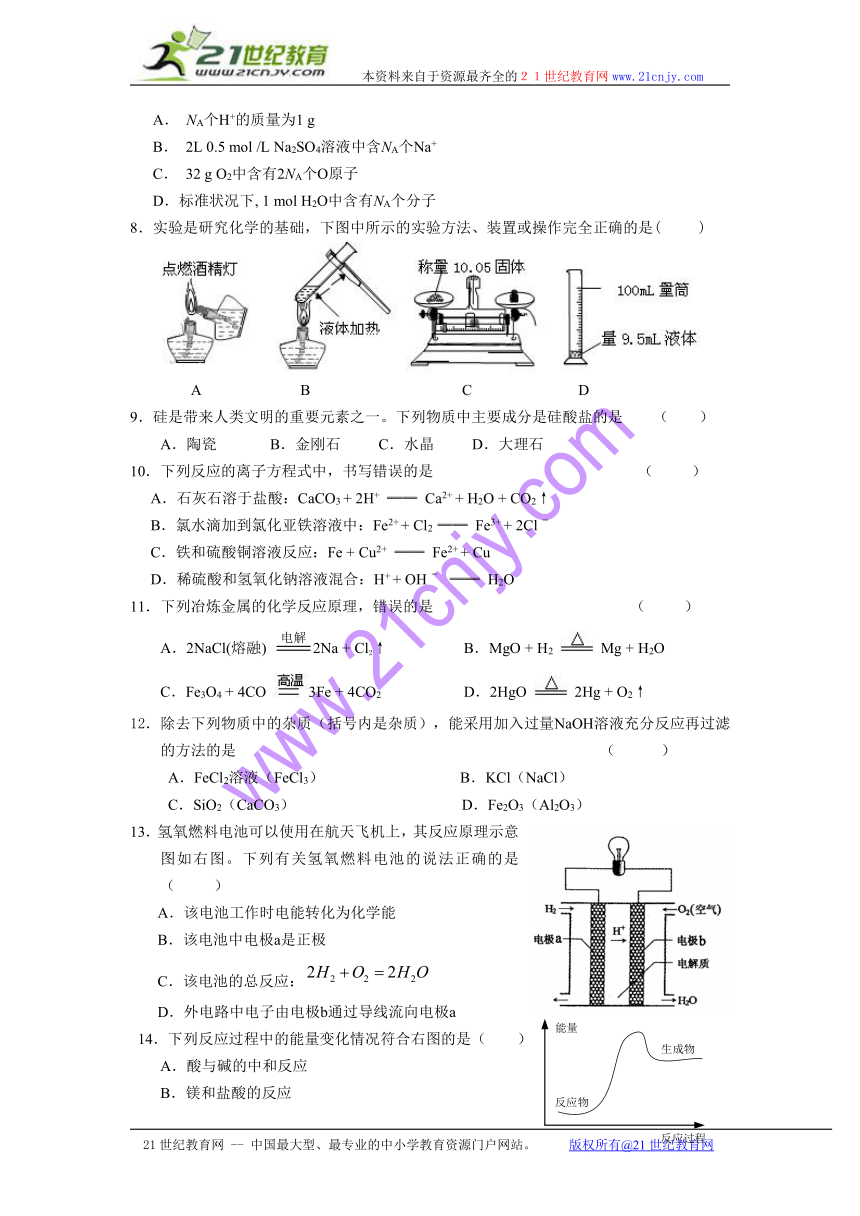
8.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A B C D
9.硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是 ( )
A.陶瓷 B.金刚石 C.水晶 D.大理石
10.下列反应的离子方程式中,书写错误的是 ( )
A.石灰石溶于盐酸:CaCO3 + 2H+ ══ Ca2+ + H2O + CO2↑
B.氯水滴加到氯化亚铁溶液中:Fe2+ + Cl2 ══ Fe3+ + 2Clˉ
C.铁和硫酸铜溶液反应:Fe + Cu2+ ══ Fe2+ + Cu
D.稀硫酸和氢氧化钠溶液混合:H+ + OHˉ ══ H2O
11.下列冶炼金属的化学反应原理,错误的是 ( )
A.2NaCl(熔融) 2Na + Cl2↑ B.MgO + H2 Mg + H2O
C.Fe3O4 + 4CO 3Fe + 4CO2 D.2HgO 2Hg + O2↑
12.除去下列物质中的杂质(括号内是杂质),能采用加入过量NaOH溶液充分反应再过滤的方法的是 ( )
A.FeCl2溶液(FeCl3) B.KCl(NaCl)
C.SiO2(CaCO3) D.Fe2O3(Al2O3)
13.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法正确的是 ( )
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.该电池的总反应:
D.外电路中电子由电极b通过导线流向电极a
14.下列反应过程中的能量变化情况符合右图的是( )
A.酸与碱的中和反应
B.镁和盐酸的反应
C.水发生分解反应
D.氧化钙和水反应
15.同周期的X、Y、Z三种主族元素,其最高价氧化物对应水化物的酸性由弱到强的顺序是:H3ZO4A.原子半径X>Y>Z
B.非金属性 XC.原子的最外层电子数按X、Y、Z的顺序由少到多
D.气态氢化物的稳定性按X、Y、Z的顺序由强到弱
16.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化。则X为
A.Fe B.Al
C.O2 D.Cl2
17.常温下将铁放入下列过量的溶液中,在溶液中能大量生成Fe3+的是 ( )
A.浓硫酸 B.浓硝酸
C.稀硝酸 D.盐酸
18.下列说法中,不正确的是 ( )
A.碘水可以用来检验淀粉的存在
B.葡萄糖与新制氢氧化铜悬浊液共热会生成砖红色沉淀
C.纤维素与淀粉是同分异构体
D.硝酸可以使蛋白质变黄,称为蛋白质的颜色反应
19.下列物质中,能与溴的CCl4溶液发生化学反应并使其褪色的是 ( )
A.乙醇 B.乙烯 C.苯 D.甲烷
20.用碱石灰和浓硫酸均能干燥的一组气体是 ( )
A.CO2、O2、NH3 B.CO、H2、O2
C.NO、O2、SO2 D.SO2、Cl2、N2
21.下列关于乙醇和乙酸的说法中,正确的是 ( )
A.乙醇和乙酸分子中都含有C=O键
B.乙醇和乙酸相互之间不能溶解
C.乙醇和乙酸均能使紫色石蕊试液变红
D.乙醇和乙酸在一定条件下能发生酯化反应
22.高铁酸钾()是一种新型、高效、多功能水处理剂。下列反应可制取:
2+3+10KOH2+6KCl+8H2O
对于该反应,下列说法正确的是 ( )
A.该反应是置换反应 B.钾元素化合价降低
C.是氧化剂 D.发生还原反应
23.某溶液中可能含有下列6种离子中的某几种:、、、、、。为确认溶液组成进行如下实验:(1)取200mL上述溶液,加入足量溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是 ( )
A.一定存在、、,可能存在、、
B.一定存在、、、,一定不存在、
C.c()=0.01mol·L-1,>
D.如果上述6种离子都存在,则c()>
二、非选择题(本部分3题,共31分)
24.(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
⑴(3分)随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①粮食中的淀粉在人体中水解最终转化成 。
A.葡萄糖 B.蔗糖 C.乙酸 D.乙醇
②出售的食品中常加有苯甲酸钠,苯甲酸钠属于食品 。
A.调味剂 B.防腐剂 C.着色剂
③维生素C也称抗坏血酸。人体对维生素C的主要摄入途径是 。
A.米饭 B.新鲜水果和蔬菜 C.肉类 D.牛奶
⑵(5分)中国是世界上最早研究和生产合金的国家之一。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点 。
②黄铜(铜锌合金)外观同金(Au)相似,常被误认为黄金。试写出一种鉴别黄铜与黄金的化学方法: 。
用盐酸可以除去铜器表面的铜绿[主要成分是Cu2(OH)2CO3],,该反应的化学方程式为 。
③下列对金属制品采取的防护方法不正确的是 (填序号)。
A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
⑶(7分)防止环境污染,保护地球环境。
①控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施: 。
②水中含有的悬浮颗粒物等杂质,可以加入 等混凝剂进行净化处理,自来水在出厂前会通入少量 气进行消毒。
③焚烧—发电法是先进的垃圾处理方法。下面列出了现代生活中的常见垃圾:A.废纸 B.废电池 C.厨余垃圾 D.玻璃瓶 E.塑料制品
在对垃圾焚烧处理前,除废电池外,还有 (填序号)应剔除并回收。随意丢弃废电池造成的主要危害是 。
④汽车尾气中含有的CO和NO会严重污染大气环境。安装尾气催化转换器,可使它们转化成两种无害的气体,写出这一反应的方程式:
。
B.《有机化学基础》
如右图所示,已知有机物A的相对分子质量是28,它的产量是一个国家石油化工水平的标志,D具有酸性。E是具有香味的不溶于水的液体。
(1)(3分)A分子的空间构型是 ,结构简式是 ,
D的分子式为 。
(2)(5分)B与D的反应在下图所示装置中进行。
在左试管中先加入2mL 95%的B,并缓缓加入3mL浓硫酸,再加入2 mL D,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当右试管中有明显现象时停止实验。
①浓硫酸的作用是 。
②饱和Na2CO3溶液的作用是 。
③分离右试管中所得产品E和Na2CO3溶液的操作为(只填名称) ,所需主要仪器为 。
(3)(7分)④的反应类型是 。
写出A→B的化学反应方程式: 。
写出B→C的化学反应方程式: 。
写出B+D→E的化学反应方程式: 。
25.下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。
请回答下列问题:
(1)D的电子式为_______________。
(2)K的化学式为_______________。
(3)写出B与C高温反应生成E和F的化学方程式: 。
(4)写出D与J的稀溶液反应生成G的离子方程式: 。
26.(10分)某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:
3Cl2 + 6OH- 5Cl- + ClO3- + 3H2O
该兴趣小组设计了下列实验装置,进行实验。
请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是____________。
②该兴趣小组用100mL 12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2_________g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了、两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为右图(不考虑氯气和水的反应)。
①图中曲线I表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为__________mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中的物质的量为0.37mol,则产物中=______________。
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法:
。
参考答案
一、单项选择题:(每小题3分,共69分)
1
2
3
4
5
6
7
8
9
10
11
12
A
D
C
B
A
C
B
B
A
B
B
D
13
14
15
16
17
18
19
20
21
22
23
C
C
D
A
C
C
B
B
D
C
D
23.解析:加入氯化钡后所得4.30g沉淀中,n(BaSO4)= 2.33g/233 g·mol-1 = 0.01 mol ,
n(BaCO3) = (4.30g - 2.33g) / 197g·mol-1 = 0.01 mol ,加入氢氧化钠溶液后生成氨气n(NH3) =1.12L/22.4L·mol-1 = 0.05 mol 。则原溶液中一定存在的离子有 NH4+( 0.05 mol)、SO42ˉ(0.01 mol)、CO32ˉ(0.01 mol)。根据离子电荷守恒,溶液中一定含Clˉ,可能含有Na+、K+。如果上述六种离子都存在,则n(Clˉ)﹥0.01 mol ,此时c(Clˉ)>c(SO42ˉ)。
24.A.《化学与生活》
⑴(3分) ①A ②B ③ B
⑵(5分)①低 ②取少许合金加入少量盐酸(或稀硫酸、醋酸等),若有气泡产生,则可证明是假黄金 Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O ③C
⑶(7分)①减少化石燃料的使用、植树造林;少用空调和暖气、少开车、少坐飞机;利用太阳能、风能等 ②明矾 氯气 ③ D 重金属离子污染
④ 2CO + 2NO N2 + 2CO2
24.B.《有机化学基础》
(1)平面型 CH2=CH2 C2H4O2 (写成结构简式或结构式给分)
(2)① 催化剂和吸水剂
② 吸收未反应的乙酸和乙醇,减少乙酸乙酯在水中的溶解,除去乙酸乙酯中的乙酸。(意思相近给分,答出任两点给满分)
③ 分液 分液漏斗
(3)取代反应或酯化反应
CH2=CH2 + H2O CH3CH2OH
2CH3CH2OH + O2 2CH3CHO + 2H2O
CH3CH2OH + CH3COOH CH3COOCH3 + H2O
25.(6分) (1) (2)FeCl3
(3)Fe2O3+2AlA12O3+2Fe (4)CO2+CO32—+H2O=2HCO3—
26.(10分) (1)①除去氯气中混有的氯化氢 ②7.15 (2 )①ClO— ②0.25 ③7:6
(3)将丙装置浸在盛有冷水的水槽中
解析:(1)②盐酸过量,n(MnO2) = 8.7g / 87 g·mol-1 = 0.1mol,生成氯气: n(Cl2) = 0.1mol
2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 + 2H2O,可制取Ca(ClO)2:(0.1mol/2)×143 g·mol-1 = 7.15 g
(2)①刚开始反应时,生成的是氯化钙和次氯酸钙,反应一段时间后温度升高,生成氯酸钙,所以曲线Ⅰ表示的是ClOˉ离子的物质的量随反应时间变化的关系,曲线Ⅱ表示的是ClO3ˉ离子的物质的量随反应时间变化的关系。
②在时间t2后反应完成,此时溶液中n(ClOˉ) = 0.1 mol, 同时生成n(Clˉ)= 0.1 mol,n(ClO3ˉ) = 0.05 mol, 同时生成n(Clˉ) = 0.05 mol ×5 = 0.25 mol。这时溶液中阴离子总物质的量为 n(阴离子)= (0.1+0.1+0.05+0.25) mol=0.5 mol,根据电荷守恒,溶液中含钙离子n(Ca2+) = 0.5 mol /2 = 0.25 mol,即所取石灰乳中含有Ca(OH)2的物质的量为0.25 mol。
③当溶液中n(Ca2+) = 0.25 mol,n(Clˉ) = 0.37 mol时,
根据方程式比例关系和电荷守恒:
n(ClOˉ) + 5 n(ClO3ˉ) = n(Clˉ) n(ClOˉ) = 0.07mol
n(Clˉ)+ n(ClOˉ) + n(ClO3ˉ) = 2n(Ca2+) n(ClO3ˉ)= 0.06 mol
=
化 学
可能用到的相对原子质量:Ca 40 Mn55 Ba 137 H 1 C12 O16 S32 Cl 35.5
一、单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)。
1.在抗震救灾中要用大量漂白粉和漂白液杀菌消毒。下列说法正确的是 ( )
A.漂白粉的有效成分是Ca(ClO)2
B.漂白粉是纯净物,漂白液是混合物
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成份是Na2O2
2.下列表示物质结构的化学用语或模型中,正确的是 ( )
A.8个中子的碳原子的核素符号:12C
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:
3.试管中充满某气体后倒立于盛水的水槽中,结果如右图所示,该试管中原来所装的气体可能是 ( )
A.NO2 B.NO
C.NH3 D.N2
4.下列各组物质相互反应时,不会生成有气味气体的是 ( )
A.Na2SO3 与H2SO4 B.Na2O2与H2O
C.NH4Cl与浓NaOH溶液 D.Cu与浓硝酸
5.下列物质的变化中,不能通过一步化学反应完成的是 ( )
A.SiO2 → H2SiO3 B.Cl2 → HClO
C.NO2 → HNO3 D.H2SO4(浓) → SO2
6.现有三组溶液,①汽油和氯化钠溶液,②乙醇和CCl4的混合物,③氯化钠和单质碘的水溶液。分离以上各混合物的正确方法依次是 ( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
7.用NA表示阿伏加德罗常数的值。下列判断中,错误的是 ( )
A. NA个H+的质量为1 g
B. 2L 0.5 mol /L Na2SO4溶液中含NA个Na+
C. 32 g O2中含有2NA个O原子
D.标准状况下, 1 mol H2O中含有NA个分子
8.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A B C D
9.硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是 ( )
A.陶瓷 B.金刚石 C.水晶 D.大理石
10.下列反应的离子方程式中,书写错误的是 ( )
A.石灰石溶于盐酸:CaCO3 + 2H+ ══ Ca2+ + H2O + CO2↑
B.氯水滴加到氯化亚铁溶液中:Fe2+ + Cl2 ══ Fe3+ + 2Clˉ
C.铁和硫酸铜溶液反应:Fe + Cu2+ ══ Fe2+ + Cu
D.稀硫酸和氢氧化钠溶液混合:H+ + OHˉ ══ H2O
11.下列冶炼金属的化学反应原理,错误的是 ( )
A.2NaCl(熔融) 2Na + Cl2↑ B.MgO + H2 Mg + H2O
C.Fe3O4 + 4CO 3Fe + 4CO2 D.2HgO 2Hg + O2↑
12.除去下列物质中的杂质(括号内是杂质),能采用加入过量NaOH溶液充分反应再过滤的方法的是 ( )
A.FeCl2溶液(FeCl3) B.KCl(NaCl)
C.SiO2(CaCO3) D.Fe2O3(Al2O3)
13.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法正确的是 ( )
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.该电池的总反应:
D.外电路中电子由电极b通过导线流向电极a
14.下列反应过程中的能量变化情况符合右图的是( )
A.酸与碱的中和反应
B.镁和盐酸的反应
C.水发生分解反应
D.氧化钙和水反应
15.同周期的X、Y、Z三种主族元素,其最高价氧化物对应水化物的酸性由弱到强的顺序是:H3ZO4
B.非金属性 X
D.气态氢化物的稳定性按X、Y、Z的顺序由强到弱
16.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化。则X为
A.Fe B.Al
C.O2 D.Cl2
17.常温下将铁放入下列过量的溶液中,在溶液中能大量生成Fe3+的是 ( )
A.浓硫酸 B.浓硝酸
C.稀硝酸 D.盐酸
18.下列说法中,不正确的是 ( )
A.碘水可以用来检验淀粉的存在
B.葡萄糖与新制氢氧化铜悬浊液共热会生成砖红色沉淀
C.纤维素与淀粉是同分异构体
D.硝酸可以使蛋白质变黄,称为蛋白质的颜色反应
19.下列物质中,能与溴的CCl4溶液发生化学反应并使其褪色的是 ( )
A.乙醇 B.乙烯 C.苯 D.甲烷
20.用碱石灰和浓硫酸均能干燥的一组气体是 ( )
A.CO2、O2、NH3 B.CO、H2、O2
C.NO、O2、SO2 D.SO2、Cl2、N2
21.下列关于乙醇和乙酸的说法中,正确的是 ( )
A.乙醇和乙酸分子中都含有C=O键
B.乙醇和乙酸相互之间不能溶解
C.乙醇和乙酸均能使紫色石蕊试液变红
D.乙醇和乙酸在一定条件下能发生酯化反应
22.高铁酸钾()是一种新型、高效、多功能水处理剂。下列反应可制取:
2+3+10KOH2+6KCl+8H2O
对于该反应,下列说法正确的是 ( )
A.该反应是置换反应 B.钾元素化合价降低
C.是氧化剂 D.发生还原反应
23.某溶液中可能含有下列6种离子中的某几种:、、、、、。为确认溶液组成进行如下实验:(1)取200mL上述溶液,加入足量溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是 ( )
A.一定存在、、,可能存在、、
B.一定存在、、、,一定不存在、
C.c()=0.01mol·L-1,>
D.如果上述6种离子都存在,则c()>
二、非选择题(本部分3题,共31分)
24.(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
⑴(3分)随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①粮食中的淀粉在人体中水解最终转化成 。
A.葡萄糖 B.蔗糖 C.乙酸 D.乙醇
②出售的食品中常加有苯甲酸钠,苯甲酸钠属于食品 。
A.调味剂 B.防腐剂 C.着色剂
③维生素C也称抗坏血酸。人体对维生素C的主要摄入途径是 。
A.米饭 B.新鲜水果和蔬菜 C.肉类 D.牛奶
⑵(5分)中国是世界上最早研究和生产合金的国家之一。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点 。
②黄铜(铜锌合金)外观同金(Au)相似,常被误认为黄金。试写出一种鉴别黄铜与黄金的化学方法: 。
用盐酸可以除去铜器表面的铜绿[主要成分是Cu2(OH)2CO3],,该反应的化学方程式为 。
③下列对金属制品采取的防护方法不正确的是 (填序号)。
A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
⑶(7分)防止环境污染,保护地球环境。
①控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施: 。
②水中含有的悬浮颗粒物等杂质,可以加入 等混凝剂进行净化处理,自来水在出厂前会通入少量 气进行消毒。
③焚烧—发电法是先进的垃圾处理方法。下面列出了现代生活中的常见垃圾:A.废纸 B.废电池 C.厨余垃圾 D.玻璃瓶 E.塑料制品
在对垃圾焚烧处理前,除废电池外,还有 (填序号)应剔除并回收。随意丢弃废电池造成的主要危害是 。
④汽车尾气中含有的CO和NO会严重污染大气环境。安装尾气催化转换器,可使它们转化成两种无害的气体,写出这一反应的方程式:
。
B.《有机化学基础》
如右图所示,已知有机物A的相对分子质量是28,它的产量是一个国家石油化工水平的标志,D具有酸性。E是具有香味的不溶于水的液体。
(1)(3分)A分子的空间构型是 ,结构简式是 ,
D的分子式为 。
(2)(5分)B与D的反应在下图所示装置中进行。
在左试管中先加入2mL 95%的B,并缓缓加入3mL浓硫酸,再加入2 mL D,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当右试管中有明显现象时停止实验。
①浓硫酸的作用是 。
②饱和Na2CO3溶液的作用是 。
③分离右试管中所得产品E和Na2CO3溶液的操作为(只填名称) ,所需主要仪器为 。
(3)(7分)④的反应类型是 。
写出A→B的化学反应方程式: 。
写出B→C的化学反应方程式: 。
写出B+D→E的化学反应方程式: 。
25.下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。
请回答下列问题:
(1)D的电子式为_______________。
(2)K的化学式为_______________。
(3)写出B与C高温反应生成E和F的化学方程式: 。
(4)写出D与J的稀溶液反应生成G的离子方程式: 。
26.(10分)某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:
3Cl2 + 6OH- 5Cl- + ClO3- + 3H2O
该兴趣小组设计了下列实验装置,进行实验。
请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是____________。
②该兴趣小组用100mL 12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2_________g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了、两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为右图(不考虑氯气和水的反应)。
①图中曲线I表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为__________mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中的物质的量为0.37mol,则产物中=______________。
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法:
。
参考答案
一、单项选择题:(每小题3分,共69分)
1
2
3
4
5
6
7
8
9
10
11
12
A
D
C
B
A
C
B
B
A
B
B
D
13
14
15
16
17
18
19
20
21
22
23
C
C
D
A
C
C
B
B
D
C
D
23.解析:加入氯化钡后所得4.30g沉淀中,n(BaSO4)= 2.33g/233 g·mol-1 = 0.01 mol ,
n(BaCO3) = (4.30g - 2.33g) / 197g·mol-1 = 0.01 mol ,加入氢氧化钠溶液后生成氨气n(NH3) =1.12L/22.4L·mol-1 = 0.05 mol 。则原溶液中一定存在的离子有 NH4+( 0.05 mol)、SO42ˉ(0.01 mol)、CO32ˉ(0.01 mol)。根据离子电荷守恒,溶液中一定含Clˉ,可能含有Na+、K+。如果上述六种离子都存在,则n(Clˉ)﹥0.01 mol ,此时c(Clˉ)>c(SO42ˉ)。
24.A.《化学与生活》
⑴(3分) ①A ②B ③ B
⑵(5分)①低 ②取少许合金加入少量盐酸(或稀硫酸、醋酸等),若有气泡产生,则可证明是假黄金 Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O ③C
⑶(7分)①减少化石燃料的使用、植树造林;少用空调和暖气、少开车、少坐飞机;利用太阳能、风能等 ②明矾 氯气 ③ D 重金属离子污染
④ 2CO + 2NO N2 + 2CO2
24.B.《有机化学基础》
(1)平面型 CH2=CH2 C2H4O2 (写成结构简式或结构式给分)
(2)① 催化剂和吸水剂
② 吸收未反应的乙酸和乙醇,减少乙酸乙酯在水中的溶解,除去乙酸乙酯中的乙酸。(意思相近给分,答出任两点给满分)
③ 分液 分液漏斗
(3)取代反应或酯化反应
CH2=CH2 + H2O CH3CH2OH
2CH3CH2OH + O2 2CH3CHO + 2H2O
CH3CH2OH + CH3COOH CH3COOCH3 + H2O
25.(6分) (1) (2)FeCl3
(3)Fe2O3+2AlA12O3+2Fe (4)CO2+CO32—+H2O=2HCO3—
26.(10分) (1)①除去氯气中混有的氯化氢 ②7.15 (2 )①ClO— ②0.25 ③7:6
(3)将丙装置浸在盛有冷水的水槽中
解析:(1)②盐酸过量,n(MnO2) = 8.7g / 87 g·mol-1 = 0.1mol,生成氯气: n(Cl2) = 0.1mol
2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 + 2H2O,可制取Ca(ClO)2:(0.1mol/2)×143 g·mol-1 = 7.15 g
(2)①刚开始反应时,生成的是氯化钙和次氯酸钙,反应一段时间后温度升高,生成氯酸钙,所以曲线Ⅰ表示的是ClOˉ离子的物质的量随反应时间变化的关系,曲线Ⅱ表示的是ClO3ˉ离子的物质的量随反应时间变化的关系。
②在时间t2后反应完成,此时溶液中n(ClOˉ) = 0.1 mol, 同时生成n(Clˉ)= 0.1 mol,n(ClO3ˉ) = 0.05 mol, 同时生成n(Clˉ) = 0.05 mol ×5 = 0.25 mol。这时溶液中阴离子总物质的量为 n(阴离子)= (0.1+0.1+0.05+0.25) mol=0.5 mol,根据电荷守恒,溶液中含钙离子n(Ca2+) = 0.5 mol /2 = 0.25 mol,即所取石灰乳中含有Ca(OH)2的物质的量为0.25 mol。
③当溶液中n(Ca2+) = 0.25 mol,n(Clˉ) = 0.37 mol时,
根据方程式比例关系和电荷守恒:
n(ClOˉ) + 5 n(ClO3ˉ) = n(Clˉ) n(ClOˉ) = 0.07mol
n(Clˉ)+ n(ClOˉ) + n(ClO3ˉ) = 2n(Ca2+) n(ClO3ˉ)= 0.06 mol
=
同课章节目录
