对新课程化学高考复习的几点思考
图片预览









文档简介
课件53张PPT。对新课程化学高考复习的几点思考
南京师大附中 保志明
2010年8月17日 沭阳一。对新课程高考的认识课标教材在变,化学的基本原理没有变。
载体情境在变,考查的知识点没有变。
理念、观念在变,考试的形式没有变。
考试的形式没有变, 命题人员在变。
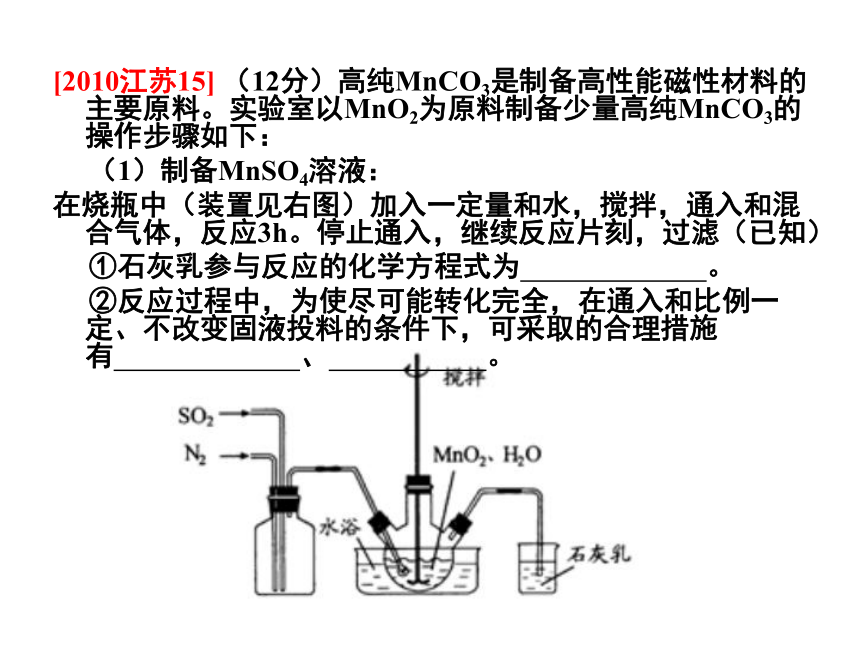
阅卷的形式没有变,阅卷的标准可能变。[2010江苏15] (12分)高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
在烧瓶中(装置见右图)加入一定量和水,搅拌,通入和混合气体,反应3h。停止通入,继续反应片刻,过滤(已知)
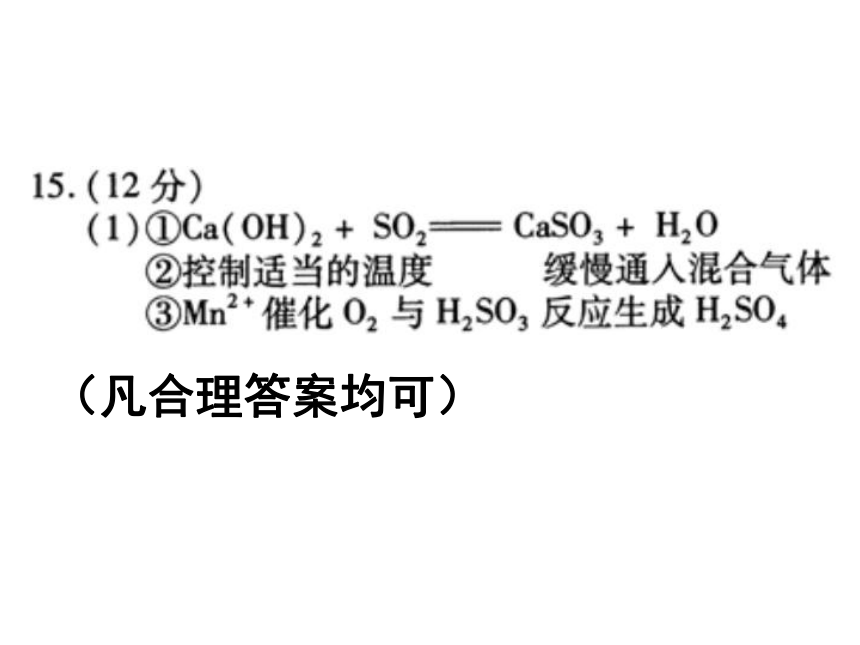
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使尽可能转化完全,在通入和比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。(凡合理答案均可)我们的策略:尊重认知规律,顺应形势变化。
过去复习的几大版块:
基本概念和基础理论(含选修3、4)
元素化合物
有机化学(含选修5)
化学实验1. 化学观点的渗透和建构比具体知识点的复习更为重要。
2. 新旧联系、前后对比,形成新的复习教学中心。
3. 新课程复习中模糊模块间的界限,复习“整体”的化学。
4. 坚持做有教育价值的实验。如何尊重认知规律,顺应形势变化?复习案例:
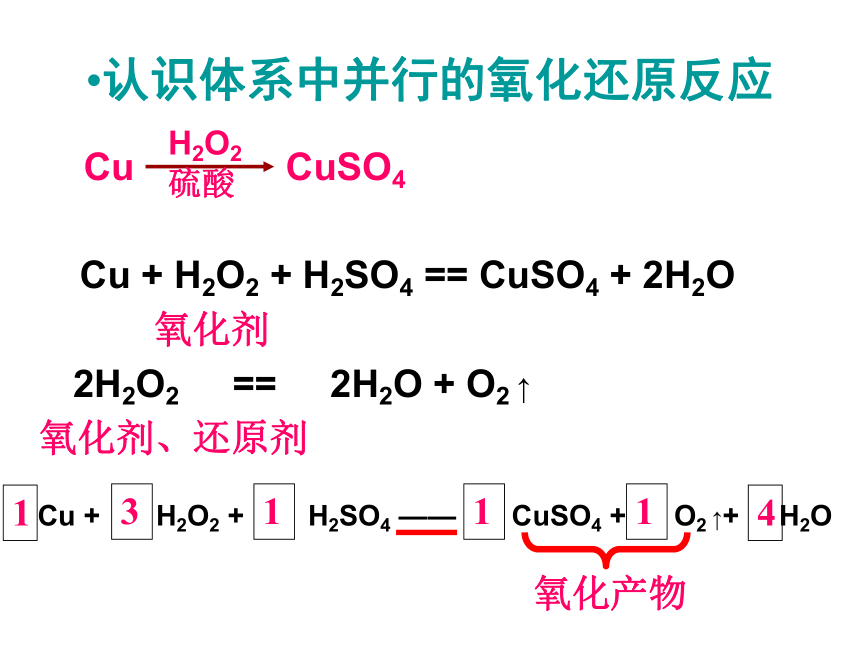
元素化合物硫酸铜的制备问题1:以铜为原料,有哪些方法可制得硫酸铜?写出反应的化学方程式,并评价不同方法用于工业制备的优劣。
问题2:若在铜和稀硫酸的混合物中,不通氧气,而加入某种无色液体,也能得到蓝色溶液,有些什么可能性?
实验探究:1)铜与稀硫酸——不反应
2)加入无色液体(H2O2)——溶液变蓝,产生气泡,
讨论分析原因,用化学方程式来解释。
Cu+H2O2+2H+=Cu2++2H2O 2H2O2=2H2O+O2↑
Cu + H2O2 + H2SO4 == CuSO4 + 2H2O氧化剂2H2O2 == 2H2O + O2 ↑ Cu + H2O2 + H2SO4 —— CuSO4 + O2 ↑+ H2O131114认识体系中并行的氧化还原反应氧化剂、还原剂氧化产物在KI和H2SO4的溶液里加入H2O2,放出大量不溶于水的无色气体(现象是从溶液内部析出大量小气泡),同时溶液呈现棕红色,可使淀粉变蓝。写出化学方程式。
H2O2+2KI+H2SO4===I2+K2SO4+2H2O
2H2O2===2H2O+O2↑
CuSO4与Cu(NO3)2在不同温度下的溶解度(g)进一步认识结晶过程的竞争性、有序性进一步理解化学反应中的催化剂3Cu+2NO3-+8H+===3Cu2++2NO↑+4H2O
2NO+O2===NO2
3NO2+H2O===2HNO3+NO
总的结果 2Cu + O2 +4H+====2Cu2++2H2O HNO3市场上出现过一种一氧化碳检测器,其外观像一张塑料信用卡,正中有一个直径不到2cm的小窗口,露出橙红色固态物质。若发现橙红色转为黑色而在短时间内不复原,表明室内一氧化碳浓度超标,有中毒危险。一氧化碳不超标时,橙红色虽也会变黑却能很快复原。已知检测器的化学成分:亲水性的硅胶、氯化钙、固体酸H8[Si(Mo2O7)6]·28H2O、CuCl2·2H2O和PdCl2·2H2O(注:橙红色为复合色,不必细究)。
(1)CO与PdCl2·2H2O的反应方程式为:
(2) (1)的产物之一与CuCl2·2H2O反应而复原,化学方程式为:
(3) (2)的产物之一复原的反应方程式为:小 结认识体系中并行的氧化还原反应
进一步理解化学反应中的催化剂
进一步认识结晶过程的竞争性、有序性
探究反应机理的实验设计
复习案例:
有机化学1。课程标准和教学要求分必修和选修要求,复习时宜整合。
必修暂不作要求的,选修中到位。
乙炔的性质暂不作要求。
苯的同系物的性质暂不作要求。
卤代烃、酚暂不作要求。
加聚反应和缩聚反应的化学方程式书写暂不作要求。 2。复习安排约用4周时间,24课时:
有机复习第一周:
? 有机物的空间结构 1课时
? 同分异构和同系物 1课时
? 有机物燃烧的计算 1课时
? 烷烯炔芳烃的结构与性质 1课时
练习及讲评 2课时有机复习第二周:
? 醇、酚的结构与性质 1课时
? 醛酮的结构与性质 1课时
? 羧酸、酯的结构与性质 1课时
? 糖类、蛋白质 1课时
练习及讲评 2课时有机复习第三周:
? 有机反应类型 2课时
? 高分子与合成材料 1课时
? 官能团间的相互转化、有机合成 1课时
? 练习与讲评 2课时有机复习第四周:
? 有机框图推断 2课时
? 有机重要实验 2课时
? 练习与讲评 2课时 3。对有机复习课教学的思考(1)联系选修3,多从物质结构角度理解有机物及其反应。(2009江苏21)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
?? (1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式?????????? 。
? ?(2)根据等电子原理,写出CO分子结构式???????????????? 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
?? ??????①甲醇的沸点比甲醛的高,其主要原因是???????????? ;甲醛分子中碳原子轨道的杂化类型为??????????????? 。
??? ???②甲醛分子的空间构型是??????????? ;1mol甲醛分子中σ键的数目为???? 。
?? ???????③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为????????? 。(2010江苏21)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体, O22+的电子式可表示为 ;1mol 中O22+含有的π键数目为 。
(2)将乙炔通入 溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中含有的哑铃形C22-的存在,使晶胞沿一个方向拉长。 CaC2晶体中1个Ca2+周围距离最近的C22-数目为 。理解几种典型分子的立体结构甲烷
长链烷烃
环已烷
金刚烷、乌洛托品(高度对称)
金刚石
水
氨
sp3杂化乙烯
苯
石墨
C60
甲醛
sp2杂化
C240乙炔
氯化铍
sp杂化
关于氢键
理解乙醇的沸点高、与水任意比互溶
理解水溶性:丙三醇>乙二醇>甲醇
画出对羟基苯甲醛分子间氢键。
mp. 115 ℃
bp. 250 ℃
邻羟基苯甲醛
分子内氢键
mp. 2 ℃
bp. 196.5 ℃
根据四种碱基的结构,试说明这四种碱基间通过氢键可能的配对方式(2)整合知识点,复习与新授课采用不同角度
例:羟基的脱水反应一、乙醇的脱水反应1、分子内脱水——消去反应
2、分子间脱水——取代反应二、乙二醇的脱水反应 →
(1) 环氧乙烷
(2)
(3) 12-冠-4 15-冠-5 18-冠-6
?
冠 醚(4)(CH2CH2O)n
缩聚反应三、乙醇与乙酸的脱水反应(酯化反应)
四、乙二酸与乙二醇的脱水反应
五、羟基酸的脱水反应已知六、酯化反应归纳
1、羧酸与醇形成低级酯2、无机酸(含氧酸)与醇、纤维素等形成无机酸酯3、高级脂肪酸与甘油形成油脂
4、二元羧酸与二元醇间生成环酯 5、二元羧酸与二元醇之间缩聚成聚酯
6、a-羟基酸间形成交酯7、二元醇与一元羧酸形成酯
8、二元羧酸与一元醇形成酯(9)多元无机酸与醇形成酯。已知:
现有只含C、H、O的化合物A—F,有关它们的某些信息,已注明在下面的方框内.(1)在化合物A~F中有酯的结构的化合物是(填字母代号) .
(2)写出化合物A和F的结构简式.七、氨基酸的脱水 蛋白质是氨基酸分子间脱水(羧基脱一OH,氨基脱H)缩合而成的高分子化合物,蛋白质属于高分子化合物。例 蛋白质在动物体内的消耗过程可表示为:蛋白质
多肽 氨基酸
今有一种多肽,其化学式是C55H70O19N10,消化后只得到下列四种氨基酸:
甘氨酸 丙氨酸
苯丙氨酸 谷氨酸
请填写下列空白:
(1)该多肽是 肽(填数字)。
(2)一分子多肽被消化后,得____个谷氨酸分子,____个苯丙氨酸分子。
南京师大附中 保志明
2010年8月17日 沭阳一。对新课程高考的认识课标教材在变,化学的基本原理没有变。
载体情境在变,考查的知识点没有变。
理念、观念在变,考试的形式没有变。
考试的形式没有变, 命题人员在变。
阅卷的形式没有变,阅卷的标准可能变。[2010江苏15] (12分)高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
在烧瓶中(装置见右图)加入一定量和水,搅拌,通入和混合气体,反应3h。停止通入,继续反应片刻,过滤(已知)
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使尽可能转化完全,在通入和比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。(凡合理答案均可)我们的策略:尊重认知规律,顺应形势变化。
过去复习的几大版块:
基本概念和基础理论(含选修3、4)
元素化合物
有机化学(含选修5)
化学实验1. 化学观点的渗透和建构比具体知识点的复习更为重要。
2. 新旧联系、前后对比,形成新的复习教学中心。
3. 新课程复习中模糊模块间的界限,复习“整体”的化学。
4. 坚持做有教育价值的实验。如何尊重认知规律,顺应形势变化?复习案例:
元素化合物硫酸铜的制备问题1:以铜为原料,有哪些方法可制得硫酸铜?写出反应的化学方程式,并评价不同方法用于工业制备的优劣。
问题2:若在铜和稀硫酸的混合物中,不通氧气,而加入某种无色液体,也能得到蓝色溶液,有些什么可能性?
实验探究:1)铜与稀硫酸——不反应
2)加入无色液体(H2O2)——溶液变蓝,产生气泡,
讨论分析原因,用化学方程式来解释。
Cu+H2O2+2H+=Cu2++2H2O 2H2O2=2H2O+O2↑
Cu + H2O2 + H2SO4 == CuSO4 + 2H2O氧化剂2H2O2 == 2H2O + O2 ↑ Cu + H2O2 + H2SO4 —— CuSO4 + O2 ↑+ H2O131114认识体系中并行的氧化还原反应氧化剂、还原剂氧化产物在KI和H2SO4的溶液里加入H2O2,放出大量不溶于水的无色气体(现象是从溶液内部析出大量小气泡),同时溶液呈现棕红色,可使淀粉变蓝。写出化学方程式。
H2O2+2KI+H2SO4===I2+K2SO4+2H2O
2H2O2===2H2O+O2↑
CuSO4与Cu(NO3)2在不同温度下的溶解度(g)进一步认识结晶过程的竞争性、有序性进一步理解化学反应中的催化剂3Cu+2NO3-+8H+===3Cu2++2NO↑+4H2O
2NO+O2===NO2
3NO2+H2O===2HNO3+NO
总的结果 2Cu + O2 +4H+====2Cu2++2H2O HNO3市场上出现过一种一氧化碳检测器,其外观像一张塑料信用卡,正中有一个直径不到2cm的小窗口,露出橙红色固态物质。若发现橙红色转为黑色而在短时间内不复原,表明室内一氧化碳浓度超标,有中毒危险。一氧化碳不超标时,橙红色虽也会变黑却能很快复原。已知检测器的化学成分:亲水性的硅胶、氯化钙、固体酸H8[Si(Mo2O7)6]·28H2O、CuCl2·2H2O和PdCl2·2H2O(注:橙红色为复合色,不必细究)。
(1)CO与PdCl2·2H2O的反应方程式为:
(2) (1)的产物之一与CuCl2·2H2O反应而复原,化学方程式为:
(3) (2)的产物之一复原的反应方程式为:小 结认识体系中并行的氧化还原反应
进一步理解化学反应中的催化剂
进一步认识结晶过程的竞争性、有序性
探究反应机理的实验设计
复习案例:
有机化学1。课程标准和教学要求分必修和选修要求,复习时宜整合。
必修暂不作要求的,选修中到位。
乙炔的性质暂不作要求。
苯的同系物的性质暂不作要求。
卤代烃、酚暂不作要求。
加聚反应和缩聚反应的化学方程式书写暂不作要求。 2。复习安排约用4周时间,24课时:
有机复习第一周:
? 有机物的空间结构 1课时
? 同分异构和同系物 1课时
? 有机物燃烧的计算 1课时
? 烷烯炔芳烃的结构与性质 1课时
练习及讲评 2课时有机复习第二周:
? 醇、酚的结构与性质 1课时
? 醛酮的结构与性质 1课时
? 羧酸、酯的结构与性质 1课时
? 糖类、蛋白质 1课时
练习及讲评 2课时有机复习第三周:
? 有机反应类型 2课时
? 高分子与合成材料 1课时
? 官能团间的相互转化、有机合成 1课时
? 练习与讲评 2课时有机复习第四周:
? 有机框图推断 2课时
? 有机重要实验 2课时
? 练习与讲评 2课时 3。对有机复习课教学的思考(1)联系选修3,多从物质结构角度理解有机物及其反应。(2009江苏21)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
?? (1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式?????????? 。
? ?(2)根据等电子原理,写出CO分子结构式???????????????? 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
?? ??????①甲醇的沸点比甲醛的高,其主要原因是???????????? ;甲醛分子中碳原子轨道的杂化类型为??????????????? 。
??? ???②甲醛分子的空间构型是??????????? ;1mol甲醛分子中σ键的数目为???? 。
?? ???????③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为????????? 。(2010江苏21)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体, O22+的电子式可表示为 ;1mol 中O22+含有的π键数目为 。
(2)将乙炔通入 溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中含有的哑铃形C22-的存在,使晶胞沿一个方向拉长。 CaC2晶体中1个Ca2+周围距离最近的C22-数目为 。理解几种典型分子的立体结构甲烷
长链烷烃
环已烷
金刚烷、乌洛托品(高度对称)
金刚石
水
氨
sp3杂化乙烯
苯
石墨
C60
甲醛
sp2杂化
C240乙炔
氯化铍
sp杂化
关于氢键
理解乙醇的沸点高、与水任意比互溶
理解水溶性:丙三醇>乙二醇>甲醇
画出对羟基苯甲醛分子间氢键。
mp. 115 ℃
bp. 250 ℃
邻羟基苯甲醛
分子内氢键
mp. 2 ℃
bp. 196.5 ℃
根据四种碱基的结构,试说明这四种碱基间通过氢键可能的配对方式(2)整合知识点,复习与新授课采用不同角度
例:羟基的脱水反应一、乙醇的脱水反应1、分子内脱水——消去反应
2、分子间脱水——取代反应二、乙二醇的脱水反应 →
(1) 环氧乙烷
(2)
(3) 12-冠-4 15-冠-5 18-冠-6
?
冠 醚(4)(CH2CH2O)n
缩聚反应三、乙醇与乙酸的脱水反应(酯化反应)
四、乙二酸与乙二醇的脱水反应
五、羟基酸的脱水反应已知六、酯化反应归纳
1、羧酸与醇形成低级酯2、无机酸(含氧酸)与醇、纤维素等形成无机酸酯3、高级脂肪酸与甘油形成油脂
4、二元羧酸与二元醇间生成环酯 5、二元羧酸与二元醇之间缩聚成聚酯
6、a-羟基酸间形成交酯7、二元醇与一元羧酸形成酯
8、二元羧酸与一元醇形成酯(9)多元无机酸与醇形成酯。已知:
现有只含C、H、O的化合物A—F,有关它们的某些信息,已注明在下面的方框内.(1)在化合物A~F中有酯的结构的化合物是(填字母代号) .
(2)写出化合物A和F的结构简式.七、氨基酸的脱水 蛋白质是氨基酸分子间脱水(羧基脱一OH,氨基脱H)缩合而成的高分子化合物,蛋白质属于高分子化合物。例 蛋白质在动物体内的消耗过程可表示为:蛋白质
多肽 氨基酸
今有一种多肽,其化学式是C55H70O19N10,消化后只得到下列四种氨基酸:
甘氨酸 丙氨酸
苯丙氨酸 谷氨酸
请填写下列空白:
(1)该多肽是 肽(填数字)。
(2)一分子多肽被消化后,得____个谷氨酸分子,____个苯丙氨酸分子。
同课章节目录
