化学:2.2《化学反应的限度》第2课时课件(2)(鲁科版选修4)
文档属性
| 名称 | 化学:2.2《化学反应的限度》第2课时课件(2)(鲁科版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-03-16 00:00:00 | ||
图片预览







文档简介
课件21张PPT。《化学反应原理》(选修4)
第2章 化学反应的方向、限度与速率第2节 化学反应的限度
(第二课时)1 000 K时反应C(s)+2H2(g) CH4(g)的K=8.28×107(mol·L-1)-1,
当各气体物质的量浓度分别为H2: 0.1 mol·L-1,CH4:0.2 mol·L-1时,上述
反应是否达到平衡状态?若未处于化学平衡状态,反应在向哪个方向进行?问题探究知识回顾Q和K的相对大小与平衡移动的关系是怎样的?判断依据:Q与K的相对大小Q=K 可逆反应处于平衡状态
Q<K 化学平衡正向(向右)移动
Q>K 化学平衡逆向(向左)移动【教学目标】
知识与技能:通过实验探究温度、浓度对化学平衡
的影响,并能用相关理论加以解释。
过程与方法:通过探究活动,提高实验探究的能力。
情感、态度与价值观:通过学习,认识化学科学对个
人和社会发展的贡献。
【学习重点】温度、浓度对化学平衡的影响。
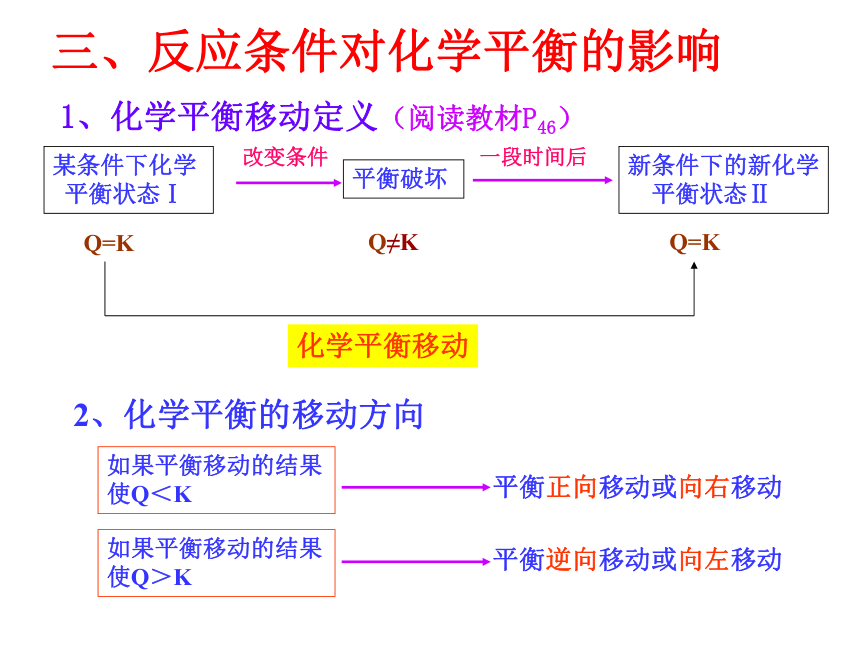
【学习难点】温度、浓度对化学平衡的影响。三、反应条件对化学平衡的影响1、化学平衡移动定义(阅读教材P46)某条件下化学
平衡状态Ⅰ Q=KQ≠K Q=K平衡破坏新条件下的新化学
平衡状态Ⅱ2、化学平衡的移动方向平衡正向移动或向右移动如果平衡移动的结果
使Q<K如果平衡移动的结果
使Q>K平衡逆向移动或向左移动1、温度升高,该反应的化学平衡常K______ (增大或减小)
2、结合Q与K的相对大小预测平衡移动的方向及反应现象
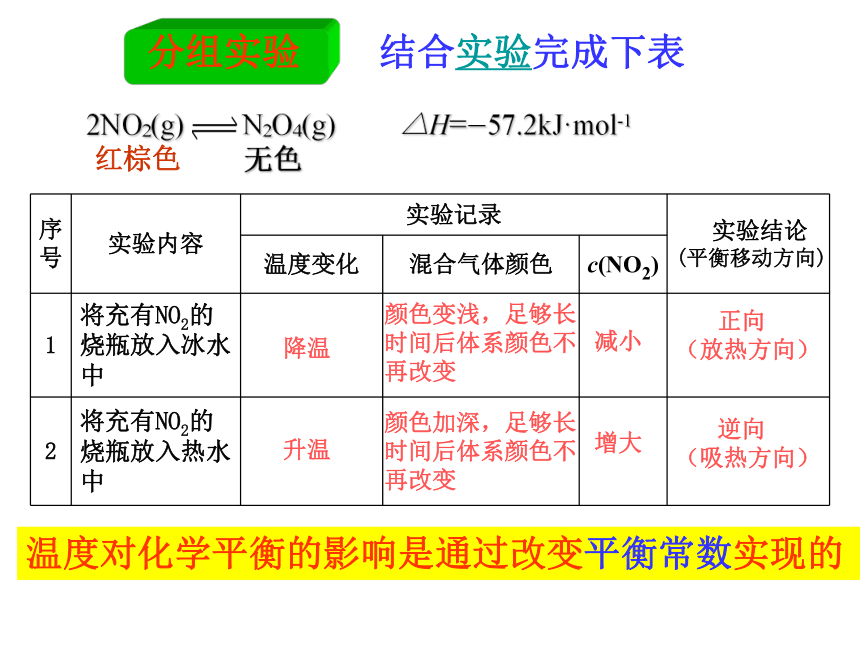
3、如何设计实验探究温度对化学平衡的影响呢?0.6016.8K/ (mol·L-1)-1333298T/K(一)温度的影响2NO2(g) N2O4(g) △H=-57.2kJ·mol-1
红棕色 无色 实验原理:活动·探究减小实验用品: 充有NO2的平衡管 2个100ml烧杯
热水 冰水降温颜色变浅,足够长
时间后体系颜色不
再改变减小 正向
(放热方向)升温增大 逆向
(吸热方向)颜色加深,足够长
时间后体系颜色不
再改变结合实验完成下表温度对化学平衡的影响是通过改变平衡常数实现的2NO2(g) N2O4(g) △H=-57.2kJ·mol-1
红棕色 无色 升高温度
⑴放热反应的化学平衡常数K_____,浓度商Q______K,化学平
衡向____反应方向移动(填“正”或“逆”),即向______方向
移动(填“吸热”或“放热”)
⑵吸热反应的化学平衡常数K______, 浓度商Q______K,化学平衡向____反应方向移动(填“正”或“逆”),即向______方向
移动(填“吸热”或“放热”)
分析表格中数据,总结温度改变与化学平衡移动的关系2.00.0015K/ (mol·L-1)2673473 T/K0.6016.8K/ (mol·L-1)-1333298T/K减小增大独立思考><逆吸热正吸热 降低温度
⑴放热反应的化学平衡常数K_____,浓度商Q______K,化学平
衡向____反应方向移动(填“正”或“逆”),即向______方向
移动(填“吸热”或“放热”)
⑵吸热反应的化学平衡常数K______, 浓度商Q______K,化学平衡向____反应方向移动(填“正”或“逆”),即向______方向
移动(填“吸热”或“放热”)
分析表格中数据,总结温度改变与化学平衡移动的关系2.00.0015K/ (mol·L-1)2673473 T/K0.6016.8K/ (mol·L-1)-1333T/K独立思考298增大<正放热减小>逆放热 在一定体积的 密闭容器中,反应CO2(g) + H2(g)
CO(g) + H2O(g) 的化学平衡常数和温度的关系如下表:回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应的正反应为 反应(填”吸热”或”放热”)。
(3)某温度下,平衡浓度符合下式:
c(CO2)c(H2) =c(CO) c(H2O),可判断此时的温度为 ℃。吸热830迁移 应用(二)浓度的影响实验原理:活动探究1、根据浓度商Q的表达式分析:增大了反应物的浓度或
减少了生成物的浓度,Q如何改变?反之Q如何改变?
2、根据Q与K的相对大小预测化学平衡的移动方向?
3、如何设计实验探究浓度对化学平衡的影响呢?实验用品: 0.01 mol·L-1 FeCl3溶液 1 mol·L-1 FeCl3溶液
0.03mol·L-1KSCN溶液 1mol·L-1KSCN溶液
1mol·L-1NaOH溶液 Fe粉 试管 胶头滴管 药匙
初始溶液呈红色;正向移动初始溶液呈红色;正向移动Q < KQ <KQ、K关系加KSCN溶液后
红色加深加FeCl3溶液后红色加深初始溶液呈红色;加NaOH溶液后
红色变浅初始溶液呈红色;加Fe粉红色变浅逆向移动逆向移动Q >KQ >K平衡移动减小减小增大增大Q < KQ < KQ > KQ > K平衡右移平衡右移平衡左移平衡左移增大反应物的浓度或减少生成物的浓度,Q<K,平衡向正反应方向移动
减少反应物的浓度或增大生成物的浓度,Q>K,平衡向逆反应方向移动在一定温度下对于化学反应:请讨论并填写下表。交流﹒研讨减小反应物浓度追踪探讨 固体、纯液体的浓度是一常数,增加固体或纯液体的量,
平衡不发生移动1、向已达平衡状态的体系中,滴加几滴KCl溶液,平衡是否
发生移动?为什么?改变浓度时,只有改变参与反应的离子的浓度,平衡才会发生移动强调不移动不变提高O2在原料气中的比例,使平衡正向移动,进而提高SO2的平衡转化率,降低生产成本。工业生产上适当的增大廉价的反应物的浓度或将生成物
及时从体系中抽走,能使化学平衡向正反应方向移动,
可提高价格较高原料的转化率,以降低生产成本。迁移应用 2、2SO2(g) + O2(g) 2SO3(g) △H = _ 197.8kJ·mol-1
是硫酸制造工业的基本反 应。在生产中通常采用通入过量的空气的方法。为什么?1、某自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应
的化学方程式为:NH3+HClO H2O+NH2Cl,NH2Cl比HClO
稳定。请用化学平衡的观点分析加液氨能延长液氯杀菌时间的原因。 HClO能杀菌消毒,当降低C(HClO)时,平衡逆向移动,使NH2Cl转化为HClO。而NH2Cl比HClO稳定,故可延长液氯杀菌的时间 在一定条件下,反应H2(g)+Br2(g) 2HBr(g) △H<0,
达到化学平衡状态且其它条件不变时:
(1)如果升高温度,平衡混合物的颜色_________;
(2)如果在体积固定的容器中加入一定量的氢气,
化学平衡 移动(正向、逆向或不移动),
Br2(g)的平衡转化率_____(变大、变小或不变)。
典例剖析加深正向变大原平衡状态 新平衡状态 化学平 衡 移 动浓度的改变,引起Q的改变 ;
借助Q与K的相对大小进行判断 降低温度,平衡向放热方向移动温度对化学平衡的影响是
通过改变平衡常数来实现的改变浓度,若Q > K,平衡逆向移动改变浓度,若Q < K,平衡正向移动小结蓝色 粉红色课堂达标评价 1、 在一定条件下,反应CO + NO2 CO2 + NO达到平衡后,降低温度,混合气体的颜色变浅。下列判断正确的是( )
A. 正反应为吸热反应 B. 正反应为放热反应
C. CO的平衡转化率降低 D. 各物质的浓度不变BBB4、已知合成氨的热化学方程式:
N2(g) + 3H2(g) 2NH3(g) △H(298 K )=-57.2KJ·mol–1
请从温度和浓度的角度进行分析,怎样提高平衡时氨的产量?1.降低反应的温度
2.增加氮气或氢气的浓度
3.及时分离出氨气1、完成教材P52迁移应用1
2、复习巩固温度、浓度对化学平衡的影响;预习压强去化学平衡的影响
3、查阅资料:奇妙的化学振荡反应
作业
第2章 化学反应的方向、限度与速率第2节 化学反应的限度
(第二课时)1 000 K时反应C(s)+2H2(g) CH4(g)的K=8.28×107(mol·L-1)-1,
当各气体物质的量浓度分别为H2: 0.1 mol·L-1,CH4:0.2 mol·L-1时,上述
反应是否达到平衡状态?若未处于化学平衡状态,反应在向哪个方向进行?问题探究知识回顾Q和K的相对大小与平衡移动的关系是怎样的?判断依据:Q与K的相对大小Q=K 可逆反应处于平衡状态
Q<K 化学平衡正向(向右)移动
Q>K 化学平衡逆向(向左)移动【教学目标】
知识与技能:通过实验探究温度、浓度对化学平衡
的影响,并能用相关理论加以解释。
过程与方法:通过探究活动,提高实验探究的能力。
情感、态度与价值观:通过学习,认识化学科学对个
人和社会发展的贡献。
【学习重点】温度、浓度对化学平衡的影响。
【学习难点】温度、浓度对化学平衡的影响。三、反应条件对化学平衡的影响1、化学平衡移动定义(阅读教材P46)某条件下化学
平衡状态Ⅰ Q=KQ≠K Q=K平衡破坏新条件下的新化学
平衡状态Ⅱ2、化学平衡的移动方向平衡正向移动或向右移动如果平衡移动的结果
使Q<K如果平衡移动的结果
使Q>K平衡逆向移动或向左移动1、温度升高,该反应的化学平衡常K______ (增大或减小)
2、结合Q与K的相对大小预测平衡移动的方向及反应现象
3、如何设计实验探究温度对化学平衡的影响呢?0.6016.8K/ (mol·L-1)-1333298T/K(一)温度的影响2NO2(g) N2O4(g) △H=-57.2kJ·mol-1
红棕色 无色 实验原理:活动·探究减小实验用品: 充有NO2的平衡管 2个100ml烧杯
热水 冰水降温颜色变浅,足够长
时间后体系颜色不
再改变减小 正向
(放热方向)升温增大 逆向
(吸热方向)颜色加深,足够长
时间后体系颜色不
再改变结合实验完成下表温度对化学平衡的影响是通过改变平衡常数实现的2NO2(g) N2O4(g) △H=-57.2kJ·mol-1
红棕色 无色 升高温度
⑴放热反应的化学平衡常数K_____,浓度商Q______K,化学平
衡向____反应方向移动(填“正”或“逆”),即向______方向
移动(填“吸热”或“放热”)
⑵吸热反应的化学平衡常数K______, 浓度商Q______K,化学平衡向____反应方向移动(填“正”或“逆”),即向______方向
移动(填“吸热”或“放热”)
分析表格中数据,总结温度改变与化学平衡移动的关系2.00.0015K/ (mol·L-1)2673473 T/K0.6016.8K/ (mol·L-1)-1333298T/K减小增大独立思考><逆吸热正吸热 降低温度
⑴放热反应的化学平衡常数K_____,浓度商Q______K,化学平
衡向____反应方向移动(填“正”或“逆”),即向______方向
移动(填“吸热”或“放热”)
⑵吸热反应的化学平衡常数K______, 浓度商Q______K,化学平衡向____反应方向移动(填“正”或“逆”),即向______方向
移动(填“吸热”或“放热”)
分析表格中数据,总结温度改变与化学平衡移动的关系2.00.0015K/ (mol·L-1)2673473 T/K0.6016.8K/ (mol·L-1)-1333T/K独立思考298增大<正放热减小>逆放热 在一定体积的 密闭容器中,反应CO2(g) + H2(g)
CO(g) + H2O(g) 的化学平衡常数和温度的关系如下表:回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应的正反应为 反应(填”吸热”或”放热”)。
(3)某温度下,平衡浓度符合下式:
c(CO2)c(H2) =c(CO) c(H2O),可判断此时的温度为 ℃。吸热830迁移 应用(二)浓度的影响实验原理:活动探究1、根据浓度商Q的表达式分析:增大了反应物的浓度或
减少了生成物的浓度,Q如何改变?反之Q如何改变?
2、根据Q与K的相对大小预测化学平衡的移动方向?
3、如何设计实验探究浓度对化学平衡的影响呢?实验用品: 0.01 mol·L-1 FeCl3溶液 1 mol·L-1 FeCl3溶液
0.03mol·L-1KSCN溶液 1mol·L-1KSCN溶液
1mol·L-1NaOH溶液 Fe粉 试管 胶头滴管 药匙
初始溶液呈红色;正向移动初始溶液呈红色;正向移动Q < KQ <KQ、K关系加KSCN溶液后
红色加深加FeCl3溶液后红色加深初始溶液呈红色;加NaOH溶液后
红色变浅初始溶液呈红色;加Fe粉红色变浅逆向移动逆向移动Q >KQ >K平衡移动减小减小增大增大Q < KQ < KQ > KQ > K平衡右移平衡右移平衡左移平衡左移增大反应物的浓度或减少生成物的浓度,Q<K,平衡向正反应方向移动
减少反应物的浓度或增大生成物的浓度,Q>K,平衡向逆反应方向移动在一定温度下对于化学反应:请讨论并填写下表。交流﹒研讨减小反应物浓度追踪探讨 固体、纯液体的浓度是一常数,增加固体或纯液体的量,
平衡不发生移动1、向已达平衡状态的体系中,滴加几滴KCl溶液,平衡是否
发生移动?为什么?改变浓度时,只有改变参与反应的离子的浓度,平衡才会发生移动强调不移动不变提高O2在原料气中的比例,使平衡正向移动,进而提高SO2的平衡转化率,降低生产成本。工业生产上适当的增大廉价的反应物的浓度或将生成物
及时从体系中抽走,能使化学平衡向正反应方向移动,
可提高价格较高原料的转化率,以降低生产成本。迁移应用 2、2SO2(g) + O2(g) 2SO3(g) △H = _ 197.8kJ·mol-1
是硫酸制造工业的基本反 应。在生产中通常采用通入过量的空气的方法。为什么?1、某自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应
的化学方程式为:NH3+HClO H2O+NH2Cl,NH2Cl比HClO
稳定。请用化学平衡的观点分析加液氨能延长液氯杀菌时间的原因。 HClO能杀菌消毒,当降低C(HClO)时,平衡逆向移动,使NH2Cl转化为HClO。而NH2Cl比HClO稳定,故可延长液氯杀菌的时间 在一定条件下,反应H2(g)+Br2(g) 2HBr(g) △H<0,
达到化学平衡状态且其它条件不变时:
(1)如果升高温度,平衡混合物的颜色_________;
(2)如果在体积固定的容器中加入一定量的氢气,
化学平衡 移动(正向、逆向或不移动),
Br2(g)的平衡转化率_____(变大、变小或不变)。
典例剖析加深正向变大原平衡状态 新平衡状态 化学平 衡 移 动浓度的改变,引起Q的改变 ;
借助Q与K的相对大小进行判断 降低温度,平衡向放热方向移动温度对化学平衡的影响是
通过改变平衡常数来实现的改变浓度,若Q > K,平衡逆向移动改变浓度,若Q < K,平衡正向移动小结蓝色 粉红色课堂达标评价 1、 在一定条件下,反应CO + NO2 CO2 + NO达到平衡后,降低温度,混合气体的颜色变浅。下列判断正确的是( )
A. 正反应为吸热反应 B. 正反应为放热反应
C. CO的平衡转化率降低 D. 各物质的浓度不变BBB4、已知合成氨的热化学方程式:
N2(g) + 3H2(g) 2NH3(g) △H(298 K )=-57.2KJ·mol–1
请从温度和浓度的角度进行分析,怎样提高平衡时氨的产量?1.降低反应的温度
2.增加氮气或氢气的浓度
3.及时分离出氨气1、完成教材P52迁移应用1
2、复习巩固温度、浓度对化学平衡的影响;预习压强去化学平衡的影响
3、查阅资料:奇妙的化学振荡反应
作业
