不同类型的晶体
图片预览





文档简介
课件22张PPT。不同类型的晶体晶体的概念什么叫晶体?晶体:具有规则几何外形的固体叫晶体。
晶体中的微粒按一定的规则排列。
阴阳离子
分子
原子
阴阳离子间以离子键结合,形成离子晶体。
分子间以分子间作用力(又称范德华力)结合,
形成 分子晶体。
原子间以共价键结合,形成原子晶体。
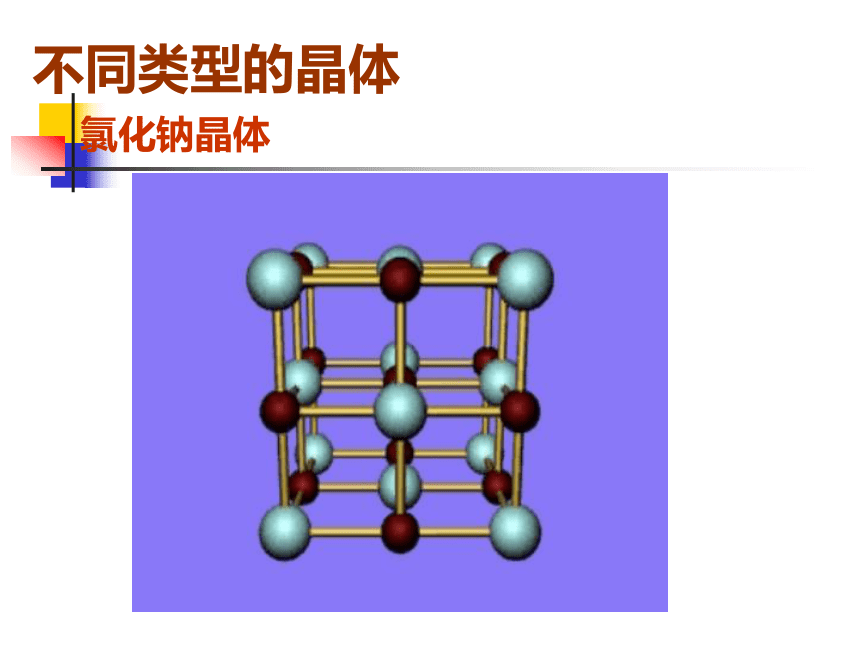
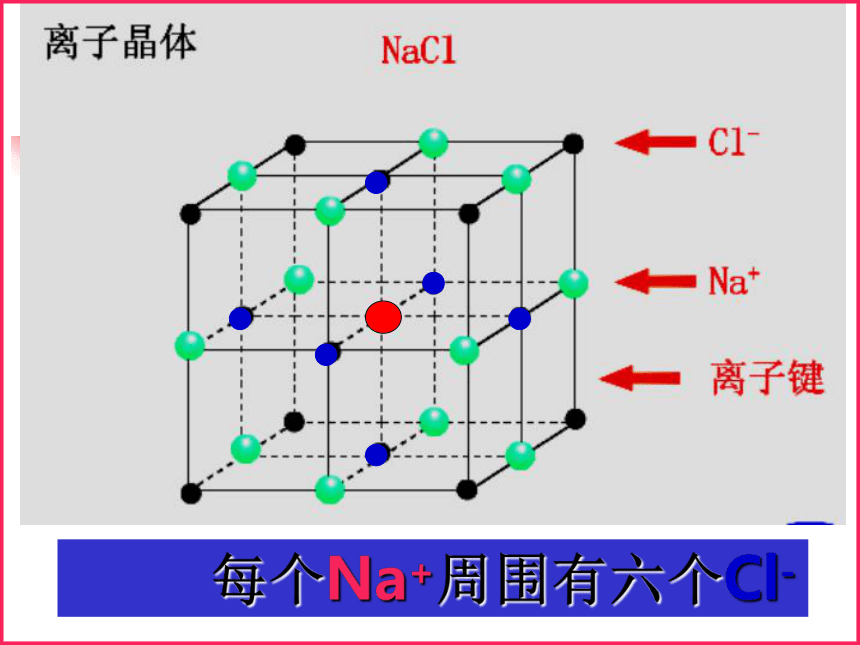
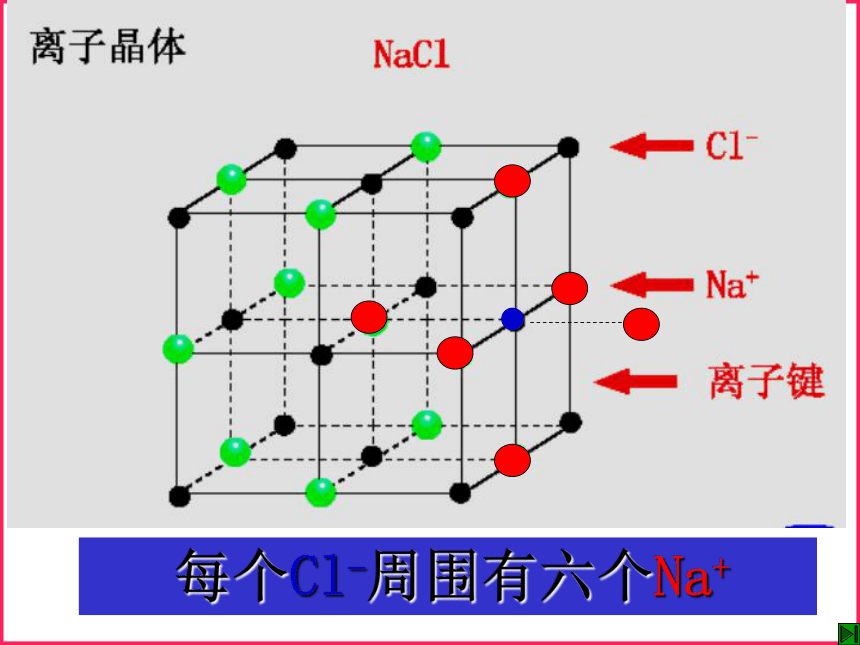
构成晶体的基本微粒和作用力不同类型的晶体氯化钠晶体 每个Na+周围有六个Cl- 每个Cl-周围有六个Na+一、离子晶体1.定义:
2.特点:
3.属于离子晶体的物质:
离子间通过离子键结合而成的晶体。
无单个分子存在;如:NaCl不表示分子式。
熔沸点较高,硬度较大。
水溶液或者熔融状态下均导电。
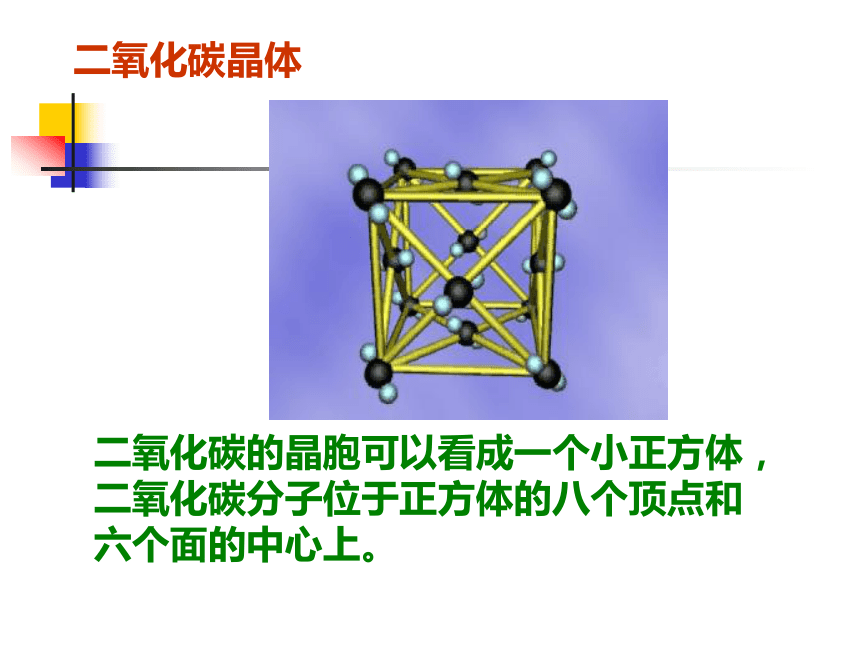
强碱、部分金属氧化物、部分盐类。二氧化碳晶体二氧化碳的晶胞可以看成一个小正方体,二氧化碳分子位于正方体的八个顶点和六个面的中心上。二、分子晶体1.定义:
2.特点:
3.形成分子晶体的物质:
分子间通过分子间作用力结合成的晶体。
有单个分子存在;化学式就是分子式。
熔沸点较低,硬度较小。
液态不导电,溶于水有的导电
卤素、氧气、氢气等多数非金属单质、
稀有气体、非金属氢化物、多数非金
属氧化物等。金刚石1.金刚石属于原子晶体,呈空间网状结构。2.金刚石晶体中碳碳键的键角为109°28′。3.金刚石晶体中基本结构单元:正四面体4.金刚石晶体最小的碳原子环为六元环。二氧化硅晶体1.二氧化硅属于原子晶体,呈空间网状结构。2.二氧化硅晶体中硅氧键的键角为109°28′。3.二氧化硅晶体中1个硅原子周围有4个氧原子,1个氧原子有2个硅原子;1个硅原子占有4个硅氧键,1个氧原子占有2个硅氧键。4.二氧化硅晶体最小的原子环为十二元环,其中有6个硅原子,6个氧原子。三、原子晶体1.定义:
2.特点:
3.属于原子晶体的物质:
原子间通过共价键结合成的具有
空间网状结构的晶体。
同种或异种原子
熔沸点很高,硬度很大。
不导电,难溶于水
金刚石、单晶硅、碳化硅、二氧化硅等。四、金属晶体1.定义:
2.物理性质:
3.属于金属晶体的物质:金属阳离子和自由电子通过金属键形成的晶体。
金属键:金属阳离子和自由电子之间强烈的相互 作用
构晶微粒:金属阳离子、自由电子有金属光泽、导电、导热、延展性金属单质或合金
如:钠、钾、铜石墨的晶体结构石墨石墨为什么很软?
石墨的熔沸点为什么很高?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。—混合型晶体拓展视野总结:四类晶体结构与性质的比较晶体粒子粒子间作用硬 度熔点溶解性导电性阴、阳离子分子原子金属阳离子、自由电子金属键离子键分子间作用力共价键较大较小很大一般较大,部分小较高较低很高有高有低多数易溶于水有的溶,有的不溶难溶难溶,有些可与水反应熔化或溶于水能导电不易导电不易导电 良导体
(导电传热)观察与思考
4.教材表1-10列出了几种晶体的熔点、硬度。联
系它们所属的晶体类型,体会四类晶体的性质特
点。
答案 通过观察,我们发现除了金属晶体之间的差
异较大,其他三种晶体,同一类晶体之间的性质有
一定的相似性,不同类晶体之间的性质有一定的差
异。观察熔点、硬度,我们可以发现熔点、硬度由
高到低一般来说:原子晶体>离子晶体>分子晶体。
而金属晶体的熔、沸点差别较大。如钨的熔点高达
3410℃,比原子晶体SiO2的熔点还高,而Na的熔点
很低,比一些分子晶体的熔点还低。 晶体类型的判断从组成上判断(仅限于中学范围):
金属单质:金属晶体
有无金属离子或NH4+?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;
由高到低一般来说:原子晶体>离子晶体>分子晶体。
而金属晶体的熔、沸点差别较大。
熔融状态的导电性。(导电:离子晶体、金属晶体) 课堂训练下列物质所属晶体类型分类正确的是 ( )1、下列物质所属晶体类型分类正确的是 ( )D课堂练习题2. 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.SO2和SiO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
3.下列物质的晶体中,不存在分子的是 ( )
A、二氧化碳 B、二氧化硫
C、二氧化硅 D、二硫化碳
4、下列晶体熔化时,不需要破坏化学键的是 ( )
A、金刚石 B、干冰
C、食盐 D、晶体硅BCB5、实现下列变化时,需克服相同类型作用力的是( )
(A)水晶和干冰的熔化 (B)食盐和冰醋酸熔化
(C)液溴和液汞的气化 (D)纯碱和烧碱的熔化6.在下列有关晶体的叙述中错误的是( )
A.离子晶体中,一定存在离子键
B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高
D.稀有气体的原子能形成分子晶体DC
晶体中的微粒按一定的规则排列。
阴阳离子
分子
原子
阴阳离子间以离子键结合,形成离子晶体。
分子间以分子间作用力(又称范德华力)结合,
形成 分子晶体。
原子间以共价键结合,形成原子晶体。
构成晶体的基本微粒和作用力不同类型的晶体氯化钠晶体 每个Na+周围有六个Cl- 每个Cl-周围有六个Na+一、离子晶体1.定义:
2.特点:
3.属于离子晶体的物质:
离子间通过离子键结合而成的晶体。
无单个分子存在;如:NaCl不表示分子式。
熔沸点较高,硬度较大。
水溶液或者熔融状态下均导电。
强碱、部分金属氧化物、部分盐类。二氧化碳晶体二氧化碳的晶胞可以看成一个小正方体,二氧化碳分子位于正方体的八个顶点和六个面的中心上。二、分子晶体1.定义:
2.特点:
3.形成分子晶体的物质:
分子间通过分子间作用力结合成的晶体。
有单个分子存在;化学式就是分子式。
熔沸点较低,硬度较小。
液态不导电,溶于水有的导电
卤素、氧气、氢气等多数非金属单质、
稀有气体、非金属氢化物、多数非金
属氧化物等。金刚石1.金刚石属于原子晶体,呈空间网状结构。2.金刚石晶体中碳碳键的键角为109°28′。3.金刚石晶体中基本结构单元:正四面体4.金刚石晶体最小的碳原子环为六元环。二氧化硅晶体1.二氧化硅属于原子晶体,呈空间网状结构。2.二氧化硅晶体中硅氧键的键角为109°28′。3.二氧化硅晶体中1个硅原子周围有4个氧原子,1个氧原子有2个硅原子;1个硅原子占有4个硅氧键,1个氧原子占有2个硅氧键。4.二氧化硅晶体最小的原子环为十二元环,其中有6个硅原子,6个氧原子。三、原子晶体1.定义:
2.特点:
3.属于原子晶体的物质:
原子间通过共价键结合成的具有
空间网状结构的晶体。
同种或异种原子
熔沸点很高,硬度很大。
不导电,难溶于水
金刚石、单晶硅、碳化硅、二氧化硅等。四、金属晶体1.定义:
2.物理性质:
3.属于金属晶体的物质:金属阳离子和自由电子通过金属键形成的晶体。
金属键:金属阳离子和自由电子之间强烈的相互 作用
构晶微粒:金属阳离子、自由电子有金属光泽、导电、导热、延展性金属单质或合金
如:钠、钾、铜石墨的晶体结构石墨石墨为什么很软?
石墨的熔沸点为什么很高?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。—混合型晶体拓展视野总结:四类晶体结构与性质的比较晶体粒子粒子间作用硬 度熔点溶解性导电性阴、阳离子分子原子金属阳离子、自由电子金属键离子键分子间作用力共价键较大较小很大一般较大,部分小较高较低很高有高有低多数易溶于水有的溶,有的不溶难溶难溶,有些可与水反应熔化或溶于水能导电不易导电不易导电 良导体
(导电传热)观察与思考
4.教材表1-10列出了几种晶体的熔点、硬度。联
系它们所属的晶体类型,体会四类晶体的性质特
点。
答案 通过观察,我们发现除了金属晶体之间的差
异较大,其他三种晶体,同一类晶体之间的性质有
一定的相似性,不同类晶体之间的性质有一定的差
异。观察熔点、硬度,我们可以发现熔点、硬度由
高到低一般来说:原子晶体>离子晶体>分子晶体。
而金属晶体的熔、沸点差别较大。如钨的熔点高达
3410℃,比原子晶体SiO2的熔点还高,而Na的熔点
很低,比一些分子晶体的熔点还低。 晶体类型的判断从组成上判断(仅限于中学范围):
金属单质:金属晶体
有无金属离子或NH4+?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;
由高到低一般来说:原子晶体>离子晶体>分子晶体。
而金属晶体的熔、沸点差别较大。
熔融状态的导电性。(导电:离子晶体、金属晶体) 课堂训练下列物质所属晶体类型分类正确的是 ( )1、下列物质所属晶体类型分类正确的是 ( )D课堂练习题2. 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.SO2和SiO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
3.下列物质的晶体中,不存在分子的是 ( )
A、二氧化碳 B、二氧化硫
C、二氧化硅 D、二硫化碳
4、下列晶体熔化时,不需要破坏化学键的是 ( )
A、金刚石 B、干冰
C、食盐 D、晶体硅BCB5、实现下列变化时,需克服相同类型作用力的是( )
(A)水晶和干冰的熔化 (B)食盐和冰醋酸熔化
(C)液溴和液汞的气化 (D)纯碱和烧碱的熔化6.在下列有关晶体的叙述中错误的是( )
A.离子晶体中,一定存在离子键
B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高
D.稀有气体的原子能形成分子晶体DC
