化学反应的限度
图片预览



文档简介
课件10张PPT。化学反应的限度化学反应和能量变化说明:在相同的条件下, Fe3+与I-能发生反应生成Fe2+和I2, Fe2+和I2
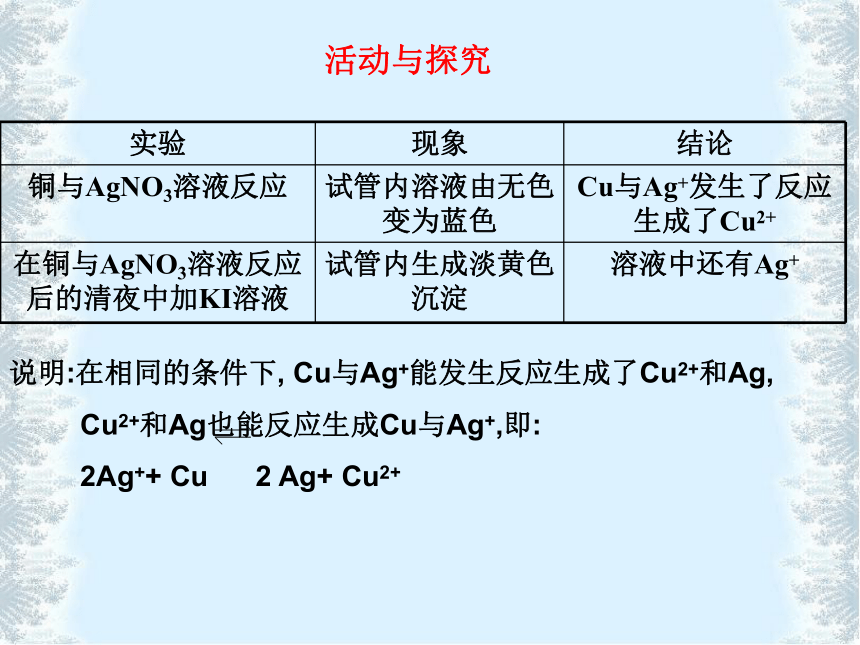
也能反应生成Fe3+与I-,即: 2Fe3++2I- 2 Fe2++I2活动与探究说明:在相同的条件下, Cu与Ag+能发生反应生成了Cu2+和Ag,
Cu2+和Ag也能反应生成Cu与Ag+,即:
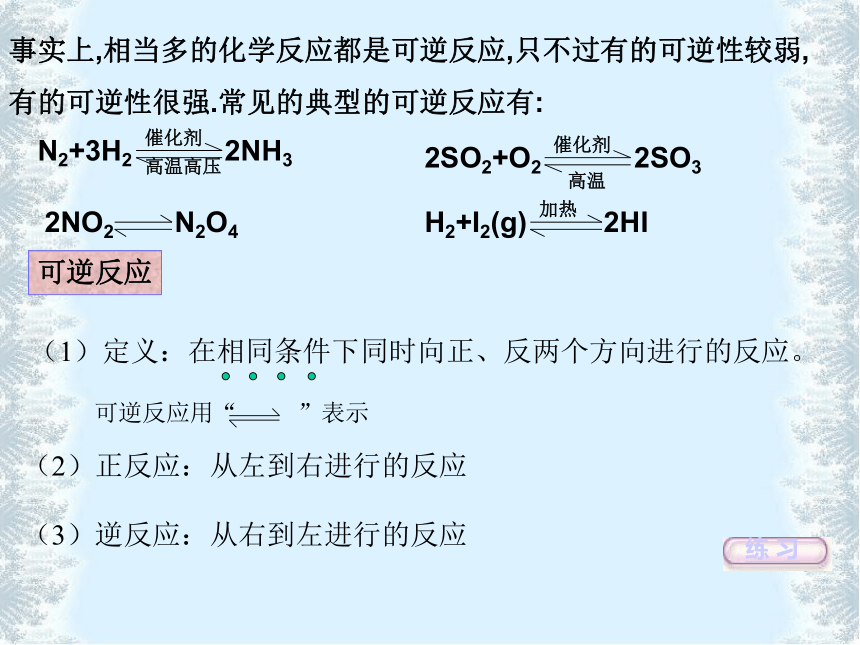
2Ag++ Cu 2 Ag+ Cu2+活动与探究可逆反应(1)定义:在相同条件下同时向正、反两个方向进行的反应。(2)正反应:从左到右进行的反应
(3)逆反应:从右到左进行的反应练 习事实上,相当多的化学反应都是可逆反应,只不过有的可逆性较弱,
有的可逆性很强.常见的典型的可逆反应有:下列对可逆反应的认识正确的是( )
A、SO2+Br2+2H2O=H2SO4+2HBr与
2HBr+H2SO4(浓)=Br2+SO2↑+2H2O互为可逆反应
B、既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应
C、在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应
D、在一定条件下SO2被氧化成SO3的反应是可逆反应判断:二氧化碳与氧化钙反应生成碳酸钙是否为可逆反应?特点:可逆反应不可能完全进行到底CD交流·研讨化学平衡的标志:ν正=ν逆
反应混合物中各组分的浓度保持不变化学平衡(1)概念:化学平衡状态就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化的状态(2)特征:a.逆:可逆反应b.等:V正=V逆c.动: V正=V逆≠0,即是一个动态平衡d.定:平衡混合物中各组分的百分含量一定e.变:条件改变,平衡改变,直到建立新的平衡(3)判断依据 a. V正=V逆
b.反应混合物中各组分的浓度保持不变
<练习>对反应mA(g)+nB(g) pC(g)+qD(g)
判断下面状态是否为平衡状态:
1.各物质的物质的量或物质的量分数一定
2.各物质的质量或质量分数一定
3.各气体的体积或体积分数一定
4.外界条件不变时,A、B的转化率保持不变
5.当某物质的消耗速率与生成速率相等时。
6.当A的消耗速率与C的消耗速率之比为m:p时。
7.反应体系内有色物质的颜色深浅不再改变。A、1个N≡N键断裂的同时,有3个H-H键形成 B、 1个N≡N键断裂的同时,有3个H-H键断裂C、 1个N≡N键断裂的同时,有6个N-H键形成 D、 1个N≡N键断裂的同时,有6个N-H键断裂 例1、下列那种说法可以证明反应:
N2+3H2 2NH3已达到平衡状态 ( )ADA、C生成的速率与分解的速率相等B、A、B、C的浓度不在发生变化C、单位时间内,生成nmolA,同时生成3nmolBD、A、B、C的分子数之比为1:3:2A、B例2、在一定温度下,可逆反应A+3B 2C达到平衡状态的标志是( )例 某温度时,将1molNO2分解:2NO2==2NO+O2,并达到平衡,
此时NO的体积分数为40%,求:
(1)平衡时NO的物质的量;
(2)平衡时NO2、O2的体积分数。终 (1mol-x) x 0.5x解:设平衡时NO的物质的量为x,则: 2NO2 == 2NO + O2始 1mol 0 0变 x x 0.5x1.对于达到平衡状态的可逆反应:N2 +NH3 2NH3 ,下列有关叙述正确的是
A.反应物和生成物浓度不再发生变化
B.反应物和生成物的浓度相等
C.N2和NH3的质量分数相等
D.正反应和逆反应不再进行
2.在2SO2+O2 2SO3的平衡体系中,加入18O2,当平衡发生移动后,SO2中18O的含量 (填增加、减少或不变),其原因是__________________________________________________。
在SO2与18O2反应生成S18O3的同时,S18O3又分解成S18O2 增加A巩固练习
也能反应生成Fe3+与I-,即: 2Fe3++2I- 2 Fe2++I2活动与探究说明:在相同的条件下, Cu与Ag+能发生反应生成了Cu2+和Ag,
Cu2+和Ag也能反应生成Cu与Ag+,即:
2Ag++ Cu 2 Ag+ Cu2+活动与探究可逆反应(1)定义:在相同条件下同时向正、反两个方向进行的反应。(2)正反应:从左到右进行的反应
(3)逆反应:从右到左进行的反应练 习事实上,相当多的化学反应都是可逆反应,只不过有的可逆性较弱,
有的可逆性很强.常见的典型的可逆反应有:下列对可逆反应的认识正确的是( )
A、SO2+Br2+2H2O=H2SO4+2HBr与
2HBr+H2SO4(浓)=Br2+SO2↑+2H2O互为可逆反应
B、既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应
C、在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应
D、在一定条件下SO2被氧化成SO3的反应是可逆反应判断:二氧化碳与氧化钙反应生成碳酸钙是否为可逆反应?特点:可逆反应不可能完全进行到底CD交流·研讨化学平衡的标志:ν正=ν逆
反应混合物中各组分的浓度保持不变化学平衡(1)概念:化学平衡状态就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化的状态(2)特征:a.逆:可逆反应b.等:V正=V逆c.动: V正=V逆≠0,即是一个动态平衡d.定:平衡混合物中各组分的百分含量一定e.变:条件改变,平衡改变,直到建立新的平衡(3)判断依据 a. V正=V逆
b.反应混合物中各组分的浓度保持不变
<练习>对反应mA(g)+nB(g) pC(g)+qD(g)
判断下面状态是否为平衡状态:
1.各物质的物质的量或物质的量分数一定
2.各物质的质量或质量分数一定
3.各气体的体积或体积分数一定
4.外界条件不变时,A、B的转化率保持不变
5.当某物质的消耗速率与生成速率相等时。
6.当A的消耗速率与C的消耗速率之比为m:p时。
7.反应体系内有色物质的颜色深浅不再改变。A、1个N≡N键断裂的同时,有3个H-H键形成 B、 1个N≡N键断裂的同时,有3个H-H键断裂C、 1个N≡N键断裂的同时,有6个N-H键形成 D、 1个N≡N键断裂的同时,有6个N-H键断裂 例1、下列那种说法可以证明反应:
N2+3H2 2NH3已达到平衡状态 ( )ADA、C生成的速率与分解的速率相等B、A、B、C的浓度不在发生变化C、单位时间内,生成nmolA,同时生成3nmolBD、A、B、C的分子数之比为1:3:2A、B例2、在一定温度下,可逆反应A+3B 2C达到平衡状态的标志是( )例 某温度时,将1molNO2分解:2NO2==2NO+O2,并达到平衡,
此时NO的体积分数为40%,求:
(1)平衡时NO的物质的量;
(2)平衡时NO2、O2的体积分数。终 (1mol-x) x 0.5x解:设平衡时NO的物质的量为x,则: 2NO2 == 2NO + O2始 1mol 0 0变 x x 0.5x1.对于达到平衡状态的可逆反应:N2 +NH3 2NH3 ,下列有关叙述正确的是
A.反应物和生成物浓度不再发生变化
B.反应物和生成物的浓度相等
C.N2和NH3的质量分数相等
D.正反应和逆反应不再进行
2.在2SO2+O2 2SO3的平衡体系中,加入18O2,当平衡发生移动后,SO2中18O的含量 (填增加、减少或不变),其原因是__________________________________________________。
在SO2与18O2反应生成S18O3的同时,S18O3又分解成S18O2 增加A巩固练习
