第一节 电 离 平 衡
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第一节 电 离 平 衡
【基础考点梳理】
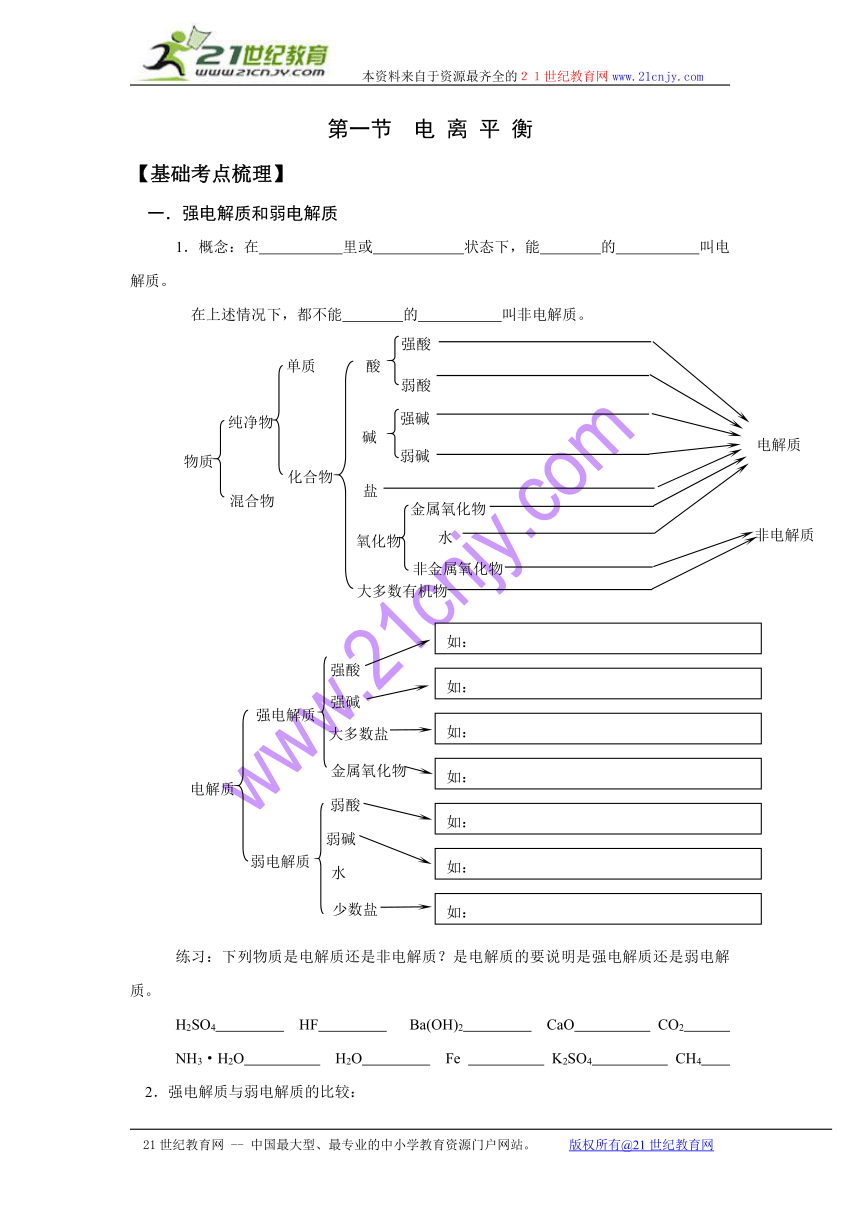
一.强电解质和弱电解质
1.概念:在 里或 状态下,能 的 叫电解质。
在上述情况下,都不能 的 叫非电解质。
练习:下列物质是电解质还是非电解质?是电解质的要说明是强电解质还是弱电解质。
H2SO4 HF Ba(OH)2 CaO CO2
NH3·H2O H2O Fe K2SO4 CH4
2.强电解质与弱电解质的比较:
强电解质 弱电解质
定义 溶于水后 电离的电解质 溶于水后只有 电离的电解质
化合物类型 ⑴离子化合物⑵含强极性键的共价化合物 含弱极性键的共价化合物
电离程度 几乎 电离 只有 电离
电离过程 不可逆,无 可逆,存在
溶液中存在的微粒 只有电离出的 不存在 既有电离出的 又有
电离方程式 KNO3 H2SO4 CH3COOH NH3·H2O
3.电解质电离方程式的书写
⑴强电解质的电离书写时用“=”;弱电解质的电离书写时用“”。
⑵多元弱酸的电离是分步进行的,所以电离方程式也要分步书写;
多元弱碱也是分步电离的,但是书写时一般只用金属阳离子和OH—表示。
⑶酸式盐的电离:强酸的酸式盐完全电离,如:Na2SO4=Na++H++SO42-
弱酸的酸式盐的电离情况如下:NaHCO3=Na++HCO3-;HCO3H++CO32-
二.弱电解质的电离平衡
1.意义:弱电解质的电离平衡是指一定条件下( 、 ),弱电解质分子
和
相等的状态。
2.弱电解质的电离平衡的特点:
⑴“动”即
⑵“等”即 和 相等
⑶“定”即弱电解质的分子和电离出的阴、阳离子的 一定
⑷“变”指外界条件改变时,平衡被打破,电离平衡发生移动。
以0.1mol/L的CH3COOH为例:CH3COOHH++CH3COO-
加水 升温 加NaOH 加H2SO4
平衡移动方向
n(H+)
c(H+)
导电能力
练习填写以下各空:
实例 CH3COOH CH3COO-+ H+△H>0 NH3·H2ONH4+ + OH-△H>0
改变条件 平衡移动方向 电离程度变化 溶液中离子总浓度 导电能力 平衡移动方向 电离程度变化 溶液中离子总浓度 导电能力
加水稀释
通入HCl
通入NH3
加NaOH固体
加入醋酸铵
升高温度
基础考点梳理答案:
一.
1.水溶液 熔融 导电 化合物 。 导电 化合物。
练习:强电解质:H2SO4、Ba(OH)2、CaO、K2SO4
弱电解质:HF、NH3·H2O、H2O
非电解质:CO2、CH4
既不是电解质也不是非电解质:Fe
2.强电解质与弱电解质的比较:
强电解质 弱电解质
定义 溶于水后 完全 电离的电解质 溶于水后只有 部分 电离的电解质
化合物类型 ⑴离子化合物⑵含强极性键的共价化合物 含弱极性键的共价化合物
电离程度 几乎 完全 电离 只有 部分 电离
电离过程 不可逆,无 电离平衡 可逆,存在 电离平衡
溶液中存在的微粒 只有电离出的 离子 不存在 电解质分子 既有电离出的 离子 又有 电解质分子
电离方程式 KNO3 =K++NO3-H2SO4=2H++SO42- CH3COOHCH3COO-+ H+NH3·H2ONH4++OH-
二.1(温度、浓度),电离成离子的速率和离子重新结合成分子的速率
2. ⑴动态平衡
⑵离子化速率 分子化速率
⑶“浓度
加水 升温 加NaOH 加H2SO4
平衡移动方向 右 右 右 左
n(H+) 增大 增大 减小 增大
c(H+) 减小 增大 减小 增大
导电能力 减小 增大 增大 增大
练习填写以下各空:
实例 CH3COOH CH3COO-+ H+△H>0 NH3·H2ONH4+ + OH-△H>0
改变条件 平衡移动方向 电离程度变化 溶液中离子总浓度 导电能力 平衡移动方向 电离程度变化 溶液中离子总浓度 导电能力
加水稀释 右 增大 减小 减小 右 增大 减小 减小
通入HCl 左 减小 增大 增大 右 增大 增大 增大
通入NH3 右 增大 增大 增大 右 减小 增大 增大
加NaOH固体 右 增大 增大 增大 左 减小 增大 增大
加入醋酸铵 左 减小 增大 增大 左 减小 增大 增大
升高温度 右 增大 增大 增大 右 增大 增大 增大
【解题方法规律技巧大放送】
一、强弱电解质的判断依据
1.在相同浓度.相同温度下,与强电解质做导电性对比实验。
2.在相同浓度.相同温度下,比较反应速率的快慢。如:将锌粒投入到等浓度的盐酸和醋酸溶液中,结果前者比后者快。
3.浓度与pH的关系。如:0.1mol·L-1CH3COOH,其pH﹥1,则证明CH3COOH是弱电解质。
4.测定对应盐的酸碱性。如CH3COONa溶液呈碱性,则证明醋酸是弱酸。
5.稀释前后的pH与稀释倍数的变化关系。例如,将pH=2的酸溶液稀释1000倍,若pH﹤5,则证明为弱酸;若pH=5,则证明为强酸。
6.采用实验证明电离平衡。如醋酸溶液中滴入石蕊变红,加入醋酸钠晶体,颜色变浅。
7.利用强酸(或碱)制备较弱的酸(或碱)判断电解质的强弱。如将醋酸加入到石灰石中有二氧化碳产生,则说明酸性:CH3COOH﹥H2CO3
8.利用元素周期律进行判断,如非金属性:Cl﹥S﹥P﹥Si,则酸性:HClO4﹥H2SO4﹥H3PO4﹥H2SiO3;金属性:Na﹥Mg﹥Al,则碱性:NaOH﹥Mg(OH)2﹥Al(OH)3
【例1】下列叙述中正确的是( )
A.氯化钠溶液在电流作用下电离成钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.硫酸钡难溶于水,但硫酸钡属于强电解质
D.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
答案:C
解析:氯化钠溶于水发生电离,而不是在电流作用下电离,A错;NaHSO4溶于水电离出H+,但是盐,B错;CO2溶于水与水反应生成的H2CO3电离而导电,不是CO2本身电离,故CO2属于非电解质,D错。
二、影响电离平衡的因素
1.温度:温度越高,电离平衡向右移动;
2.浓度:加水稀释,电离平衡向右移动;
3.同离子效应:增加阴、阳离子的浓度,平衡向左移动;减小阴、阳离子的浓度,平衡向右移动。
【例2】欲使0.1 mol·L-1的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
答案:D
解析:NaHCO3溶液中存在:HCO3—H++CO32—,所以通CO2和HCl, c(H+)增大;加入NaOH固体平衡正向移动c(CO32-)增大;加饱和石灰水溶液,Ca2+结合CO32—使得平衡正向移动,结果c(CO32-)、c(HCO3-)都减少,又因加的为碱c(H+)必然减小。
物质
纯净物
混合物
单质
化合物
酸
碱
盐
氧化物
大多数有机物
强酸
弱酸
强碱
弱碱
金属氧化物
水
非金属氧化物
电解质
非电解质
电解质
强酸
弱酸
强碱
弱碱
金属氧化物
水
强电解质
弱电解质
大多数盐
少数盐
如:
如:
如:
如:
如:
如:
如:
电解质
强酸
弱酸
强碱
弱碱
金属氧化物
水
强电解质
弱电解质
大多数盐
少数盐
如:H2SO4、HCl、HNO3、HBr、HI、HClO4
如:KOH、NaOH、Ba(OH)2、Ca(OH)2
如:NaCl、BaSO4
如:Na2O、CaO、Na2O2
如:HClO、H2SO3、H2CO3、HF、CH3COOH
如:NH3·H2O、Al(OH)3、Cu(OH)2
如:(CH3COO)2Pb
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第一节 电 离 平 衡
【基础考点梳理】
一.强电解质和弱电解质
1.概念:在 里或 状态下,能 的 叫电解质。
在上述情况下,都不能 的 叫非电解质。
练习:下列物质是电解质还是非电解质?是电解质的要说明是强电解质还是弱电解质。
H2SO4 HF Ba(OH)2 CaO CO2
NH3·H2O H2O Fe K2SO4 CH4
2.强电解质与弱电解质的比较:
强电解质 弱电解质
定义 溶于水后 电离的电解质 溶于水后只有 电离的电解质
化合物类型 ⑴离子化合物⑵含强极性键的共价化合物 含弱极性键的共价化合物
电离程度 几乎 电离 只有 电离
电离过程 不可逆,无 可逆,存在
溶液中存在的微粒 只有电离出的 不存在 既有电离出的 又有
电离方程式 KNO3 H2SO4 CH3COOH NH3·H2O
3.电解质电离方程式的书写
⑴强电解质的电离书写时用“=”;弱电解质的电离书写时用“”。
⑵多元弱酸的电离是分步进行的,所以电离方程式也要分步书写;
多元弱碱也是分步电离的,但是书写时一般只用金属阳离子和OH—表示。
⑶酸式盐的电离:强酸的酸式盐完全电离,如:Na2SO4=Na++H++SO42-
弱酸的酸式盐的电离情况如下:NaHCO3=Na++HCO3-;HCO3H++CO32-
二.弱电解质的电离平衡
1.意义:弱电解质的电离平衡是指一定条件下( 、 ),弱电解质分子
和
相等的状态。
2.弱电解质的电离平衡的特点:
⑴“动”即
⑵“等”即 和 相等
⑶“定”即弱电解质的分子和电离出的阴、阳离子的 一定
⑷“变”指外界条件改变时,平衡被打破,电离平衡发生移动。
以0.1mol/L的CH3COOH为例:CH3COOHH++CH3COO-
加水 升温 加NaOH 加H2SO4
平衡移动方向
n(H+)
c(H+)
导电能力
练习填写以下各空:
实例 CH3COOH CH3COO-+ H+△H>0 NH3·H2ONH4+ + OH-△H>0
改变条件 平衡移动方向 电离程度变化 溶液中离子总浓度 导电能力 平衡移动方向 电离程度变化 溶液中离子总浓度 导电能力
加水稀释
通入HCl
通入NH3
加NaOH固体
加入醋酸铵
升高温度
基础考点梳理答案:
一.
1.水溶液 熔融 导电 化合物 。 导电 化合物。
练习:强电解质:H2SO4、Ba(OH)2、CaO、K2SO4
弱电解质:HF、NH3·H2O、H2O
非电解质:CO2、CH4
既不是电解质也不是非电解质:Fe
2.强电解质与弱电解质的比较:
强电解质 弱电解质
定义 溶于水后 完全 电离的电解质 溶于水后只有 部分 电离的电解质
化合物类型 ⑴离子化合物⑵含强极性键的共价化合物 含弱极性键的共价化合物
电离程度 几乎 完全 电离 只有 部分 电离
电离过程 不可逆,无 电离平衡 可逆,存在 电离平衡
溶液中存在的微粒 只有电离出的 离子 不存在 电解质分子 既有电离出的 离子 又有 电解质分子
电离方程式 KNO3 =K++NO3-H2SO4=2H++SO42- CH3COOHCH3COO-+ H+NH3·H2ONH4++OH-
二.1(温度、浓度),电离成离子的速率和离子重新结合成分子的速率
2. ⑴动态平衡
⑵离子化速率 分子化速率
⑶“浓度
加水 升温 加NaOH 加H2SO4
平衡移动方向 右 右 右 左
n(H+) 增大 增大 减小 增大
c(H+) 减小 增大 减小 增大
导电能力 减小 增大 增大 增大
练习填写以下各空:
实例 CH3COOH CH3COO-+ H+△H>0 NH3·H2ONH4+ + OH-△H>0
改变条件 平衡移动方向 电离程度变化 溶液中离子总浓度 导电能力 平衡移动方向 电离程度变化 溶液中离子总浓度 导电能力
加水稀释 右 增大 减小 减小 右 增大 减小 减小
通入HCl 左 减小 增大 增大 右 增大 增大 增大
通入NH3 右 增大 增大 增大 右 减小 增大 增大
加NaOH固体 右 增大 增大 增大 左 减小 增大 增大
加入醋酸铵 左 减小 增大 增大 左 减小 增大 增大
升高温度 右 增大 增大 增大 右 增大 增大 增大
【解题方法规律技巧大放送】
一、强弱电解质的判断依据
1.在相同浓度.相同温度下,与强电解质做导电性对比实验。
2.在相同浓度.相同温度下,比较反应速率的快慢。如:将锌粒投入到等浓度的盐酸和醋酸溶液中,结果前者比后者快。
3.浓度与pH的关系。如:0.1mol·L-1CH3COOH,其pH﹥1,则证明CH3COOH是弱电解质。
4.测定对应盐的酸碱性。如CH3COONa溶液呈碱性,则证明醋酸是弱酸。
5.稀释前后的pH与稀释倍数的变化关系。例如,将pH=2的酸溶液稀释1000倍,若pH﹤5,则证明为弱酸;若pH=5,则证明为强酸。
6.采用实验证明电离平衡。如醋酸溶液中滴入石蕊变红,加入醋酸钠晶体,颜色变浅。
7.利用强酸(或碱)制备较弱的酸(或碱)判断电解质的强弱。如将醋酸加入到石灰石中有二氧化碳产生,则说明酸性:CH3COOH﹥H2CO3
8.利用元素周期律进行判断,如非金属性:Cl﹥S﹥P﹥Si,则酸性:HClO4﹥H2SO4﹥H3PO4﹥H2SiO3;金属性:Na﹥Mg﹥Al,则碱性:NaOH﹥Mg(OH)2﹥Al(OH)3
【例1】下列叙述中正确的是( )
A.氯化钠溶液在电流作用下电离成钠离子和氯离子
B.溶于水后能电离出氢离子的化合物都是酸
C.硫酸钡难溶于水,但硫酸钡属于强电解质
D.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
答案:C
解析:氯化钠溶于水发生电离,而不是在电流作用下电离,A错;NaHSO4溶于水电离出H+,但是盐,B错;CO2溶于水与水反应生成的H2CO3电离而导电,不是CO2本身电离,故CO2属于非电解质,D错。
二、影响电离平衡的因素
1.温度:温度越高,电离平衡向右移动;
2.浓度:加水稀释,电离平衡向右移动;
3.同离子效应:增加阴、阳离子的浓度,平衡向左移动;减小阴、阳离子的浓度,平衡向右移动。
【例2】欲使0.1 mol·L-1的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
答案:D
解析:NaHCO3溶液中存在:HCO3—H++CO32—,所以通CO2和HCl, c(H+)增大;加入NaOH固体平衡正向移动c(CO32-)增大;加饱和石灰水溶液,Ca2+结合CO32—使得平衡正向移动,结果c(CO32-)、c(HCO3-)都减少,又因加的为碱c(H+)必然减小。
物质
纯净物
混合物
单质
化合物
酸
碱
盐
氧化物
大多数有机物
强酸
弱酸
强碱
弱碱
金属氧化物
水
非金属氧化物
电解质
非电解质
电解质
强酸
弱酸
强碱
弱碱
金属氧化物
水
强电解质
弱电解质
大多数盐
少数盐
如:
如:
如:
如:
如:
如:
如:
电解质
强酸
弱酸
强碱
弱碱
金属氧化物
水
强电解质
弱电解质
大多数盐
少数盐
如:H2SO4、HCl、HNO3、HBr、HI、HClO4
如:KOH、NaOH、Ba(OH)2、Ca(OH)2
如:NaCl、BaSO4
如:Na2O、CaO、Na2O2
如:HClO、H2SO3、H2CO3、HF、CH3COOH
如:NH3·H2O、Al(OH)3、Cu(OH)2
如:(CH3COO)2Pb
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
