电解池台州市优质课
图片预览




文档简介
课件12张PPT。电解池的工作原理及应用仙居中学 周文芬实验探究 取一张用混有酚酞的饱和NaCl溶液浸湿的滤纸,分别以石墨和铁钉作电极,接通直流电源,用铁钉慢速在滤纸上写字,观察实验现象。现象: 铁钉写出来的字为红字神笔马良知识回顾---电解池的工作原理一、电解池的工作原理2.构成条件(1)两个电极(活性或惰性)
(2)电解质溶液或熔融电解质
(3)直流电源
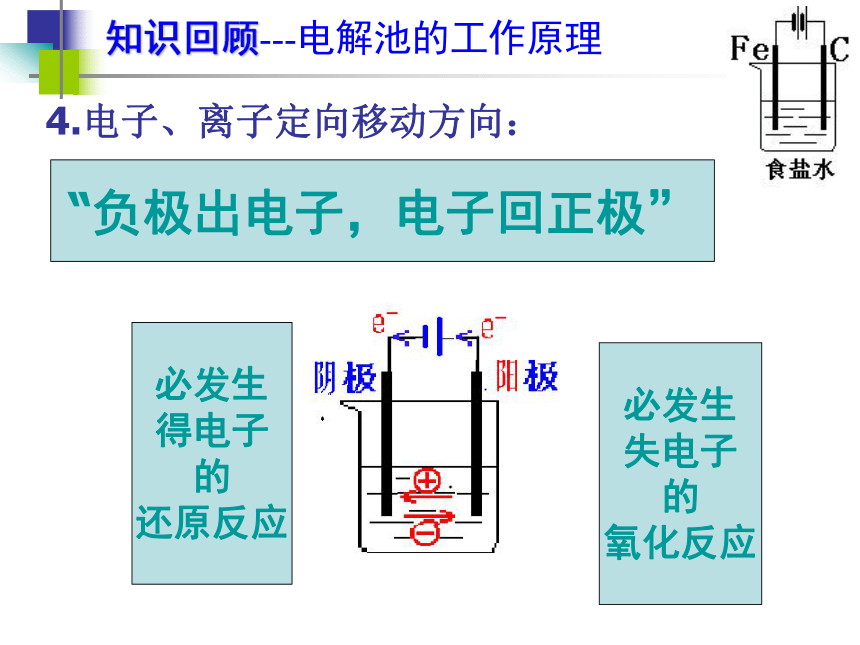
(4)形成闭合回路3.电极名称: 将电能转化为化学能的装置。1.定义:知识回顾---电解池的工作原理4.电子、离子定向移动方向:“负极出电子,电子回正极”必发生
得电子
的
还原反应必发生
失电子
的
氧化反应交流讨论---电解池的工作原理 在电解饱和食盐水中,两极产生的气体分别为氢气和氯气,而NaCl溶液中有自由移动的Na+、Cl-、H+、OH-,为什么是H+ 、Cl-得失电子?知识回顾---电解池的工作原理5、两极上放电顺序(1)阳极上(氧化反应) (2)阴极上(还原反应)
活泼金属>S2->I->Br->Cl->OH->含氧酸根Ag+ > Fe3+ > Cu2+ > H+ > Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ > Al3+ > Mg2+ > Na+ > Ca2+ > K+ 请写出上述电解池的电极反应式及电池反应方程式。交流讨论---电解池的工作原理如:
通电一段时间后,溶液的pH如何变化?
如何使该电解质溶液复原?
反应原理小 结离子的放电顺序(惰性电极)阳离子得电子的顺序:按金属活动性顺序,越不活泼的金属离子越容易得到电子。必记:Ag+ > Cu2+ > H+ 必记: ① Cl- > OH-
② 4OH- - 4e- = 2H2O + O2↑Ag+ > Fe3+ > Cu2+ > H+ > Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ > Al3+ > Mg2+ > Na+ > Ca2+ > K+ 若将上述电解池中的电解液换成CuSO4溶液,请写出电极反应式及电池反应方程式。交流讨论---电解池的工作原理CuSO4
溶液变式练习2:
通电一段时间后,溶液的pH如何变化?交流讨论---电解池的工作原理变式练习3:
如何使该电解质溶液复原?CuSO4
溶液(1)第一阶段:只有一个电极上有大量气体生成。产生大量气体的电极是______ (填Fe或C ),写出其电极反应式: 某实验小组同学在右图所示的装置中加入CuCl2使二者的物质的量浓度相等,试分析可能观察到的实验现象。2Cl-+2e-=Cl2 ↑2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-)碳棒上产生的气体由黄绿色变成无色。C(2)第二阶段:继续通电,另一个电极上出现了大量无色无味气体,标志着新的反应阶段开始。产生无色无味气体的电极反应式为(3)第三阶段:通电一段时间后,实验现象又发生明显改变,标志第三阶段开始。标志第三阶段开始的现象是:交流讨论---电解池的工作原理交流讨论---电解池的工作原理工业上氯碱工业当电极与电源正负极反向连接时此电解池就可成为工业上运用的铜的电解精炼及电镀等
(2)电解质溶液或熔融电解质
(3)直流电源
(4)形成闭合回路3.电极名称: 将电能转化为化学能的装置。1.定义:知识回顾---电解池的工作原理4.电子、离子定向移动方向:“负极出电子,电子回正极”必发生
得电子
的
还原反应必发生
失电子
的
氧化反应交流讨论---电解池的工作原理 在电解饱和食盐水中,两极产生的气体分别为氢气和氯气,而NaCl溶液中有自由移动的Na+、Cl-、H+、OH-,为什么是H+ 、Cl-得失电子?知识回顾---电解池的工作原理5、两极上放电顺序(1)阳极上(氧化反应) (2)阴极上(还原反应)
活泼金属>S2->I->Br->Cl->OH->含氧酸根Ag+ > Fe3+ > Cu2+ > H+ > Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ > Al3+ > Mg2+ > Na+ > Ca2+ > K+ 请写出上述电解池的电极反应式及电池反应方程式。交流讨论---电解池的工作原理如:
通电一段时间后,溶液的pH如何变化?
如何使该电解质溶液复原?
反应原理小 结离子的放电顺序(惰性电极)阳离子得电子的顺序:按金属活动性顺序,越不活泼的金属离子越容易得到电子。必记:Ag+ > Cu2+ > H+ 必记: ① Cl- > OH-
② 4OH- - 4e- = 2H2O + O2↑Ag+ > Fe3+ > Cu2+ > H+ > Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ > Al3+ > Mg2+ > Na+ > Ca2+ > K+ 若将上述电解池中的电解液换成CuSO4溶液,请写出电极反应式及电池反应方程式。交流讨论---电解池的工作原理CuSO4
溶液变式练习2:
通电一段时间后,溶液的pH如何变化?交流讨论---电解池的工作原理变式练习3:
如何使该电解质溶液复原?CuSO4
溶液(1)第一阶段:只有一个电极上有大量气体生成。产生大量气体的电极是______ (填Fe或C ),写出其电极反应式: 某实验小组同学在右图所示的装置中加入CuCl2使二者的物质的量浓度相等,试分析可能观察到的实验现象。2Cl-+2e-=Cl2 ↑2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-)碳棒上产生的气体由黄绿色变成无色。C(2)第二阶段:继续通电,另一个电极上出现了大量无色无味气体,标志着新的反应阶段开始。产生无色无味气体的电极反应式为(3)第三阶段:通电一段时间后,实验现象又发生明显改变,标志第三阶段开始。标志第三阶段开始的现象是:交流讨论---电解池的工作原理交流讨论---电解池的工作原理工业上氯碱工业当电极与电源正负极反向连接时此电解池就可成为工业上运用的铜的电解精炼及电镀等
