复件 2011碳族元素
图片预览



文档简介
(共12张PPT)
1.物理性质及用途
碳 硅
形态 游离态、化合态 化合态
物性 金刚石:熔点高,硬度大
石墨:熔点高,硬度小 灰黑色固体,有金属光泽,硬而脆
形态 游离态、化合态 化合态
用途 金刚石用作切割刀具,
石墨用作电极、铅笔芯 半导体材料和合金材料
碳、硅
一
2.化学性质
碳、硅在参加的化学反应中,一般表现还原性.
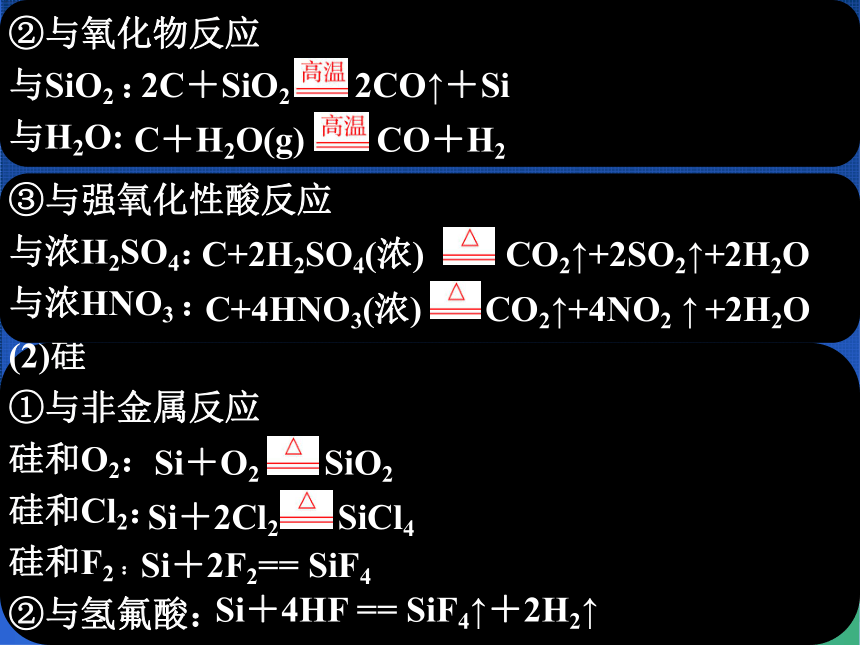
(1)碳①与O2反应
氧足量: 氧不足:
C+O2 CO2
2C+O2 2CO
Si+2Cl2 SiCl4
Si+O2 SiO2
(2)硅
①与非金属反应
硅和O2:
硅和Cl2:
硅和F2 :
②与氢氟酸:
Si+2F2== SiF4
Si+4HF == SiF4↑+2H2↑
③与强氧化性酸反应
与浓H2SO4:
与浓HNO3 :
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
C+4HNO3(浓) CO2↑+4NO2 ↑ +2H2O
②与氧化物反应
与SiO2 :
与H2O:
2C+SiO2 2CO↑+Si
C+H2O(g) CO+H2
3.碳、硅元素单质的特性
(1) 碳还原出比它更强的硅:
SiO2+2C Si+2CO↑
(2)硅为非金属,却可以和强碱反应,放出氢气:
Si+2NaOH+H2O === Na2SiO3+2H2 ↑.
(3)一般情况下,较活泼金属+酸→盐+氢气,然而Si
是非金属,却能与氢氟酸发生反应:
Si+4HF == SiF4 ↑+2H2 ↑.
[例1]下列关于硅的说法中,不正确的是
A.硅是非金属元素,晶体硅是灰黑色有金属光泽的固体
B.硅的导电性能介于导体和绝缘体之间,是良好的半导体
C.硅的化学性质不活泼,常温下不与任何物质反应
D.加热到一定温度时,硅能与氯气、氧气等非金属反应
1.一氧化碳
CO是无色无味的有毒气体,不溶于水,可用作气体燃料和冶金工业的还原剂.
(1)燃烧:
(2)还原CuO:
2CO+O2 2CO2
CO+CuO Cu+CO2
碳、硅的氧化物
二
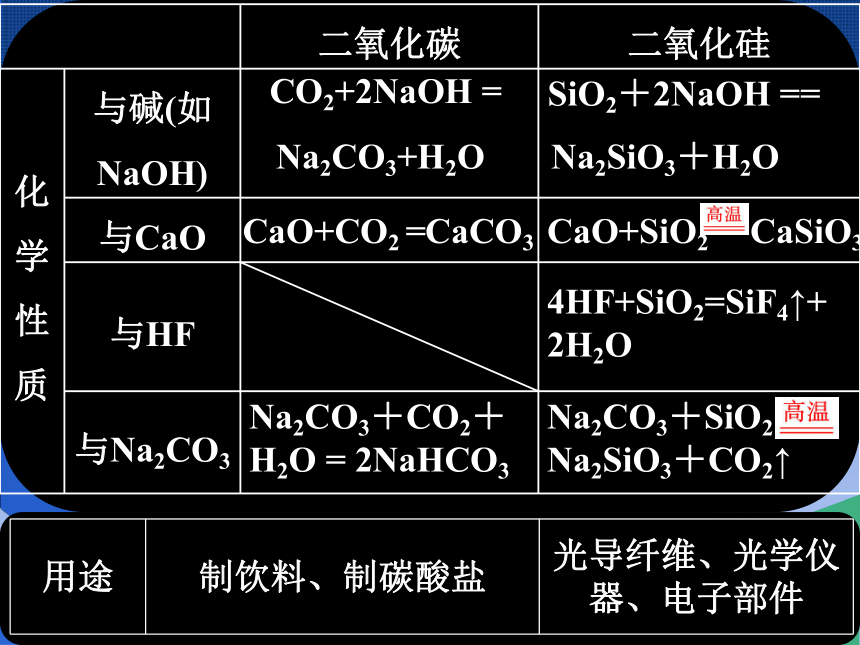
二氧化碳 二氧化硅
类别 均为酸性氧化物
结构 由二氧化碳分子构成 由氧原子与硅原子构成
立体网状结构
物性 熔点和沸点低、可溶于水 坚硬难熔的固体,不溶于水
2.二氧化碳和二氧化硅
二氧化碳 二氧化硅
化
学
性
质 与碱(如
NaOH)
与CaO
与HF
与Na2CO3
用途 制饮料、制碳酸盐 光导纤维、光学仪器、电子部件
Na2CO3+H2O
Na2SiO3+H2O
CaSiO3
CaCO3
4HF+SiO2=SiF4↑+2H2O
Na2CO3+CO2+H2O = 2NaHCO3
Na2CO3+SiO2
Na2SiO3+CO2↑
CO2+2NaOH =
SiO2+2NaOH ==
CaO+CO2 =
CaO+SiO2
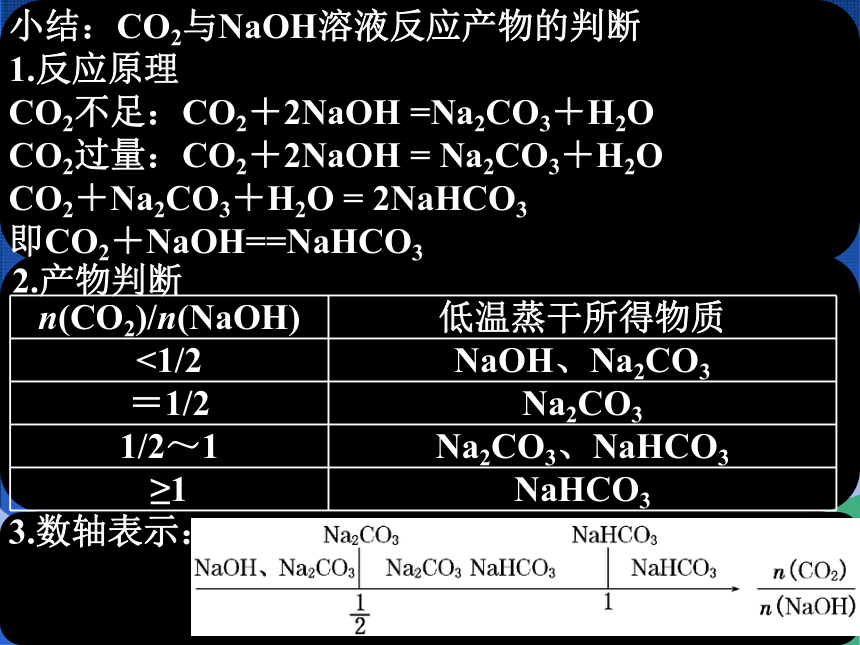
小结:CO2与NaOH溶液反应产物的判断
1.反应原理
CO2不足:CO2+2NaOH =Na2CO3+H2O
CO2过量:CO2+2NaOH = Na2CO3+H2O
CO2+Na2CO3+H2O = 2NaHCO3
即CO2+NaOH==NaHCO3
2.产物判断
n(CO2)/n(NaOH) 低温蒸干所得物质
<1/2 NaOH、Na2CO3
=1/2 Na2CO3
1/2~1 Na2CO3、NaHCO3
≥1 NaHCO3
3.数轴表示:
[例3]用1 L 1.0 mol/L NaOH溶液吸收0.8 mol CO2,所得溶液中CO32-与HCO3-的物质的量浓度之比约是
A.1∶3 B.1∶2 C.2∶3 D.3∶2
H2SiO3 H2O+SiO2
硅酸,硅酸盐, 碳酸盐
三
1.硅酸
(1)物理性质:白色固体,不溶于水.
(2)化学性质
①弱酸性
硅酸是一种很弱的酸,酸性比碳酸弱。与NaOH溶液反应的化学方程式为:
②不稳定性(受热易分解)
2NaOH+H2SiO3=Na2SiO3+2H2O
(3)制备及用途
可溶性硅酸盐溶液与其他酸溶液反应可制得硅酸.
Na2SiO3+2HCl=2NaCl+H2SiO3↓
Na2SiO3+CO2+H2O= Na2CO3+H2SiO3↓
硅胶可用作干燥剂、催化剂的载体.
2.硅酸盐
(1)硅酸盐
硅酸盐是由 硅 、氧 和 金属 组成的化合物的总称。硅酸盐是一类结构复杂的物质,一般都不溶于水 。化学性质很 稳定 ,通常用二氧化硅 和金属氧化物 的形式表示其组成。
(2)硅酸钠
硅酸钠可溶于水,其水溶液俗称水玻璃,是无色黏稠液体,常用于制备硅胶和木材防火剂防腐剂玻璃胶等.
3.无机非金属材料
(1)硅酸盐材料
水泥 玻璃 陶瓷
原料 石灰石、黏土
纯碱、石灰
石、石英 黏土
设备 水泥回转窑 玻璃窑 陶瓷窑
(2)特殊功能的含硅物质
①碳化硅具有金刚石结构,可用作磨料.
②含硅元素4%的硅钢具有导磁性.
③硅橡胶具有良好的弹性的性质.
④分子筛(具有均匀微孔结构的铝硅酸盐)主要用作吸附剂和催化剂.
小结:硅酸盐组成的表示方法1.表示形式
硅酸盐种类繁多,结构复杂,通常用二氧化硅和金属氧化物的组合形式来表示其组成,如:硅酸钠
(Na2SiO3):Na2O·SiO2
2.书写方法 (1)根据组成元素写成氧化物的形式;
(2)根据原子守恒及原子个数比例配置系数;
(3)按活泼金属氧化物→较活泼金属氧化物→二氧化硅→水的顺序书写.
注意:氧化物之间以“·”隔开,系数出现分数的要
化为整数.如:正长石(KAlSi3O8):K2O·Al2O3·6SiO2.
小结:常见含硅材料的应用
(1)硅单质:硅太阳能电池,计算机芯片,半导体晶体管.
(2)二氧化硅:石英钟表,水晶镜片,玛瑙饰物,光导纤维.
(3)硅酸盐材料:水泥、玻璃、陶瓷等.
4.碳酸和碳酸盐
(1)碳酸是一种二元弱酸,酸性较弱,但能使紫色石蕊试液变红,具备酸的通性。
(2)碳酸盐
酸式盐:NaHCO3 Ca(HCO3)2 正盐: Na2CO3 CaCO3
(3)碳酸的酸式盐与正盐的比较
①在水中的溶液性
a.含K+、Na+、NH4+的正盐易溶于水,其余正盐难溶于水,酸式盐均易溶于水.
b.难溶性碳酸盐溶解性小于碳酸氢盐;可溶性碳酸盐溶解性大于碳酸氢盐.
②热稳定性
a.一般地,热稳定性顺序为:正盐>酸式盐>碳酸
b.可溶性正盐>难溶性正盐
②HCO3-:向待检溶液中加入CaCl2 或 BaCl2溶液反应,若无明显现象,再加入酸(硝酸或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。则待检溶液中含有HCO3-
① CO32-:向待检溶液中加入CaCl2 或 BaCl2溶液反应,生成白色的CaCO3或BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。则待检溶液中含有CO32-
(5) CO32-、HCO3-的检验
1.物理性质及用途
碳 硅
形态 游离态、化合态 化合态
物性 金刚石:熔点高,硬度大
石墨:熔点高,硬度小 灰黑色固体,有金属光泽,硬而脆
形态 游离态、化合态 化合态
用途 金刚石用作切割刀具,
石墨用作电极、铅笔芯 半导体材料和合金材料
碳、硅
一
2.化学性质
碳、硅在参加的化学反应中,一般表现还原性.
(1)碳①与O2反应
氧足量: 氧不足:
C+O2 CO2
2C+O2 2CO
Si+2Cl2 SiCl4
Si+O2 SiO2
(2)硅
①与非金属反应
硅和O2:
硅和Cl2:
硅和F2 :
②与氢氟酸:
Si+2F2== SiF4
Si+4HF == SiF4↑+2H2↑
③与强氧化性酸反应
与浓H2SO4:
与浓HNO3 :
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
C+4HNO3(浓) CO2↑+4NO2 ↑ +2H2O
②与氧化物反应
与SiO2 :
与H2O:
2C+SiO2 2CO↑+Si
C+H2O(g) CO+H2
3.碳、硅元素单质的特性
(1) 碳还原出比它更强的硅:
SiO2+2C Si+2CO↑
(2)硅为非金属,却可以和强碱反应,放出氢气:
Si+2NaOH+H2O === Na2SiO3+2H2 ↑.
(3)一般情况下,较活泼金属+酸→盐+氢气,然而Si
是非金属,却能与氢氟酸发生反应:
Si+4HF == SiF4 ↑+2H2 ↑.
[例1]下列关于硅的说法中,不正确的是
A.硅是非金属元素,晶体硅是灰黑色有金属光泽的固体
B.硅的导电性能介于导体和绝缘体之间,是良好的半导体
C.硅的化学性质不活泼,常温下不与任何物质反应
D.加热到一定温度时,硅能与氯气、氧气等非金属反应
1.一氧化碳
CO是无色无味的有毒气体,不溶于水,可用作气体燃料和冶金工业的还原剂.
(1)燃烧:
(2)还原CuO:
2CO+O2 2CO2
CO+CuO Cu+CO2
碳、硅的氧化物
二
二氧化碳 二氧化硅
类别 均为酸性氧化物
结构 由二氧化碳分子构成 由氧原子与硅原子构成
立体网状结构
物性 熔点和沸点低、可溶于水 坚硬难熔的固体,不溶于水
2.二氧化碳和二氧化硅
二氧化碳 二氧化硅
化
学
性
质 与碱(如
NaOH)
与CaO
与HF
与Na2CO3
用途 制饮料、制碳酸盐 光导纤维、光学仪器、电子部件
Na2CO3+H2O
Na2SiO3+H2O
CaSiO3
CaCO3
4HF+SiO2=SiF4↑+2H2O
Na2CO3+CO2+H2O = 2NaHCO3
Na2CO3+SiO2
Na2SiO3+CO2↑
CO2+2NaOH =
SiO2+2NaOH ==
CaO+CO2 =
CaO+SiO2
小结:CO2与NaOH溶液反应产物的判断
1.反应原理
CO2不足:CO2+2NaOH =Na2CO3+H2O
CO2过量:CO2+2NaOH = Na2CO3+H2O
CO2+Na2CO3+H2O = 2NaHCO3
即CO2+NaOH==NaHCO3
2.产物判断
n(CO2)/n(NaOH) 低温蒸干所得物质
<1/2 NaOH、Na2CO3
=1/2 Na2CO3
1/2~1 Na2CO3、NaHCO3
≥1 NaHCO3
3.数轴表示:
[例3]用1 L 1.0 mol/L NaOH溶液吸收0.8 mol CO2,所得溶液中CO32-与HCO3-的物质的量浓度之比约是
A.1∶3 B.1∶2 C.2∶3 D.3∶2
H2SiO3 H2O+SiO2
硅酸,硅酸盐, 碳酸盐
三
1.硅酸
(1)物理性质:白色固体,不溶于水.
(2)化学性质
①弱酸性
硅酸是一种很弱的酸,酸性比碳酸弱。与NaOH溶液反应的化学方程式为:
②不稳定性(受热易分解)
2NaOH+H2SiO3=Na2SiO3+2H2O
(3)制备及用途
可溶性硅酸盐溶液与其他酸溶液反应可制得硅酸.
Na2SiO3+2HCl=2NaCl+H2SiO3↓
Na2SiO3+CO2+H2O= Na2CO3+H2SiO3↓
硅胶可用作干燥剂、催化剂的载体.
2.硅酸盐
(1)硅酸盐
硅酸盐是由 硅 、氧 和 金属 组成的化合物的总称。硅酸盐是一类结构复杂的物质,一般都不溶于水 。化学性质很 稳定 ,通常用二氧化硅 和金属氧化物 的形式表示其组成。
(2)硅酸钠
硅酸钠可溶于水,其水溶液俗称水玻璃,是无色黏稠液体,常用于制备硅胶和木材防火剂防腐剂玻璃胶等.
3.无机非金属材料
(1)硅酸盐材料
水泥 玻璃 陶瓷
原料 石灰石、黏土
纯碱、石灰
石、石英 黏土
设备 水泥回转窑 玻璃窑 陶瓷窑
(2)特殊功能的含硅物质
①碳化硅具有金刚石结构,可用作磨料.
②含硅元素4%的硅钢具有导磁性.
③硅橡胶具有良好的弹性的性质.
④分子筛(具有均匀微孔结构的铝硅酸盐)主要用作吸附剂和催化剂.
小结:硅酸盐组成的表示方法1.表示形式
硅酸盐种类繁多,结构复杂,通常用二氧化硅和金属氧化物的组合形式来表示其组成,如:硅酸钠
(Na2SiO3):Na2O·SiO2
2.书写方法 (1)根据组成元素写成氧化物的形式;
(2)根据原子守恒及原子个数比例配置系数;
(3)按活泼金属氧化物→较活泼金属氧化物→二氧化硅→水的顺序书写.
注意:氧化物之间以“·”隔开,系数出现分数的要
化为整数.如:正长石(KAlSi3O8):K2O·Al2O3·6SiO2.
小结:常见含硅材料的应用
(1)硅单质:硅太阳能电池,计算机芯片,半导体晶体管.
(2)二氧化硅:石英钟表,水晶镜片,玛瑙饰物,光导纤维.
(3)硅酸盐材料:水泥、玻璃、陶瓷等.
4.碳酸和碳酸盐
(1)碳酸是一种二元弱酸,酸性较弱,但能使紫色石蕊试液变红,具备酸的通性。
(2)碳酸盐
酸式盐:NaHCO3 Ca(HCO3)2 正盐: Na2CO3 CaCO3
(3)碳酸的酸式盐与正盐的比较
①在水中的溶液性
a.含K+、Na+、NH4+的正盐易溶于水,其余正盐难溶于水,酸式盐均易溶于水.
b.难溶性碳酸盐溶解性小于碳酸氢盐;可溶性碳酸盐溶解性大于碳酸氢盐.
②热稳定性
a.一般地,热稳定性顺序为:正盐>酸式盐>碳酸
b.可溶性正盐>难溶性正盐
②HCO3-:向待检溶液中加入CaCl2 或 BaCl2溶液反应,若无明显现象,再加入酸(硝酸或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。则待检溶液中含有HCO3-
① CO32-:向待检溶液中加入CaCl2 或 BaCl2溶液反应,生成白色的CaCO3或BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。则待检溶液中含有CO32-
(5) CO32-、HCO3-的检验
同课章节目录
