乙 炔
图片预览




文档简介
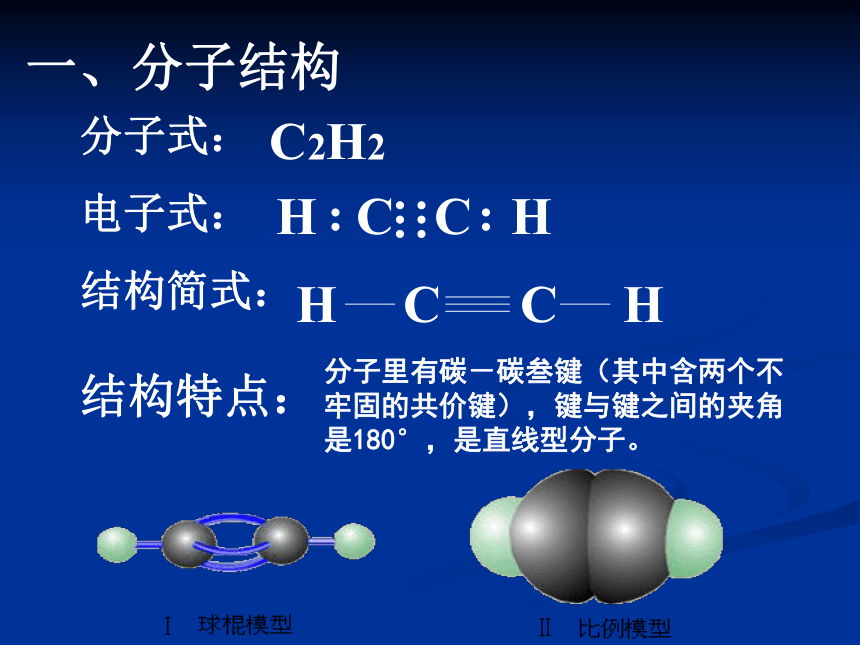
课件23张PPT。乙 炔一、分子结构分子式:
电子式:
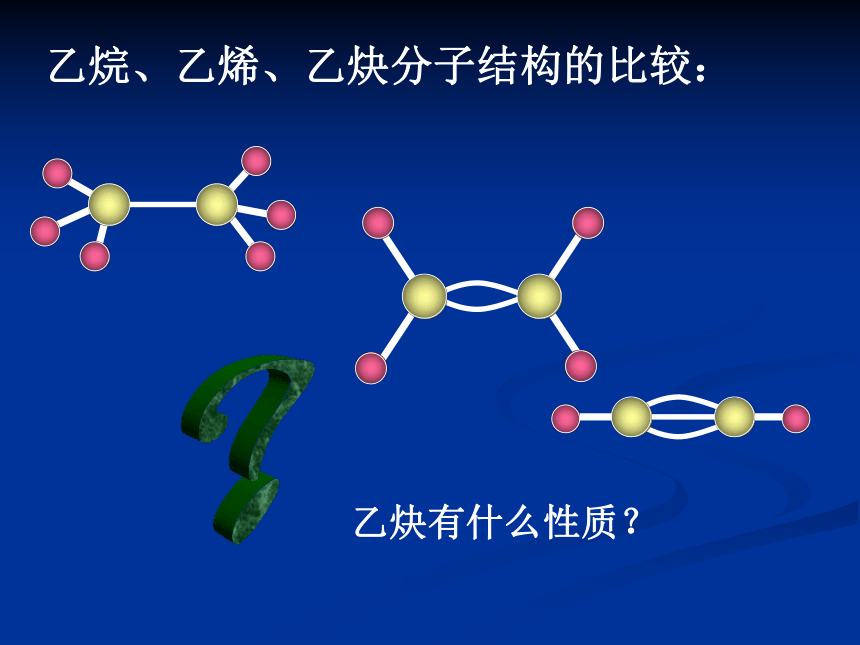
结构简式:C2H2结构特点:分子里有碳-碳叁键(其中含两个不牢固的共价键),键与键之间的夹角是180°,是直线型分子。乙烷、乙烯、乙炔分子结构的比较:?乙炔有什么性质?1、复习乙烯的化学性质
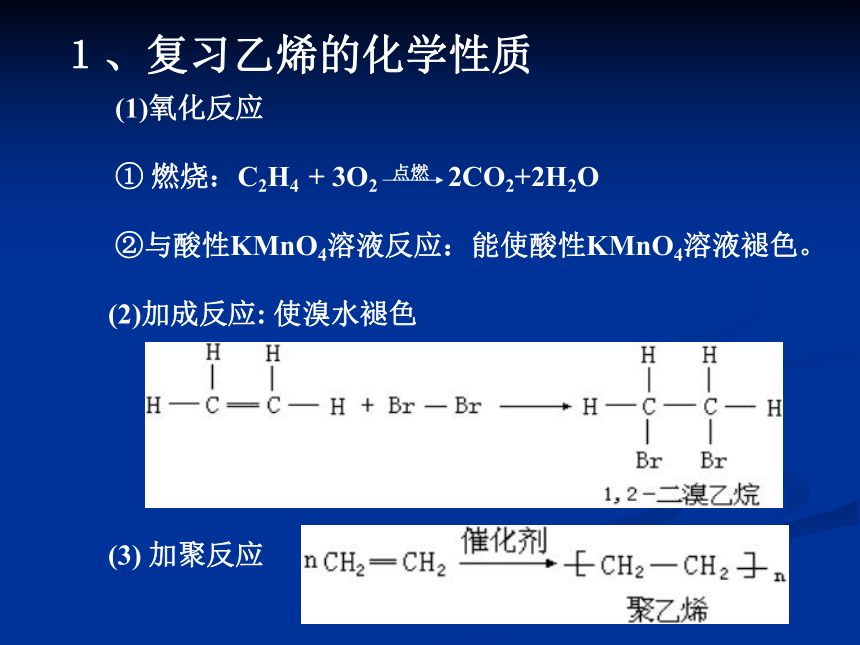
(1)氧化反应
① 燃烧:C2H4 + 3O2 点燃 2CO2+2H2O
②与酸性KMnO4溶液反应:能使酸性KMnO4溶液褪色。
(2)加成反应: 使溴水褪色
(3) 加聚反应
2、实验
① 将乙炔气体通入酸性高锰酸钾溶液中,注意 观察溶液 颜色的变化
②将乙炔气体通入溴的CCl4溶液,注意观察
溶液颜色的变化
③ 收集乙炔气体观察乙炔的物理性质,然后
点燃,观察火焰颜色及燃烧的情况
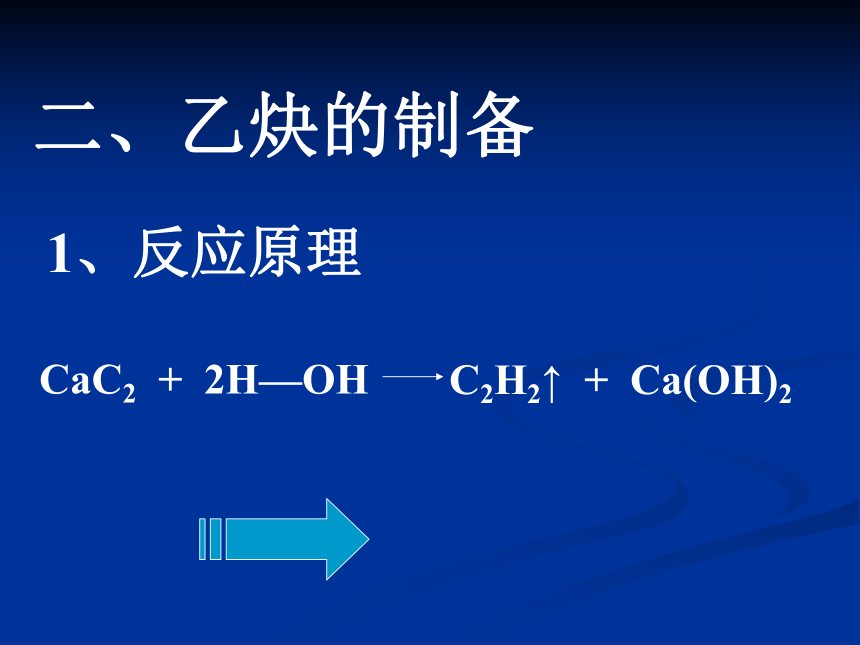
二、乙炔的制备
CaC2 + 2H—OHC2H2↑ + Ca(OH)21、反应原理 纯净的乙炔气体是无色无味的气体。用电石和水反应制取的乙炔,常闻到有恶臭气味,是因为在电石跟水作用时生成的乙炔气体常混有H2S、PH3等气体有特殊的气味所致。
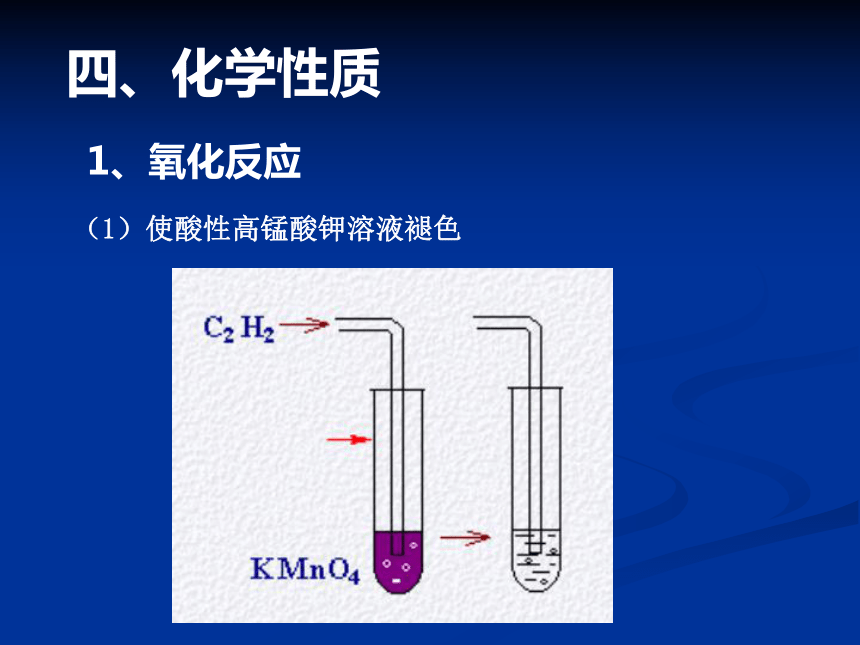
三、乙炔的物理性质四、化学性质1、氧化反应(1)使酸性高锰酸钾溶液褪色(2)可燃性:现象:火焰明亮,带浓烟?为什么乙炔燃烧时生成的黑烟
比乙烯要明显得多? 说明乙炔含碳量比乙烯高,碳没有完全燃烧的缘故。乙炔燃烧时放出大量的热,如在氧气中燃烧,产生的氧炔焰温度很高,可用来焊接或切割金属.氧炔焰枪2.加成反应A.使溴水褪色B.催化加氢C.制氯乙烯、聚氯乙稀3、聚氯乙烯的用途
C 与HX等的反应
聚氯乙烯是一种合成树脂,他在工业上有重要途,可做制塑料和合成纤维,比如塑料薄膜、泡沫、管道、建材和氯伦等。 第一步:CH≡CH+HCl 催化剂 CH2=CHCl(制氯乙烯)△不能使用聚氯乙烯制品直接盛装食品。
第二步:小结1.结构 性质决定反映练习
1、下列烃中,含碳量最低的是( )
A、CH4 B、C2H4 C、C2H2 D、C3H6
2、下列物质中,不能同时使溴水和高锰酸钾溶液褪色的是( )
A、C2H4 B、C3H6 C、CH4 D、C2H2
3、下列有关乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是( )
A、能燃烧生产二氧化碳和水
B、能发生加成反应
C、能与高锰酸钾发生反应
D、能 氯化氢反应生氯乙烯
ACD2.乙烷、乙烯、乙炔性质的比较H-C-C-HHHHHC=CHHHH练习1、如何鉴别乙烷、乙烯、乙炔气体??2、用电石、水、氯化氢为原料,制备聚氯乙烯,写出反应的化学方程式。作业:P130 三谢谢大家
电子式:
结构简式:C2H2结构特点:分子里有碳-碳叁键(其中含两个不牢固的共价键),键与键之间的夹角是180°,是直线型分子。乙烷、乙烯、乙炔分子结构的比较:?乙炔有什么性质?1、复习乙烯的化学性质
(1)氧化反应
① 燃烧:C2H4 + 3O2 点燃 2CO2+2H2O
②与酸性KMnO4溶液反应:能使酸性KMnO4溶液褪色。
(2)加成反应: 使溴水褪色
(3) 加聚反应
2、实验
① 将乙炔气体通入酸性高锰酸钾溶液中,注意 观察溶液 颜色的变化
②将乙炔气体通入溴的CCl4溶液,注意观察
溶液颜色的变化
③ 收集乙炔气体观察乙炔的物理性质,然后
点燃,观察火焰颜色及燃烧的情况
二、乙炔的制备
CaC2 + 2H—OHC2H2↑ + Ca(OH)21、反应原理 纯净的乙炔气体是无色无味的气体。用电石和水反应制取的乙炔,常闻到有恶臭气味,是因为在电石跟水作用时生成的乙炔气体常混有H2S、PH3等气体有特殊的气味所致。
三、乙炔的物理性质四、化学性质1、氧化反应(1)使酸性高锰酸钾溶液褪色(2)可燃性:现象:火焰明亮,带浓烟?为什么乙炔燃烧时生成的黑烟
比乙烯要明显得多? 说明乙炔含碳量比乙烯高,碳没有完全燃烧的缘故。乙炔燃烧时放出大量的热,如在氧气中燃烧,产生的氧炔焰温度很高,可用来焊接或切割金属.氧炔焰枪2.加成反应A.使溴水褪色B.催化加氢C.制氯乙烯、聚氯乙稀3、聚氯乙烯的用途
C 与HX等的反应
聚氯乙烯是一种合成树脂,他在工业上有重要途,可做制塑料和合成纤维,比如塑料薄膜、泡沫、管道、建材和氯伦等。 第一步:CH≡CH+HCl 催化剂 CH2=CHCl(制氯乙烯)△不能使用聚氯乙烯制品直接盛装食品。
第二步:小结1.结构 性质决定反映练习
1、下列烃中,含碳量最低的是( )
A、CH4 B、C2H4 C、C2H2 D、C3H6
2、下列物质中,不能同时使溴水和高锰酸钾溶液褪色的是( )
A、C2H4 B、C3H6 C、CH4 D、C2H2
3、下列有关乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是( )
A、能燃烧生产二氧化碳和水
B、能发生加成反应
C、能与高锰酸钾发生反应
D、能 氯化氢反应生氯乙烯
ACD2.乙烷、乙烯、乙炔性质的比较H-C-C-HHHHHC=CHHHH练习1、如何鉴别乙烷、乙烯、乙炔气体??2、用电石、水、氯化氢为原料,制备聚氯乙烯,写出反应的化学方程式。作业:P130 三谢谢大家
